激素剂量对奶牛同期发情效果的影响
2018-09-26刘立山王彩莲宋淑珍宫旭胤吴建平
刘立山,郎 侠,王彩莲,周 瑞,宋淑珍,宫旭胤,王 斐,吴建平
(1.甘肃省农业科学院,兰州 730070;2.甘肃农业大学动物科学技术学院,兰州 730070)
人工授精技术在提高奶牛繁殖力及奶牛生产性能中发挥着重要作用[1]。在当今奶牛养殖的实际生产中,由于发情鉴定技术的限制以及部分母牛产后卵巢和子宫出现病变,长时间无发情表现[2],严重影响了奶牛卵巢和子宫的复旧,降低了牛群繁殖率[3-5]。而同期发情技术可以实现难孕母牛以及繁殖有障碍的母牛集中发情和配种,达到正常受孕和产犊。定时输精可以使牛的发情时间集中,防止隐性发情造成的漏配现象,降低了劳动强度[6]。因此,同期发情定时输精技术是提高养殖场母牛繁殖效率以及经济效益的重要保证。但是由于奶牛体况的差异,在进行外源激素处理时的效应也有差异[7-9]。
本试验使用不同剂量的PGF2α和GnRH通过同期发情定时输精程序,对荷斯坦奶牛进行同期发情处理,探讨不同剂量的PGF2α和GnRH对奶牛同期发情效果的影响,为人工调控产后母牛的生殖机能障碍性疾病和提高奶牛受胎率提供理论依据。
1 材料与方法
1.1 试验材料
试验于2015年9月在甘肃省临洮县华加牧业科技有限责任公司进行。选择荷斯坦经产牛15头,严格按照牛场的饲养管理进行试验。
1.1.1 试验试剂 PGF2α为PGF2α类似物氯前列醇钠注射液,苏州市苏牧动物药业有限公司生产,规格为2 mL:0.2 mg×10支;GnRH为人工合成促性腺素释放激素,苏州市苏牧动物药业有限公司生产,规格为20 μg×10支,冻干粉针。
1.1.2 试验仪器 CS101-A型电热鼓风干燥箱(重庆实验设备厂),BCD-539WF海尔电冰箱(青岛海尔股份有限公司),5 mL注射器(宣城市江南医疗器械有限公司),爱德士测孕试剂盒(美国爱德士生物科技有限公司)。
1.2 试验设计
试验分别选择体况评分为2.5~4和大于4的荷斯坦奶牛各15头,分别为试验Ⅰ组和试验Ⅱ组。将两组试验牛分别随机分为3个处理组(A、B、C;n=5),进行3种不同剂量PGF和GnRH的同期发情定时输精程序处理(如图1),并进行子宫黏液评分和直肠检测评分,分析奶牛的同期发情率和受胎率,确定同期发情定时输精程序中最适的PGF和GnRH注射剂量(A组每次分别使用0.4 mg PGF2α和 40 μg GnRH;B 组每次分别使用 0.6 mg PGF2α和 60 μg GnRH;C 组每次分别使用 0.8 mg PGF2α和 80 μg GnRH)。
同期发情定时输精程序(4次PGF2α2次GnRH法,简称“4+2法”,如图1):试验开始的当天上午记为0 d,并且在当天上午注射一次PGF2α,14 d后上午注射一次PGF2α,25 d后上午注射一次GnRH,30 d后上午注射一次 PGF2α,31 d 后上午注射一次 PGF2α,33 d 后上午注射GnRH同时进行人工授精。
每次注射激素均在上午9:00,最后一次激素注射后12 h进行人工授精。

图1 “4+2法”同期发情定时输精程序示意图
1.3 测定指标
1.3.1 发情观察 试验期间定时对奶牛进行发情观察,及时记录发情时间及次数。
1.3.2 评分记录 以试验当天记为0 d,并在试验前进行一次子宫黏液评分和直肠检测评分,试验期间每隔7天进行子宫黏液评分和直肠检测评分,并记录统计。子宫黏液评分和直肠检测评分均参照宫艳斌[10]的方法。
1.4 受孕母牛的检测
定时对配种后的母牛进行仔细的返情观察,对未返情的母牛使用爱德士测孕试剂盒进行检测,检测时严格按照试剂盒步骤进行,确定受孕母牛数。
1.5 受胎率计算
受胎率是指配种后受孕母牛数和参配母牛数的比值。
1.6 数据处理
试验数据使用Excel 2010统计数据,通过SPSS 19.0软件中的单因素方差分析对数据进行统计分析和显著性检验,结果以平均值±标准差表示。
2 结果与分析
2.1 发情情况
由表1可知,试验Ⅰ组中的3个处理组试验奶牛发情主要集中在第5次注射激素后,发情率分别为40%、80%、60%,也是发情高峰期。其中A处理组中第1次和第4次注射激素后均未发现有发情牛,第5次注射激素后发情率最高达到40%;B处理组中每次注射完激素后均观察到发情牛,第5次注射激素后发情率最高达到80%;C处理组中除了第4次注射激素后未发现有发情牛外,其余4次注射激素后均发现有发情牛,并且第5次注射激素后发情率最高达到60%。试验Ⅱ组中的3个处理组试验奶牛发情同样主要集中在第5次注射激素后,并且第5次注射激素后发情率逐渐升高,分别为20%、40%、80%。其中,A处理组中除第3次和第5次注射激素后发情率均为20%外,其余3次注射激素后均未发现有发情牛;B处理组中第1次注射激素后未发现有发情牛,其余4次发情率分别为20%、20%、20%、40%;C处理组中每次注射完激素后均观察到有发情,发情率分别为20%、20%、40%、20%、80%,第5次注射激素后发情率达到了最高。由此可知,试验Ⅰ组中B处理组奶牛同期发情率最高,为80%;试验Ⅱ组中A、B、C三个处理组最终的同期发情率逐渐升高,其中C组处理最高,为80%。
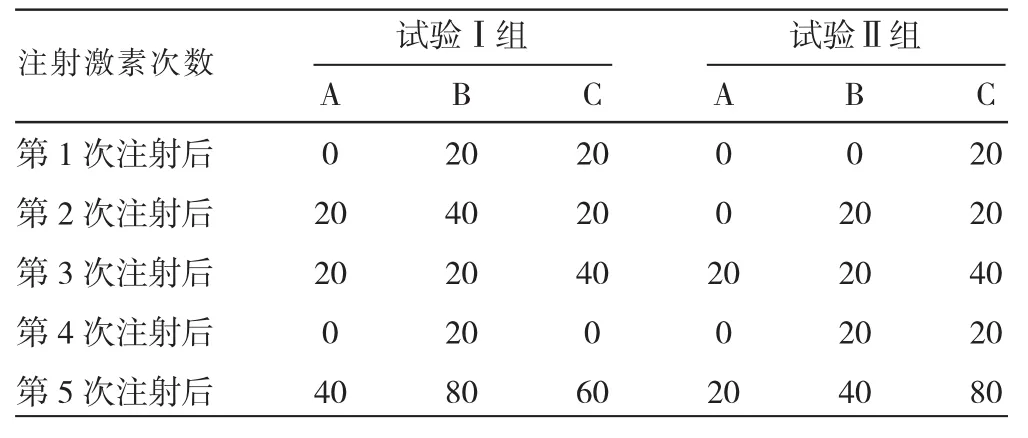
表1 发情率%
2.2 评分统计
2.2.1 子宫黏液评分 如表2所示,试验Ⅰ组中的A处理组和C处理组在试验过程中子宫黏液评分无显著变化,A处理组整体呈现升高趋势(P>0.05),第35天时子宫黏液评分为3.48。C处理组整体呈现降低趋势(P>0.05),第35天时子宫黏液评分为3.15。B处理组整体呈现升高趋势,在第28天时子宫黏液评分显著升高(P<0.05),第35天时达到4.05。试验Ⅱ组中A处理组在试验过程中子宫黏液评分无显著变化(P>0.05),第35天时子宫黏液评分为3.38,B、C两个处理组整体呈现升高趋势,B组在试验第35天时子宫黏液评分显著升高,达到3.75(P<0.05),C组在第28天时子宫黏液评分显著升高到3.84(P<0.05),第35天时子宫黏液评分达4.12(P<0.05)。
2.2.2 直肠检测评分 如表3所示,试验Ⅰ组中的A处理组在试验过程中直肠检测评分无显著变化(P>0.05),A处理组整体呈现升高趋势(P>0.05),第35天时直肠检测评分为3.26;B处理组在第14天时直肠检测评分显著升高到 3.25(P<0.05),第 35 天时升高到 3.45;C 组整体呈现降低趋势,第35天时直肠检测评分显著降低到2.76(P<0.05)。试验Ⅱ组中的A处理组和B处理组在试验过程中直肠检测评分无显著变化(P>0.05),第35天时直肠检测评分分别为3.13和3.20;C处理组直肠检测评分整体呈现升高趋势,在第35天时显著升高到3.54(P<0.05)。

表2 子宫黏液评分

表3 直肠检测评分
2.3 受胎率
如表4所示,试验Ⅰ组中的A、B、C三个处理组受胎率分别为40%、60%、20%,其中B处理组最高。试验Ⅱ组中A、B、C三个处理组受胎率分别为0%、20%、60%,其中C处理组最高。

表4 受胎率统计
3 讨论
激素不仅是动物体内重要的组成部分,而且参与机体新陈代谢、繁殖机能和免疫机能[11-12]。吴长明等[13]报道,微量元素是体内许多酶、激素、维生素的组成成分或活性因子,在奶牛的繁殖生理中起着重要作用。若机体缺乏会引起性功能障碍,在雌性动物发情周期的一定时期,通过注入外源性激素来提高血液中促性腺激素浓度,从而降低发育卵泡的闭锁,增加早期卵泡发育到成熟卵泡的数量,从而使雌性动物每次排卵数增加[14]。李子义等[15]在研究不同激素剂量对幼鼠超数排卵及超排卵质量的影响时发现,不同激素剂量对小鼠排卵数有不同的影响,小鼠对超排激素的耐受性是有一定阈值的,适量的激素剂量可以获得更多的可移植胚胎,如果剂量小可能出现卵母细胞数量少,卵母细胞成熟率高;反之,如果激素剂量大,卵母细胞数量较多,但可能出现卵母细胞成熟率低。因此,外源激素对奶牛排卵也有着重要的影响,进而影响奶牛的繁殖性能。冯雨峰等[16]采用4种不同激素剂量组合处理小鼠,结果表明小鼠对超排激素的耐受性是有一定阈值的。剂量过低,超排激素不能满足较多卵母细胞发育的需要,排卵数量下降,而剂量过高又易引起卵泡囊肿。高建明等[17]和高善颂等[18]也得出类似结论。外源激素是通过卵泡膜细胞上的FSH和LH受体来发挥促卵泡生长的作用,只有卵泡发育至窦卵泡前期时,颗粒细胞才会出现特异的FSH表达,此时卵泡已经完成由卵泡池中的始基卵泡的募集过程[19]。当外源注射激素时,便减少了已募集的卵泡发生闭锁,进而使更多的同簇卵泡生长发育。
在试验Ⅰ组中,C处理组受胎率最低,这与它们的同期发情率低以及子宫粘液和直肠检测评分较低相对应。C处理组比A处理组同期发情率高,但受胎率却相同,其原因主要是C处理组的激素剂量过大,导致了奶牛子宫和卵巢的萎缩,这也是C处理组直肠检测评分显著降低的主要原因,这与冯雨峰等在不同剂量激素对小鼠卵巢和子宫影响的研究结果一致[20]。B处理组同期发情率最高,子宫黏液评分和直肠检测评分也显著升高,这也表明卵巢和子宫功能恢复到正常,对卵巢和子宫复旧有积极的作用,因此受胎率也达到最高。在试验Ⅱ组中,A处理组的受胎率为0,这可能主要是激素剂量太小,没有启动子宫和卵巢的正常生理机能,A处理组子宫黏液评分和直肠检测评分较低也体现了子宫和卵巢功能的异常,因此同期发情率也相应较低。随着外源激素剂量的增加,受胎率也相应升高。C处理组受胎率最高,为60%,子宫黏液评分和直肠检测评分也有显著改善。本研究结果表明,低剂量和高剂量激素对奶牛繁殖率均有不同程度的影响,这种影响根据奶牛的体况评分不同而异。奶牛体况评分是衡量奶牛体组织储存状况及监控奶牛能量平衡的一种方法[21]。据Lopez等[22]报道,奶牛发生停止排卵的情况和体况评分的之间有较强的相关性。奶牛体况是奶牛饲养及营养代谢正常与否的反映,也是奶牛健康与否的标志之一,对生产性能、经济效益、健康状况、产奶周期均有非常重要的影响[23]。因此,在奶牛养殖过程中需要提高科学的营养管理技术,维持奶牛适宜的体况评分,提高繁殖力和控制疾病,从而增加效益。
4 结论
本试验中使用PGF和GnRH两种外源激素,通过同期发情定时输精程序发现,根据奶牛体况评分不同使用不同剂量的外源激素具有较好的同期发情定时输精效果。对于体况评分在2.5~4.0之间的适中奶牛,PGF2α和GnRH的剂量分别为0.6 mg和60 μg时,通过同期发情定时输精程序使得奶牛的发情时间最为集中,同期发情效果最理想,受胎率最高,对于体况评分高于4.0的较肥奶牛,PGF2α和GnRH的剂量分别为0.8 mg和80 μg时,同期发情定时输精效果较优。
