基于焓变计算的几种考查方式
2018-09-22钟舜方
钟舜方
(福建省沙县第一中学 365050 )
焓变计算是对化学反应及能量变化知识考查的重要题型之一,本文就几种常见的考查方式例析如下.
一、利用盖斯定律求焓变
首先根据所求反应的方程式中各物质的系数,将已知热化学方程式整体乘以相应的系数,然后进行加减合并.若合并后出现负号则移项,使各物质的系数与所求的方程式完全相同即可.
例1 已知:①甲醇脱水反应

ΔH1=-23.9kJ·mol-1
②甲醇制烯烃反应

ΔH2=-29.1kJ·mol-1
③乙醇异构化反应

ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应
C2H4(g)+H2O(g)=C2H5OH(g)
的ΔH= kJ·mol-1.
解析通过观察已知热化学方程式与所求热化学方程式,再由盖斯定律可知:①-②-③可得到此热化学方程式

所以ΔH=①-②-③=-23.9 kJ/mol-
(-29.1 kJ/mol)-50.7 kJ/mol=-45.5kJ/mol.
二、利用化学键键能求焓变
由于化学反应的实质是反应物旧化学键断裂要吸收能量,生成物新化学键形成要释放能量,所以反应的焓变ΔH=反应物各物质的总键能-生成物各物质的总键能.
例2 SF6是一种优良的绝缘气体,分子结构中只存在S—F键.已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F—F 、S—F键需吸收的能量分别为160 kJ、330 kJ.则S(s) + 3F2(g)=SF6(g)的反应热ΔH为( ).
A.-1780kJ/mol B. -1220 kJ/mol
C.-450 kJ/mol D. + 430 kJ/mol
解析由题意的1mol S(s)和3 mol F2(g)形成硫原子和氟原子共需要吸收能量是280 kJ+3×160 kJ=760 kJ.而生成1mol SF6(g)时需形成6 mol S—F键,共放出6×330 kJ=1980 kJ,因此该反应热ΔH=760 kJ/mol-1980kJ/mol=-1220kJ/mol,故选项B正确.
三、利用能量变化图像求焓变
根据反应物具有的总能量与生成物具有的总能量之前的关系判断:反应物具有的总能量高于生成物具有的总能量,该反应为放热反应.反应物具有的总能量低于生成物具有的总能量,该反应为吸热反应.
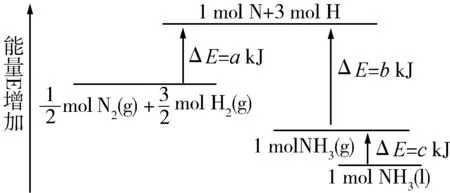
例3 氮气与氢气化学反应的能量变化图如图所示,写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式 .

变式1 P和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)根据图回答下列问题.
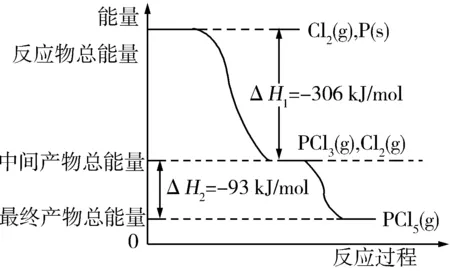
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
解析(1)根据图可知:

反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为ΔH=-306 kJ/mol,则热化学方程式为:


PCl5(g)=PCl3(g)+Cl2(g)
是吸热反应;热化学方程式为
PCl5(g)=PCl3(g)+Cl2(g) ΔH=+93 kJ/mol
四、利用燃烧热求焓变
燃烧热是在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量.
例4 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为____;
解析由题可知,先写出燃烧热的热化学方程式如下:

ΔH=-283.0kJ·mol-1①
CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)
ΔH=-726.5kJ·mol-1②
用②-①得到

五、利用中和热求焓变
中和热是指在稀溶液中,强酸跟强碱发生中和反应生成1mol液态H2O时的反应热.
例5 分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃).实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃.则实验测得的中和热ΔH= (保留1位小数).
解析先根据Q=m·c·ΔT计算反应放出的热量,然后根据ΔH=Q/nkJ·mol-1计算出反应热.
n(H2O)=0.1 L×0.5 mol=0.05 mol
m(aq)=200 mL×1g/mL=200 g
ΔT=24.9℃-21.5℃=3.4℃,
Q=m·c·ΔT=200 g×4.18J/(g·℃)×3.4℃=2842.4 J=2.842kJ
ΔH=Q/n=-2.842 kJ/0.05 mol=-56.8 kJ·mol-1
六、利用多种能量综合求焓变
例6 室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O受热分解的化学方程式为:

热效应为ΔH3,写出ΔH1、ΔH2、ΔH3之间的关系.
解析先分别写出ΔH1、ΔH2、ΔH3对应的热化学方程式:



由盖斯定律可得:①-② =③,即ΔH1-ΔH2=ΔH3.
因此,同学们要熟练掌握以上几种焓变计算的考查方式,这对解题会起到事半功倍效果.
