神农架国家公园林线过渡带土壤真菌多样性
2018-09-19盛玉钰杨开华杨林森张于光
盛玉钰,丛 静,卢 慧,3,杨开华,杨林森,王 敏,张于光,*
1 中国林业科学研究院森林生态环境与保护研究所,国家林业局森林生态环境重点实验室,北京 100091 2 青岛大学附属医院,青岛 266061 3 中央民族大学,生命与环境科学学院,北京 100081 4 神农架国家公园管理局,神农架金丝猴保育生物学湖北省重点实验室,神农架林区 442411
林线过渡带是高山郁闭森林到矮曲林之间的生态过渡带[1],是高山垂直植被带的重要生态过渡区,是陆地生态系统对气候变化响应的敏感区域[2- 4]。研究表明,气候变化使林线过渡带位置出现向上、不变或向下等不同的响应趋势,表明林线动态变化的影响机制复杂多变[5]。目前,有关林线区植被格局和气候变化响应[6- 8]、凋落物分解[3]、土壤碳氮循环[9]、幼苗建植[10]等方面已有较多研究报导,但关于林线土壤微生物的研究相对较少,且多限于微生物的降解活性[11]、土壤细菌多样性[12],忽略了其土壤真菌群落结构组成和形成机制,造成林线土壤微生物的理论体系有大部分的缺失。本研究将将致力于完善整个林线土壤微生物生态系统理论。
真菌是土壤微生物的主要组成部分,不仅可以有效降解土壤中复杂组分和凋落物,还可以监测土壤病理过程、驱动养分循环和能量流动,是陆地生态系统的重要健康指标[13- 15]。然而,采用传统方法分离出的真菌种类和数量却很有限[16],难以全面和准确了解真菌群落的真实组成和分布情况。随着分子生物学的快速发展,特别是高通量测序技术的应用,人们对土壤微生物的研究和认识日渐深入。大量研究表明环境选择是微生物群落结构形成和变化的重要影响因素,土壤真菌适宜在酸性土壤中生长[17],对土壤湿度[18]、温度[13,19]、养分含量[20-21]以及不同的土壤层环境[22]十分敏感,且不同林型对应着不同的优势菌群[23],不同地区的主要影响因子也可能存在不同。研究林线土壤真菌群落结构组成的影响机制,将为神农架国家公园(Shennongjia National Park, SNP)的建设政策提供生态理论指导。
神农架国家公园是目前世界中纬度地区唯一保存完好的亚热带森林生态系统,其独特的地理和气候条件孕育了丰富的生物资源[24],具有明显的高山林线过渡带分布特征,为开展林线过渡带微生物多样性及其形成机制研究提供了理想的场所[12]。本研究选择神农架国家公园中林线上、下的灌木林和针叶林为研究对象,采用Illumina高通量测序技术,旨在探讨:(1)林线上、下的灌木林和针叶林的真菌群落结构组成情况;(2)影响林线过渡带土壤真菌多样性的主要环境因子。
1 研究方法
1.1 样地设置与土壤样品采集
神农架国家公园位于湖北省西北部神农架林区的西南部。神农架(31°15′—31°57′N,109°59′—110°58′E)的神农顶高达3105.4 m,为华中地区最高峰[25]。属于亚热带季风气候,四季变化明显。年平均气温为7.2℃,年均降水量为1500 mm[26]。神农架国家公园具有典型的植被带分布特征,从低海拔到高海拔分别为常绿阔叶林、落叶阔叶林、针阔混交林、针叶林和灌木林,其中灌木林植物盖度较低且海拔分布为2736—2777 m,针叶林植物盖度较高且海拔分布为2530—2590 m。在灌木林中,乔木层和灌木层的优势植物物种分别是粉红杜鹃(Rhododendronoreodoxa)和神农箭竹(Fargesiamurielae),在针叶林中的优势植物物种是巴山冷杉(Abiesfargesii)。神农架国家公园的灌木林和冷杉林具有明显的林线。
在神农架国家公园的灌木林和针叶林中分别设立采样点,记录各采样点的海拔、坡度、植被等信息(表1)。在每个样地,连续设置9个20 m×20 m的样方,样方之间间隔约20 m。每个样方内以对角线五点取样法设置5个5 m×5 m的小样方,用土钻(直径4 cm)采集0—10 cm的土壤样品10—15钻,去除凋落物和碎石等,经过2 mm孔筛后分装,带回实验室进行进一步分析或低温保存备用。一部分(约100 g)置于-80℃超低温冰箱,用于DNA提取,另一部分(约500 g)4℃保存,用于土壤理化性质测定。

表1 神农架国家公园土壤采集点基本情况
1.2 土壤理化性质和植物参数的测定
土壤理化性质采用常规方法进行测定[27]。包括pH计测定土壤pH,烘干法测定土壤含水量,水溶解法测定水溶性有机碳,凯氏定氮法测定全氮,碱解扩散法测定有效氮,离子体发光色谱仪测量全磷、速效磷含量。采用温度探测仪测量土壤层10 cm温度。分别调查两个林型中的乔木层(胸径 ≥ 5 cm)和灌木层(胸径≤5 cm)的植物,记录其种名、数量、高度、盖度及多度等指标。
1.3 土壤微生物基因组DNA提取、纯化和定量
利用试剂盒E.Z.N.A.® Soil DNA Kit(OMEGA, Bio-tek, USA)提取和纯化土壤微生物DNA,通过NanoDrop ND- 1000分光光度计测量DNA溶液的浓度。DNA浓度和纯度达到以下标准:每个DNA样品浓度最低达25 ng/μL,满足A260/280处于1.8—2.0之间且A260/230>1.7。
1.4 Illumina测序和测序数据预处理
本试验通过Illumina测序平台检测rDNA ITS2基因片段序列,利用Galaxy平台(http://mem.rcees.ac.cn:8080)对测序原始数据进行预处理,分析两个样地中的土壤真菌物种组成情况。
采用gITS7F(正向引物5′-GTGARTCATCGARTCTTTG-3′)和ITS4R(反向引物5′-TCCTCCGCTT ATTGATATGC- 3′)[28]对真菌的ITS2区段进行扩增,其中反向引物中标有不同序列的Barcode,用于区分样品。PCR扩增体系(50 μL)包括5 μL 10×Taq缓冲液,1.5 μL dNTP混合物,0.5 μL Taq酶,2 μL牛血清白蛋白(5 mg/mL,酶保护剂),1 μL正向引物,1 μL反向引物,1 μL DNA溶液(约25 ng/μL)和38 μL ddH2O。PCR反应条件为94℃预变性1 min,35个循环(94℃变性20 s, 56℃退火25 s,68℃延伸45 s),68℃终延伸10 min。利用3%的凝胶电泳检测并回收DNA样品,通过试剂盒E.Z.N.A.® Gel Extraction Kit(OMEGA,Bio-tek,美国)纯化DNA样品,重新测量其浓度和纯度。纯化后的DNA样品按照光密度值和浓度进行混合,Qubit定量,建库,将混合样品与PhiX于96℃变性2 min,置于冰水混合物中5 min,最后将样品放入试剂盒MiSeq Reagent Kit(Illumina, San Diego, CA, USA)进行2×250 bp双末端上机测序。
分别将原始序列文件以及样品与Barcode对应文件上传至数据平台,区分样品、去除引物(容纳1.5%不匹配率)。按照Flash[29]算法拼接序列(最小重叠片段长度为30 bp)。利用Btrim删除质量低于20的序列[19],Trim N删除长度低于200 bp或含有模糊碱基的序列(N)。根据序列长度分布情况,将其剪切至240—350 bp。Uchime[30]去除嵌合体之后,按照Uclust算法和97%的相似度对可操作分类单元(Operational Taxonomic Units, OTUs)进行聚类分析。采用RDP classifier(50%可信度)在真菌ITS UNITE 数据库中比对物种信息。本研究将每个样品的OTUs之和标准化为10000,每个样品的OTUs丰度为该样品的单元格/10000的百分比。
1.5 数据分析
利用Excel对试验数值进行初步分析;植被多样性采用Shannon指数和Richness指数表征;真菌多样性采用Shannon指数、Chao值和Richness指数表征;基于R 3.1.2的vegan包或者在线分析网站(http://www.ou.edu/ieg/)进行下列数据分析。通过除趋势对应分析(Detrended correspondence analysis,DCA)和不相似性检验(Dissimilarity test)检测样地的群落结构组成差异;利用皮尔逊相关性分析(Pearson correlation test)、典范对应分析(Canonical correspondence analysis,CCA)和Mantel分析,得出影响真菌群落结构组成的主要环境因子,其中CCA中为避免出现严重的共线性,要求环境因子的方差因子(Variance inflation factor,VIF)必须小于20[28];利用Origin 8.5作图。利用IBM SPSS Statistics 21进行皮尔逊相关性分析和独立样本T检验。
2 结果与分析
2.1 土壤理化性质和植物多样性分析
从测得的土壤营养指标来看(表2),灌木林的土壤养分总体高于针叶林,全磷和有效磷含量具有显著差异(P< 0.01),有机碳、可溶性有机碳、全氮和有效氮含量无显著差异。在灌木林和针叶林样地采集的土壤样品均呈酸性,但针叶林土壤pH显著高于(P< 0.001)灌木林土壤。与灌木林相比,针叶林土壤温度偏低,湿度偏高,且温湿度差异显著(P< 0.001)。针叶林的胸径、乔木层株高、灌木层植物密度、植物多样性和物种数目显著(P< 0.001)高于灌木林。

表2 土壤理化性质、植被多样性和真菌多样性指数
数据表示形式均为平均值±标准误,P值通过独立样本T检验得出
2.2 土壤真菌群落结构和多样性

图1 灌木林和针叶林土壤真菌群落结构组成在门水平上的比较Fig.1 Comparison of the soil fungal community compositions in shrub and coniferous forests on level of phyla
通过Illumina测序,共得到2786条不同的ITS2区OTUs,样本的序列条数分布在13547—40799之间。按照10000的值重新取样,从灌木林土壤样品中检测出1288个OTUs,从针叶林土壤样品中检测出2027个OTUs。通过分析,发现这两个样地土壤中存在子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridimycota)和球囊菌门(Glomeromycota)等5个门的真菌,包括226个属和553个种。在门水平上,担子菌门(P= 0.003)和接合菌门(P= 0.002)的丰度在两样地之间差异极其显著(图1),壶菌门和球囊菌门的丰度不足1%,与未知菌门(Unclassified)归为其他(Others)。在灌木林土壤中的优势真菌为接合菌门(55.86%),优势菌属为被孢霉属Mortierella(35.07%)(表3),优势菌种为Mortierella_humilis|SH218044.06FU(26.15%)(表4);而在针叶林土壤中的优势真菌为担子菌门(67.38%),优势菌属为隐球菌属Cryptococcus(27.12%),优势菌种为Cryptococcus_terricola|SH215219.06FU(26.96%)。在担子菌门中,针叶林土壤中的丝膜菌属(Cortinarius)、丝盖伞属(Inocybe)、红菇属(Russula)和蜡壳耳属(Sebacina)的丰度显著高于灌木林。
针叶林土壤真菌的Shannon指数、Chao值和richness指数均显著高于(P< 0.05)灌木林(表2)。DCA显示两个林型的真菌群落结构(β多样性)差异显著(图2),不相似性检验(基于Bray-curtis和manhattan距离方法)进一步证实这两个林型的真菌群落结构存在显著差异(表5)。
上述结果表明,灌木林和针叶林在土壤真菌群落结构组成上存在显著差异,且针叶林的土壤真菌多样性显著高于灌木林。
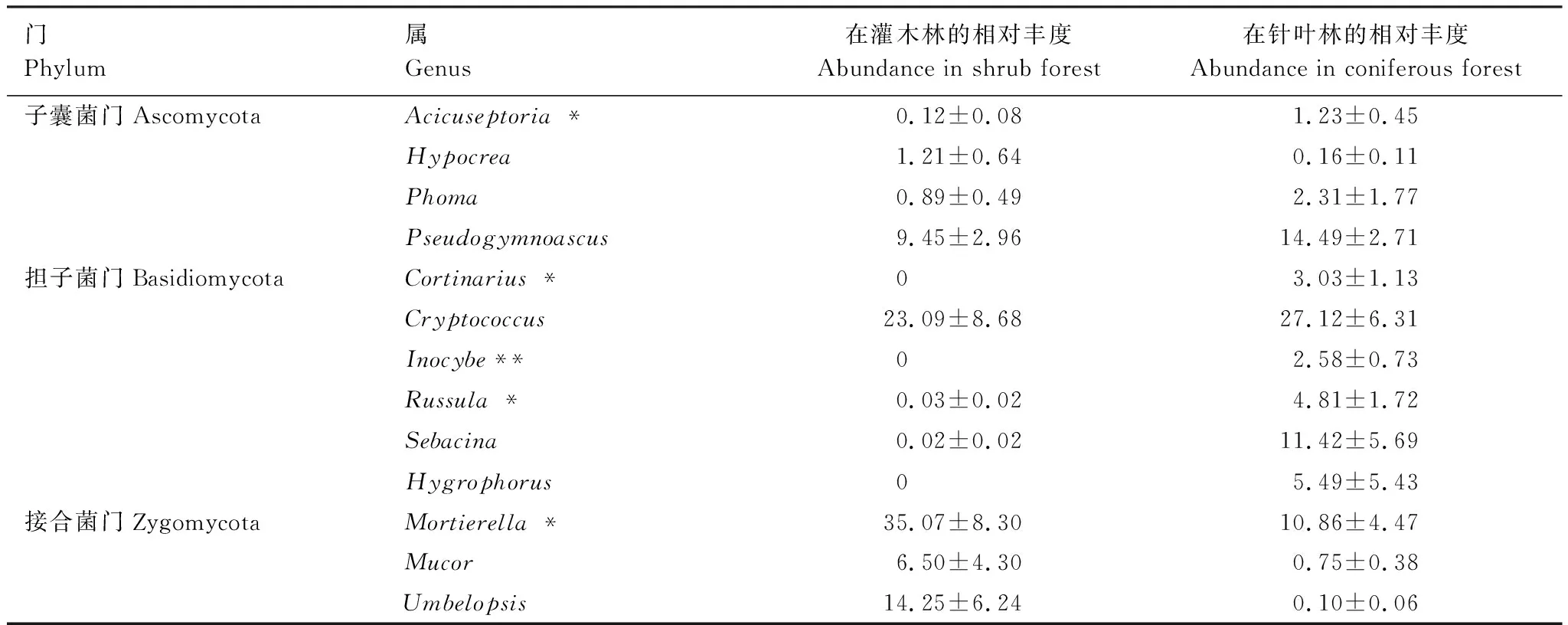
表3 两种林型中相对丰度大于1%的土壤真菌属
*表示独立样本T检验的P值 < 0.05,**表示独立样本T检验的P值 < 0.01;数值形式: 平均值±标准误

表4 两种林型中相对丰度大于1%的土壤真菌种
*表示独立样本T检验的P值 < 0.05,**表示独立样本T检验的P值 < 0.01. 数值形式: 平均值±标准误

图2 灌木林和针叶林土壤真菌群落组成除趋势对应分析Fig.2 Detrended correspondence analysis of soil fungal community compositions in shrub and coniferous forests
2.3 影响土壤真菌群落变化的主要环境因子
通过CCA初步分析与真菌群落结构组成相关的环境因子,利用方差膨胀因子分析(VIF < 20)共选入7个环境因子:可溶性有机碳、土壤温度、全磷、全氮、土壤pH、植物多样性指数、土壤湿度。按照环境因子在CCA1轴的投影长度得知,土壤pH、植物多样性、土壤温度和土壤湿度是影响真菌群落组成的重要环境因子(图3)。利用Mantel分析(表6),综合R值和P值可以看出,土壤pH对土壤真菌多样性的影响最高,植物多样性次之,土壤湿度和土壤温度对土壤真菌的类群也有明显的影响。

表5 灌木林和针叶林的土壤真菌群落组成的不相似性检验
MRPP: 多响应置换过程分析, multiple response permutation procedure; Anosim, 相似性分析, analysis of similarities; Adonis, 多元方差分, permutational multivariate analysis of variance; Delta: 该组平均距离, the group mean distance; Bray-curtis, 布雷柯蒂斯距离方法, Bray-curtis diastance method; Manhattan: 曼哈顿距离方法, Manhattan distance method

表6 土壤真菌全部OTUs、重要真菌门与环境因子的Mantel分析
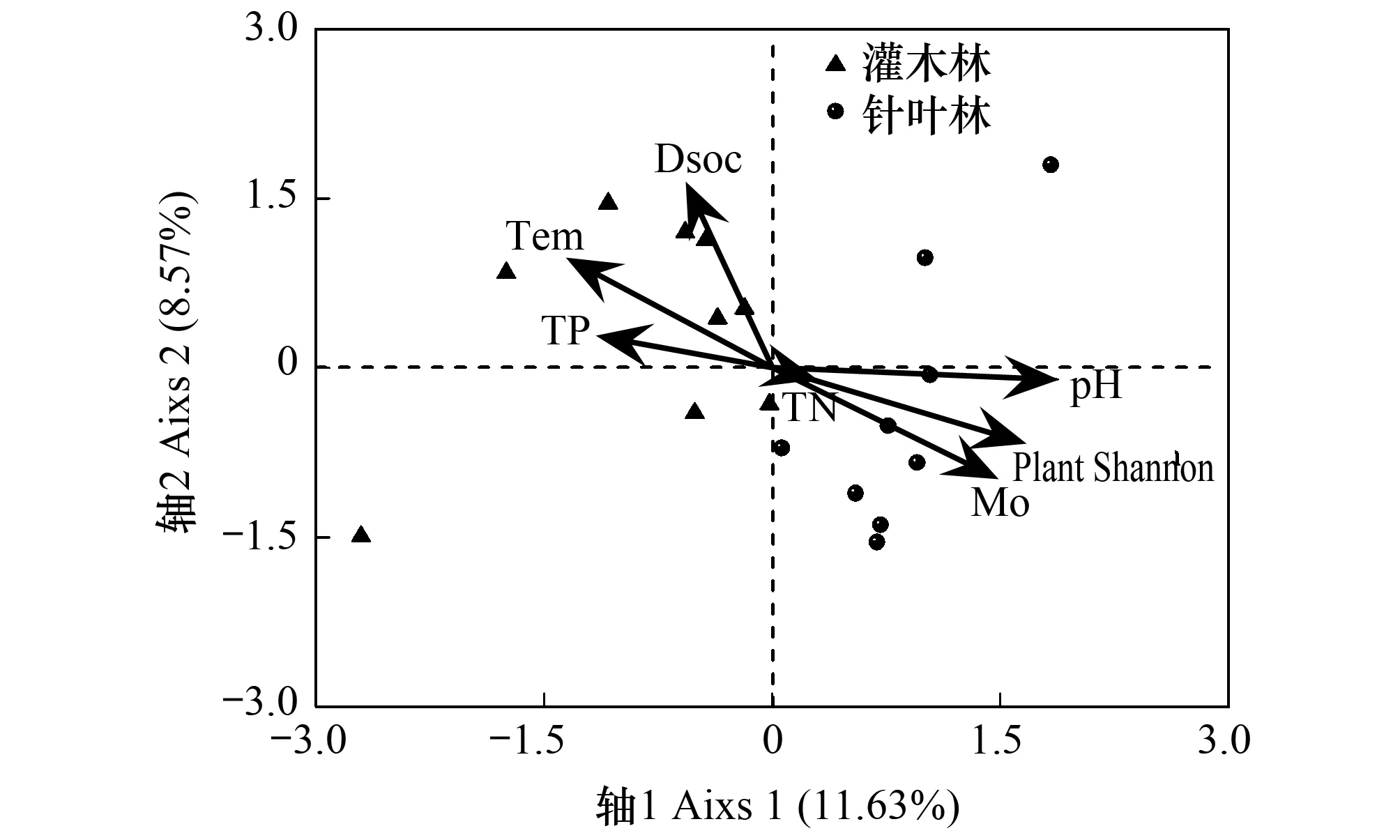
图3 灌木林和针叶林土壤真菌群落组成与环境因子间的典范对应分析Fig.3 Canonical correspondence analysis between soil fungal community compositions and environmental factors in shrub and coniferous forestsDsoc: 水溶性土壤有机碳, dissolved soil organic carbon; Tem: 土壤温度, soil temperature; TP: 全磷, total phosphorus; TN: 全氮, total nitrogen; pH: 土壤酸碱度; Mo: 土壤湿度, soil moisture; Plant Shannon: 植物香农指数, plant Shannon index
3 讨论
通过对神农架国家公园灌木林和针叶林土壤真菌多样性的分析,发现担子菌门为针叶林土壤真菌的优势类群。有研究表明,担子菌门在土壤木质素含量较高的环境中占优势,是最主要的分解者[31],本研究中针叶林植被多样性指数较高,土壤中木质素相对较多,是担子菌门的重要生存来源。丝膜菌属(Cortinarius)、丝盖伞属(Inocybe)、红菇属(Russula)和蜡壳耳属真菌(Sebacina)属于外生菌根真菌,且在针叶林中丰度显著高于灌木林。菌根真菌是植物菌根和真菌的共生体,在凋落物分解、养分循环和能量流动中具有重要作用[18],其联结形成的网络系统降低了不利物种的优势地位,促进优势担子菌与针叶树植物共生[32]。灌木林中土壤真菌的优势真菌类群为接合菌门,与Wallenstein等研究结果一致[33]。被孢霉属(Mortierella)是土壤习居菌,往往健康植物土壤中丰度更高[34],本研究发现该属真菌为灌木林土壤优势真菌,表明神农架国家公园灌木林土壤更健康。
植被的类型决定了凋落物数量和质量的不同[23]。除了微生物对土壤有机质的降解和转化,植被类型的凋落物特点[35]及其对雨水的截留能力的不同,在一定程度上影响着土壤表层有机质含量的变化。针叶林中巴山冷杉等树木的小型叶占优势[36],凋落物积累量较低,导致针叶林对雨水的拦截能力相对较弱,土壤含水量高,土壤碳氮流失较多,与赵溪等结果一致[35]。而灌木林中粉红杜鹃等树木的叶片宽大,单位面积凋落物积累量较高,使灌木林具有较强的雨水拦截能力,土壤含水量较低,表层的有机物流失较少,土壤中碳氮含量较高。且针叶林植被叶表面含难降解的腊质,而灌木林的植被凋落物相对容易降解,产生有机质输入土壤,维持灌木林土壤的碳氮含量,秦嘉海也表明祁连山的灌木林土壤有机质含量比当地针叶林高[37]。
土壤pH是影响真菌群落结构组成的重要环境因子,对土壤真菌的生长繁殖以及胞外酶的分泌均具有显著影响[38]。真菌一般在酸性条件下占优势[17-18],Nevarez等发现真菌生长最适pH为5.5[39]。本研究调查的两个林型的土壤pH < 5.5,为酸性环境,适宜真菌生长。本研究也发现土壤真菌多样性与pH值呈显著正相关,与乔沙沙等研究相同[18]。
目前,关于植物多样性与土壤真菌群落结构之间的相关性还没有一致的定论。有研究表明,植物多样性对土壤真菌群落结构在小尺度上具有很明显的相关性,但在大尺度上相关性却很低,这可能是在大尺度上气候因子的影响掩盖了植物因子的影响[40]。也有研究表明,植物多样性与土壤真菌多样性不相关[41],这可能是功能冗余[42]或者独特的植物物种在物质循环中有重要作用[43]造成的。本研究中,CCA和Mantel分析显示,真菌多样性与植物多样性呈显著正相关关系。覆盖土壤的不同植被类型影响土壤真菌多样性,一方面是因为不同植被类型产生不同的根际分泌物,影响土壤真菌群落的组成和分布;另一方面是植物与某些土壤真菌具有共生关系,如菌根关系,从而提高了共生菌的丰度,但抑制了其他真菌的生命活动,从而影响真菌的群落组成多样性[18, 23]。高林线的强烈太阳辐射对幼苗生长具有严重的限制作用[44],本研究中针叶林的乔木层胸径、株高以及灌木层株数显著高于灌木林,这可能是因为高海拔、低郁闭度的灌木林得到了较多的太阳辐射,且低温条件下的强光造成的低温光抑制作用降低了生长季的光合作用[5],其植物生长受到更多限制,而低海拔、高盖度的针叶林则没有受到强光造成的太大影响,形成针叶林的胸径、株高和物种数目高于灌木林的结果,影响着土壤真菌多样性。
森林林线过渡带的形成一般与温度存在很大关系[5],本研究显示温度与土壤真菌群落结构显著相关,说明温度也是控制林线处土壤真菌群落结构的重要环境因子,Ding等也认为温度是控制林线处土壤细菌多样性的主要环境因子[12]。林线处的郁闭林温度比其临近的高海拔林区温度更低[8],本研究的灌木林的土壤温度显著高于较低海拔的针叶林,这可能与针叶林植株茂密程度显著高于灌木林有关,灌木林郁闭度低,白天光照产生的热量能较多存储在土壤中,而高郁闭度的针叶林一定程度上阻挡了光照,热量较难进入针叶林土壤层,昼夜温差会比灌木林小,一定程度上可以维持和稳定土壤真菌的生命活性。温度变化通常会改变微生物细胞酶的活性,影响细胞生长和分化机制,从而影响微生物多样性[2, 19]。基于林线过渡带在全球气候变化中的重要指示作用,研究其地下微生物在气候和土壤条件变化下的响应,为人们对冻害的防治和林线的动态预测提供了一定的理论依据。
