2016过敏性疾病机制研究进展
2018-09-06MarcRothenbergMDPhDHirohisaSaitoMDPhDandStokesPeeblesJrMD
Marc E.Rothenberg, MD, PhD, Hirohisa Saito, MD, PhD, and R.Stokes Peebles, Jr, MD
翻译:李俊达 中国医学科学院 北京协和医学院 北京协和医院变态(过敏)反应科
本文着重综述2型固有淋巴样细胞(type 2 innate lymphoid cells,ILC2s)、CD4+Th2淋巴细胞、类二十烷酸对炎症的调节、变态反应应答中的胞外膜泡、白细胞介素(interleukin,IL)-33、微生物组学特征及其与黏膜屏障功能的关系和变态反应性炎症细胞(嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞)相关机制的研究进展。虽然本篇综述广泛地覆盖了这些领域,但内容均集中于2016年发表在《变态反应与临床免疫学杂志》的文章。希望这篇综述有助于读者更好地阅读原文。
1 ILC2s
对于不同疾病状态下ILC2s的研究取得了进一步进展。过去1年的研究发现了由于臭氧、肥胖、哮喘、食物过敏和呼吸道合胞病毒感染引起的炎症中ILC2s的作用,同时进一步阐明了调控ILC2s细胞发育的关键分子,发现了促进IL-33释放的酶,而IL-33可以活化ILC2s。
近期一项研究发现,臭氧暴露刺激能同时促进BALB/c和C57BL/6小鼠呼吸道中IL-33的释放,而只有BALB/c小鼠ILC2s数量增加[1]。对BALB/c小鼠进行抗Thy1.2抗体注射以清除ILC2s可以阻断臭氧引起的气道反应,当回输ILC2s后臭氧引起的气道反应重新激活,提示BALB/c和C57BL/6小鼠的ILC2s存在本质差异。
另一项研究表明,肥胖条件下ILCs将加重呼吸道疾病。食物诱导肥胖性小鼠的ILC2s和ILC3s数量较瘦鼠明显增加,但是它们的气道高反应性却没有增加[2]。利用屋尘螨变应原诱导变应性气道炎症,肥胖鼠较瘦鼠产生更多的ILC2s和ILC3s,同时肺脏中IL-33和IL-1β呈高表达。通过抗CD90抗体清除ILCs可降低变应性气道炎症并募集Th2和Th17细胞[2]。
一项基于重度嗜酸性粒细胞和轻度变应性哮喘患者的横断面研究采用细胞内细胞因子染色技术并利用流式细胞术分析发现,重度哮喘患者血液和痰液中的总ILC2s和分泌2型细胞因子的ILC2s显著增多[3]。此外,重度哮喘伴气道嗜酸性粒细胞(>3%)患者痰液中IL-5+IL-13+ILC2s明显多于重度哮喘伴低嗜酸性粒细胞患者。有趣的是,重度及轻度哮喘患者血液和痰液CD4细胞、嗜酸性粒细胞祖细胞所表达的细胞内的细胞因子没有差异。
一项基于小鼠的研究提示ILC2s能促进食物过敏。IL-4受体(interleukin 4 receptor,IL-4R)α链功能获得性突变小鼠表现为食物过敏的易感性增加和ILC2s数量的增加,ILC2s受IL-33刺激进而分泌IL-4[4]。已证实IL-4能抑制变应原特异性调节T细胞产生和促进食物过敏。这为利用抗IL-33抗体降低食物过敏风险提供了可能。
目前导致IL-33释放和随后ILC2激活应答的机制得以阐明[5]。链格孢和尘螨变应原提取液激发实验发现,NADPH氧化酶双氧化酶1(DUOX1)对培养的人上皮细胞和小鼠上皮细胞分泌IL-33起重要作用。上皮细胞受变应原的诱导后分泌IL-33受钙依赖表皮生长因子介导的信号通路调控并且涉及半胱氨酸氧化过程。哮喘患者鼻上皮细胞DUOX1表达升高证实其临床相关性。
另一项研究发现,全身用药能促进变态反应性炎症应答,而过表达的IL-25促进Th2细胞因子和嗜酸性粒细胞趋化因子的产生。小鼠肠内过表达IL-25并通过卵清蛋白致敏的小鼠在4次卵清蛋白激发后产生与变态反应有关的能表达IL-5和IL-13的ILC2s,且其数量明显多于致敏的非转基因小鼠[6]。ILC2s和变应原特异性Th2细胞数量间存在联系,即Th2细胞能增强ILC2s对IL-25的应答,然而ILC2s不能诱导信号传导及转录激活因子6(signal transducers and activators of transcription,STAT6)缺陷小鼠发生食物过敏,这可能与该种小鼠缺乏产生Th2细胞的能力有关。
目前已经证实胸腺基质淋巴生成素(thymic stromal lymphopoietin, TSLP)可以在呼吸道合胞病毒(respiratory syncytial virus,RSV)感染下调节ILC2s产生IL-13。在RSV01/2-20感染的小鼠模型中,拮抗TSLP可以发挥减少产生IL-13的ILC2s数量、降低气道高反应性、减少黏液化生和在不改变病毒载量的情况下防止出现RSV引起的体重减轻,其中RSV01/2-20株可以引起Th2/Th1混合型宿主免疫应答[7]。TSLP能在另外2种RSV株感染时发挥类似作用,这两种病毒株主要引起Th2型应答,提示在严重RSV感染中TSLP可能成为潜在的治疗靶标。
在固有淋巴前体细胞阶段表达转录因子早幼粒细胞白血病锌指基因(promyelocytic leukemia zinc finger protein,PLZF)对成熟ILC2s的功能具有长效作用,似乎是固有免疫相关刺激物进行的主要调节[8]。PLZF遗传缺陷小鼠对木瓜蛋白酶、IL-25或者IL-33产生应答时存在IL-5和IL-13分泌缺陷。因此,与野生型小鼠比较,PLZF-/-小鼠相招募嗜酸性粒细胞的能力减弱,黏液化生减少,但PLZF-/-小鼠对卵清蛋白的激发并不产生变态反应,因为这个过程是由CD4+T细胞介导的特异性免疫应答。
Lombardi等[9]发现,变态反应患者(变应性鼻结膜炎)和非变态反应人群中外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)中的ILC2s和ILC3s百分比无明显差异,当只关注变应性鼻结膜炎时发现了差异,尤其是变应性鼻结膜炎并发哮喘者血中ILC2s和ILC3s百分比高于未并发哮喘者,哮喘患者外周血中ILC2s和ILC3百分比远高于非哮喘患者,且慢性鼻结膜炎患者1型ILCs产生的γ干扰素(interferon-γ,IFN-γ)水平远低于健康人群。哮喘患者ILC2s的原癌基因c-FOS、FosB、JUN表达上调,这些蛋白产物构成转录因子激活蛋白1。然而,非变态反应人群ILC2s的自然杀伤细胞颗粒蛋白7(natural killer cell granule protein 7,NKG7)、细胞信号传导抑制因子1和TBX21基因上调,这些蛋白抑制Th2转录过程。近期发表的关于ILC的研究进展见表1。

表1 近期报道的关于固有淋巴样细胞的研究进展
2 CD4+Th2细胞
GATA-3是Th2分化的关键调节因子并且受sirtuin-1的负向调控,sirtuin-1是3型组蛋白去乙酰化酶[10]。去乙酰化酶是sirtuin-1和sirtuin-2的特异抑制剂,利用去乙酰化酶处理健康人PBMCs可使IL4转录本和GATA-3乙酰化增加。研究发现严重哮喘患者PBMCs的NAD-依赖蛋白sirtuin-1活性明显高于非严重哮喘患者和健康对照者,证实了上述结果的临床相关性。
有研究表明,sirtuin-6可使GATA-3去乙酰化而抑制变应性气道炎症,sirtuin-6具有组蛋白去乙酰化酶和ADP核糖基转移酶功能,参与多种衰老相关的分子通路,包括DNA修复、端粒维持、糖酵解和炎症反应。在卵清蛋白激发之前对小鼠气管输入表达sirtuin-6的腺病毒可减少肺部炎症细胞和气道黏液[11]。虽然卵清蛋白致敏可诱导GATA-3乙酰化,但sirtuin-6过表达可降低GATA-3表达。因此这两种抑制GATA-3活性的不同去乙酰化酶可能成为变应性气道疾病的治疗靶标。
当户尘螨变应原刺激致敏小鼠时IL-1β的上调促进Th2细胞分泌IL-13,从而导致支气管旁的浸润细胞增加、黏液产生和杯状细胞化生[12]。相反,Th2受IL-1β拮抗剂阿那白滞素刺激后导致IL-13表达降低,减少细胞浸润和黏液分泌。这些结果提示IL-1受体进行的信号传导是Th2细胞发生不同效应的重要因素。
通过IL-4缺陷但并不抑制Th2型免疫应答、气道反应性和黏液化生的研究进一步阐明了小鼠哮喘模型中CD4+T细胞分泌IL-4和IL-13的作用[13]。然而,IL-13缺陷可以抑制上述哮喘模型的生理病理特征。IL4Rα信号传导对哮喘的表型极其重要,当缺少IL-4Rα信号时会促进Th17应答,IL4Rα是IL-4和IL-13的共同受体亚家族,值得注意的是最近发现人源化抗IL-4Rα抗体dupilumab可以有效地治疗哮喘,dupilumab获得美国FDA批准用于特异性皮炎的治疗[14-16]。
IL-25和IL-33可能参与慢性鼻炎伴鼻息肉的发病,慢性鼻炎伴鼻息肉患者的息肉组织中发现一类Th2细胞,这类Th2细胞共表达IL-25受体亚家族IL-17受体B和跨膜区mRNA及可溶性IL-33受体亚家族ST2,使IL-25和IL-33刺激后活化,导致IL-5和IL-13分泌增多[17]。在IL-17受体B阳性CD4+细胞的不同患者中鉴定到几个相同序列的T淋巴细胞受体β链可变区互补决定域3,提示通过共同抗原进行克隆扩增的可能性。
对导致Th2极化代谢途径的了解仍处于初期阶段。在IL-4R RNA表达和Th2特异性信号传导调节偶联糖酵解和Th2极化过程中RhoA不可或缺[18]。RhoA超活化可促进Th2极化并引起变应性气道炎症。与此相反,体外实验发现,RhoA基因缺陷抑制Th2,同时阻碍卵清蛋白引起的小鼠变应性气道炎症的进展,而不影响Th1细胞成熟。此外,Toll样受体9激动剂(CpG)的存在可抑制变应原皮试过程中Th2细胞成熟,其机制是通过MyD88依赖的应答向Th1和Th17应答转变[19]。
3 类二十烷酸对炎症的调节
磷脂酶A2调控花生四烯酸生成的限速步骤,花生四烯酸是生成前列腺素和白三烯(leukotriene,LT)的前体物质。研究发现嗜酸性粒细胞内质网、高尔基体及颗粒中存在分泌型磷脂酶A2-X(sPLA2-X)[20],sPLA2-X的特异性抑制能降低嗜酸性粒细胞花生四烯酸甲酰甲硫氨酰-亮氨酰-苯丙氨酸的诱导释放和半胱氨酸LT的生成减少。IL-13和TNF/IL-1β对嗜酸性粒细胞的短期刺激能促进编码sPLA2-X的基因的表达。这些结果提示sPLA2-X在嗜酸性粒细胞生成半胱氨酸LT过程中发挥作用,其在嗜酸性粒细胞来源的LT引起的疾病中可能有治疗作用。
在阿司匹林加重性呼吸系统疾病(aspirin-exacerbated respiratory disease,AERD)患者中前列腺素E2(prostaglandin E2,PGE2)对LT生成具有抑制作用[21]。一项研究比较并评估正常对照鼻黏膜和AERD患者鼻息肉的纤维母细胞中PGE2相关蛋白表达情况,包括与PGE2合成的相关酶(COX-2和微粒体前列腺素E合成酶1)、诱导产生COX-2和Ⅰ型IL-1受体(IL-1 receptor 1,IL-1R1)的细胞因子受体、通过PGE2信号抑制LT生成的前列腺素E2受体(prostaglandin E2 receptor ,EP2)[22]。AERD患者鼻息肉的纤维母细胞中IL-1R1和EP2表达量均低于正常对照者。利用PGE2或选择性EP2拮抗剂的外源刺激可增加正常对照者鼻黏膜来源纤维母细胞中IL-1R1的表达,而对AERD患者鼻息肉的纤维母细胞影响很小。这些数据提示AERD患者EP2表达降低导致IL-1R1表达上调,而抑制IL-1β上调COX-2的能力和微粒体前列腺素E合成酶1(prostaglandin E synthase 1,PGES1)的表达则导致PGE2生成降低。
PGE2的生物学效应是由其受体通过前列腺素信号所调控的,EP2和EP4与Gs偶联而EP3和Gi偶联。LTD4和PGE2可引起血管通透性增加并导致小鼠耳朵水肿[23],这种效应是由LTD4通过半胱氨酸白三烯受体1和PGE2信号通过EP3介导,从而导致细胞外信号调节激酶、c-FPS磷酸化及吞噬细胞炎性蛋白1和COX2表达上调,肥大细胞生成PGD2。同时使用半胱氨酸白三烯受体1和EP3拮抗剂可以降低血管通透性,提示以这两个受体作为靶点可抑制炎性血管渗漏。
AERD患者尿液半胱氨酸白三烯水平升高与疾病严重程度相关。阿司匹林脱敏可以改善临床症状,但是目前仍未完全阐明脱敏机制。与正常对照者比较,AERD患者CD4+T细胞的CD3+和CD28+活化更能促进STAT6活化[24]。在细胞刺激之前利用COX抑制剂吲哚美辛或阿司匹林处理CD4+T细胞,无论细胞是否来源于AERD,均能下调STAT6活性,然而,AERD患者细胞STAT6活性出现显著下降,这些现象为解释阿司匹林脱敏对AERF患者有效的机制提供了可能的理论依据。
PGD2可以激活2种G蛋白偶联受体,即前列腺素D2受体1(prostaglandin D1 receptor ,DP1)和DP2。利用PGD2体外激活人巨噬细胞上的DP1、DP2或者同时激活两者可以引起TNF分泌和细胞迁移[25]。于气道进行脂多糖(lipopolysaccharides,LPS)激发前皮下注射PGD2会增强中性粒细胞型肺损伤,DP1和DP2信号通路参与此过程。清除巨噬细胞可减弱中性粒细胞的功能,而在LPS激发前进行PGD2处理会增强中性粒细胞功能,这些证据强调了巨噬细胞在这种肺损伤小鼠中的作用。抑制内源性PGD2的生成可阻断LPS诱导的中性粒细胞型炎症反应。
DP2也是Th2细胞表达的趋化因子受体同源分子(chemoattractant receptor-homologous molecule expressed on Th2 cells,CRTH2),可以作为鉴定致病性效应Th2(peTh2)细胞的标志物,peTh2细胞是一类具有促炎功能的Th2细胞亚型[26]。此外,这类peTh2细胞同时表达DP2和造血前列腺素D合酶(hematopoietic prostaglandin d synthase,hPGDS)并能产生PGD2,而一般Th2细胞不具备这种功能。hPGDS+细胞中IL-5和IL-13的表达水平显著高于hPGDS-细胞。对peTh2细胞的潜在功能研究表明,peTh2细胞与血嗜酸性粒细胞数量成正相关,嗜酸性胃肠道疾病患者肠道的peTh2细胞数量远多于正常人。此外,与一般Th2细胞比较,peTh2细胞中TSLP、IL-25和IL-33受体表达更强,提示这类细胞在这些细胞因子处于低水平时可以被激活。值得注意的是CRTH2拮抗剂fevipiprant可以降低难以控制的严重嗜酸性粒细胞哮喘患者痰液中嗜酸性粒细胞数量[27]。
胸腺基质淋巴生成素(thymic stromal lymphopoietin,TSLP)是AERD患者产生PGD2的重要调节因子。所有鼻息肉中的TSLPmRNA与编码hPGDS和羧肽酶基因表达量具有很强的关联性,其中羧肽酶是肥大细胞特有的[28]。AERD患者鼻息肉中同时存在失活的和活化形式的TSLP,同时重组TSLP可诱导培养的人肥大细胞产生PGD2。通过对较稳定的尿PGD2水平进行检测,进一步确定了AERD与PGD2的关系,发现AERD患者PGD2水平是正常对照人群的2倍,并且PGD2水平受阿司匹林的激发而升高。
一项研究对奥马珠单抗治疗至少12个月的AERD患者进行分析,发现治疗后其症状减轻,说明IgE可能参与AERD的致病过程[29],21例接受奥马珠单抗治疗的哮喘患者尿液LTE4和PGD2代谢产物水平降低。因此进行随机双盲安慰剂对照临床试验确定奥马珠单抗在AERD患者中的治疗作用非常必要。
脂氧素(lipoxin,LX)是花生四烯酸的代谢产物,具有抗炎和生物活性。脂氧素A4(lipoxin A4,LXA4)抑制TNF介导的中性粒细胞的趋化和激活,同时通过抑制核酸因子κB通路下调促炎基因的表达[30]。通过对间歇性哮喘患者和正常对照者外周血粒细胞进行研究,发现与单独使用氟替卡松或LXA4治疗相比较,氟替卡松与LXA4联合使用能促进粒细胞受体的活化。糖皮质激素的应用可增强LXA4对粒细胞受体活化能力的促进作用,提示LX对哮喘患者具有保护作用。
最新的研究证实,类二十烷酸可能在毒液免疫治疗相关耐受中发挥作用,特异性抗原刺激PBMCs导致PGE2和LXA4水平上升。有趣的是,在毒液免疫治疗过程中PGE2和LXA4没有明显变化[31]。毒液免疫治疗后的患者PGE2和LXA4水平上升,同时伴随IL-10和TGF-β的产生,提示PGE2和LXA4在诱导、发生和维持免疫耐受过程中具有一定作用。
4 细胞外囊泡细胞外囊泡与变态反应
细胞外囊泡细胞外囊泡(extracellular vesicles,EVs)是细胞分泌的囊泡状小体,直径0.05~5 μm,根据其来源与特征分为外泌体、细胞微泡和凋亡小体3 类(图1)。EVs从细胞膜分泌时携带各类DNAs、蛋白、mRNA和microRNAs(miRs),并在变态反应或免疫应答中发挥重要作用,目前对其在代谢和肿瘤形成中的作用已有一定的认识。例如,肉状瘤患者肺泡灌洗液的EVs中有690余种蛋白和几种炎症相关蛋白(LTA4水解酶和维他命D结合蛋白)表达上调[32]。正常鼻上皮细胞可表达miR-146a,而变应性鼻炎患者鼻上皮细胞中miR-146a表达水平显著降低。利用Th2细胞因子进行刺激,EVs和鼻上皮细胞miR-146a的释放受到抑制。鼻上皮细胞来源的miR-146a包含在EVs中,并通过单核细胞上调IL-10的表达[33]。
此外,嗜酸性粒细胞也能分泌EVs,在哮喘患者中EVs分泌量增加[34]。嗜酸性粒细胞胞外诱捕网(eosinophil extracellular traps,EETs)是一类EVs,通过释放核DNA和线粒体DNA联合细胞毒颗粒蛋白达到消灭细菌的目的[35]。在金黄色葡萄球菌感染的慢性鼻炎伴鼻息肉组织中可发现EETs的形成并伴随IL-5和骨膜蛋白组织水平的升高。在体外实验中,EETs的形成受金黄色葡萄球菌的诱导而不受表皮葡萄球菌诱导,在黏膜内外表面均可以发现嗜酸性粒细胞的迁移以消灭金黄色葡萄球菌。嗜酸性粒细胞溶解除了产生EVs以外,未水解的嗜酸性粒细胞也能释放EETs和其他EVs[35]。
血小板来源的EVs由血小板胞膜释放,是人血液中最丰富的EVs。最近对血小板来源的EVs分子和功能进行研究,结果提示它们在多种生理病理过程,尤其是炎症反应中发挥作用,而不是作为细胞活化的惰性产物[36]。移除血小板或移植IL-33基因缺乏的血小板可降低变态反应性炎症中血小板表达功能性IL-33和木瓜蛋白酶引起的嗜酸性粒细胞气道炎症程度[37]。正常状态下IL-33存在于细胞内,并在细胞坏死时大量释放,例如上皮细胞。不像其他细胞因子,IL-33并非直接通过受体依赖的信号通路而产生和释放。然而,坏死并不是唯一产生IL-33的病理机制,尤其是造血类细胞,例如血小板和单核细胞[38]。生物压力也可以引起活细胞中IL-33以时间依赖的方式从分泌小体中释放[39]。
5 IL-33:多功能细胞因子
IL-33通过促进ILC2s产生2型细胞因子并抑制天然抗病毒免疫在变态反应性炎性疾病中发挥重要作用[40]。利用全基因组关联分析发现,IL-33及其受体ST2的基因多样性与哮喘的发病风险有关。Ferreira等[41]利用新型系统分析方法鉴定了4种与核苷酸合成和信号通路相关的哮喘风险基因,哮喘动物模型研究也发现其中两种基因产物的激活剂可以诱导IL-33的释放和肺部嗜酸性粒细胞的浸润。
IL-33在多种生理病理过程中发挥作用,同时IL-33还参与肿瘤微环境的形成和结肠直肠癌的进程[42]。IL-33和ST2还可以通过诱导解偶联蛋白1的表达激活产热反应,对于寒冷环境中出生的婴儿的保护极其重要[43]。同时,围产期孕妇的IL-33通过诱导胚胎蜕膜B细胞表达孕激素诱导阻断因子1而对以Th1介导的炎症为特征的早产儿起保护作用[44]。在IL-33刺激下,ILC2s细胞分泌2型细胞因子,从而在内脏脂肪组织中形成有效的抗炎环境[45]。高脂饮食可加重变应性气道炎症,主要表现在肺部ILC2s和ILC3s细胞浸润。虽然目前并不清楚IL-33在这种模型中的作用,但是目前发现内脏脂肪组织中IL-33高表达且ILC标志物减少[2]。事实上,在某些实验模型中IL-33可以诱导组织原位Treg增加[45]。

图1EVs的类型、大小和内容物
目前已计划将抗IL-33抗体用于包括哮喘等多项变态反应性疾病的临床试验,而哮喘受其内源性影响存在表型异质性(比如肥胖型哮喘)[46-47]。因此了解IL-33参与不同类型疾病的作用机制,从而针对性地纳入合适的患者(例如内脏脂肪明显增多的患者)以及设定合理的给药时间对于抗IL-33抗体的临床研究尤其重要。2016年杂志发表的关于IL-33研究进展摘要见表2。

表2 2016年发表的关于IL-33的研究进展
6 屏障功能和微生物组学
2016年研究者明确地阐明了上皮和表皮屏障损伤如何引起炎症以及渗入这些损伤屏障的变应原如何引起2型固有性和获得性免疫应答的机制,大量研究报道了这些屏障组织微生物与变态反应性疾病发生的关系。例如气道上皮细胞、尘螨过敏的鼻炎患者,其屏障功能损伤伴随着紧密连接蛋白(闭合蛋白和紧密连接蛋白ZO-1)表达的下调[48-53]。关于哮喘的疾病进展,虽然已经证实哮喘与微生物紊乱呈正相关,但是大多数研究仍为概念验证研究。对于这种相关性的机制目前仍不清楚,依然是今后的研究热点。例如,一项基于丹麦儿童的人群队列研究发现,选择性剖宫产儿童的哮喘风险远高于急诊刨宫产儿童[54],同时对剖宫产儿童和顺产儿童进行比较,发现剖宫产影响新生儿早期肠道而不影响气道的定植菌群[55]。关于食物补充对哮喘疾病进程影响的研究发现,孕期食用鱼源n-3长链多不饱和脂肪酸可降低后代持续喘息、哮喘和下呼吸道感染风险,但并不减缓变态反应性疾病的致敏风险[56]。未来应进一步研究微生物组引发哮喘与哮喘分类的关系。
不同于其他变态反应性疾病,21世纪发生食物过敏的人数急剧增加。越来越多的证据表明,通过皮肤致敏食物变应原是打破口服耐受的可能机制[57-58]。2016年发表了多项关于特异性皮炎和其他变态反应性疾病中皮肤屏障功能和皮肤微生物组学的研究报告,报道了新生儿皮肤功能紊乱与2岁左右的儿童食物过敏风险增加的关系[59]、生活用水硬度和氯含量与特异性皮炎风险增加的关系[60]、2月龄儿童定植共生葡萄球菌与1岁特应性皮炎发生风险降低的关系[61]。
关于皮肤屏障功能紊乱的机制研究发现,2型和17型炎症反应可以同时发生及拮抗,且分别受TSLP和IL-23的调控[62]。虽然凡士林已经广泛用作保湿剂,且仅仅认为是物理屏障,但近期研究发现,凡士林的使用可以引起抗菌肽(例如S100A8和人β防御素2)[62]、固有免疫基因(例如IL6)和屏障分化标志物(例如丝聚合蛋白)的表达。关于微生物组对变态反应性疾病进程的研究发现,对牛奶过敏的婴儿肠道微生物和同龄健康对照者有所不同[63],并且在特异性皮炎加重过程中皮肤微生物多样性减少[64]。这些病理过程所涉及的机制以及基于恢复屏障功能的治疗方法还需要进一步进行研究[64-65]。

图 2 嗜酸性粒细胞研究最新进展
7 嗜酸性粒细胞增多症
2016年嗜酸性粒细胞增多症受到极大关注(图2),毫无疑问,这与第一类抗嗜酸性粒细胞药物(如基于抗IL-5抗体的瑞利珠单抗和美泊利单抗)常规用于嗜酸性粒细胞性哮喘的治疗有关[66]。除此之外,清除嗜酸性粒细胞的人源化抗体抗IL-5Ra(benralizumab)对治疗嗜酸性粒细胞哮喘极其有效[67-68]。嗜酸性粒细胞胃肠疾病也同样受到极大关注。有证据显示,质子泵抑制剂(proton pump inhibitor,PPI)反应性食管嗜酸性粒细胞增多症(reactive esopha-geal eosinophilia,REE)也可进行饮食治疗[69],与最近报道的PPI-REE与嗜酸性食管炎(eosinophilic esophagitis,EoE)的分子机制一致,包括变态反应性炎症的主要特征[70]。相关研究发现,EoE同样可以用饮食管理、糖皮质激素应用或PPI进行治疗[71]。有趣的是,PPI治疗主要是通过抑制上皮细胞释放嗜酸性粒细胞活化趋化因子(CCL26)发挥作用,而这也可能是EoE和其他嗜酸性粒细胞紊乱患者的患病机制,例如慢性鼻窦炎伴鼻息肉[72]。指南指出EoE患者应避免进食小麦,而目前的研究资料并不支持将避食小麦延伸至避食谷蛋白[73]。虽然EoE患者食物特异性IgE水平没有明显增加,但是Erwin等[74]报道发现抗牛奶IgE水平与禁食牛奶缺乏应答有关,同时称IgG4/IgE比值升高提示这个比例与耐受患者一致(例如养蜂人、养猫人以及花生口服免疫治疗后的人)。值得注意的是,Wright等[75]发现EoE患者血液及食管中食物特异性IgG4水平上升。并发现纤维化狭窄的EoE很容易诊断,但目前不清楚相关机制。最近研究发现,培养的食道纵向平滑肌细胞对刚性基质会产生促纤维化应答,实际上,刚性细胞基质诱导的形态学和转录水平改变与EoE一致[76]。此发现对炎症形成EoE的假说提出了质疑,因为该发现表明食道硬度对纤维化形成有正反馈作用。嗜酸性粒细胞型组织重塑的原因部分地与骨膜蛋白诱导嗜酸性粒细胞活化而产生依赖于αMβ2整合素的转化生长因子-β(transforming growth factor-β,TGF-β)有关[77]。另一项不同疾病的研究发现,支气管热整形术可降低重度哮喘患者血液嗜酸性粒细胞水平,由此推测利用热整形术降低平滑肌质量可以破坏正反馈环路,从而减少嗜酸性粒细胞[78]。对EoE患者循环生物标志物的研究发现,嗜酸性祖细胞水平与食道嗜酸性粒细胞水平呈正相关[79]。此外,对嗜酸性肠炎患儿的生物标志物的研究发现TSLP和IL33蛋白水平增加,但其他Th2标志物没有变化,提示这些分子不仅在EoE患者中起作用,同时也与其他嗜酸性粒细胞型肠病有关[80]。
8 嗜酸性粒细胞肉芽肿伴多血管炎
嗜酸性粒细胞肉芽肿伴多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA),原名Churg-Strauss综合征,其发生主要与Fcγ受体(FcγR)基因拷贝数变化导致自身免疫性疾病有关[81]。EGPA患者的典型表现是IgGFc端受体3B(FCGR3B)缺陷(如低表达),提示这可能会影响免疫球蛋白清除或扰乱抑制/活化Fc受体的平衡,尤其是因为EGPA出现明显的自身抗体和IgG4水平升高[81]。
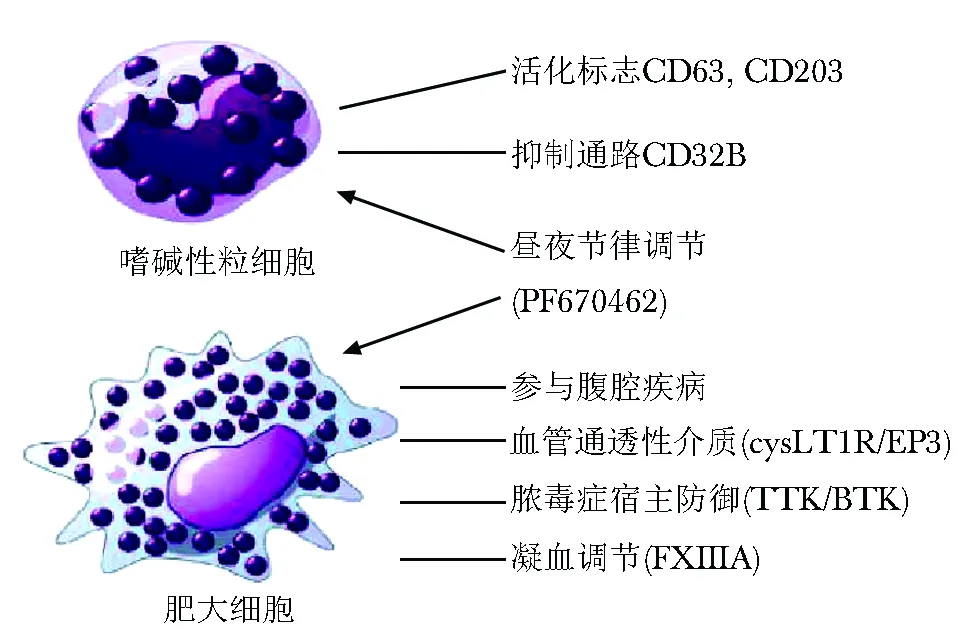
图 3 嗜碱性粒细胞及肥大细胞最新进展
9 嗜碱性粒细胞
2016年关于嗜碱性粒细胞的研究有一系列重大发现(图3)。Oliver等[82]发现,慢性自发性荨麻疹患者血清嗜碱性粒细胞CRTH2表达异常,提示这个受体可以作为自发性荨麻疹诊断或治疗监测的标志物。基于循环嗜碱性粒细胞活化标志物的表达研究发现,嗜碱性粒细胞与轻度变应性哮喘患者变应原诱导的支气管狭窄有关[83]。一项有趣的研究发现,嗜碱性粒细胞和肥大细胞均能通过生物钟影响变态反应,提示FcεRI介导的变态反应有明显的昼夜差异。PF670462是一种关键生物钟相关酪蛋白激酶1δ/ε选择性抑制剂,可以抑制IgE介导的小鼠骨髓来源的肥大细胞和嗜碱性粒细胞变态反应,同时对小鼠被动皮肤变态性反应也有抑制作用。因此,对嗜碱性粒细胞的分子钟进行药物重置可能是一种新的控制IgE介导的变态反应性疾病的策略[84]。
IgG亚群介导的嗜碱粒细胞活化或抑制机制已被阐明。嗜碱性粒细胞表达活化受体是CD32a(FcγRIIa)和抑制受体CD32b(FcγRIIb),IgG2和IgG3可以与CD32b结合,IgG3与CD32b结合性较强而IgG1和IgG4不能与CD32b结合。这一发现使得IgG3介导的抑制和直接封闭抗原的IgG4用于评价免疫治疗前后的免疫应答成为可能[85]。
Fcγ链对于嗜碱性粒细胞产生IL-4是必需的结构[86]。通过对花生过敏患者血循环中的白细胞进行分析,发现嗜碱性粒细胞是血液中对花生刺激反应最灵敏的细胞,花生刺激后CD63表达上调,这是嗜碱性粒细胞脱颗粒的标志,可调节FcεRI、CD23、CD16和CD32的表达并下调CD25和CD38的表达[87]。
变应原暴露后CD203c水平升高的嗜碱性粒细胞活化测定实验是一种有效评价变应原致敏作用的方法。一项研究显示,在鉴定变应性支气管肺曲霉菌病伴囊性纤维化方面,CD63和CD203c同时测定并不优于单独检测CD203c的效果[88]。
嗜碱性粒细胞参与多种变态反应性疾病的发生,包括通过由TSLP介导的疾病,例如特应性皮炎小鼠模型。然而,最近一项研究发现,皮肤嗜碱性粒细胞归巢并不依赖嗜碱性粒细胞表达TSLP受体,更令人吃惊的是,嗜碱性粒细胞可以缓解特应性皮炎症状。提示IL-4依赖和TSLP依赖的促炎应答更多是由树突状细胞而非嗜碱性粒细胞介导的[89]。
10 肥大细胞
关于肥大细胞的研究进展相继报道(图3),尤其是血管炎小鼠中,LTD4-PGE2通过半胱氨酰LT受体1和PG受体3影响肥大细胞而发挥作用。这个发现提示半胱氨酰LT受体1和EPG受体3可以作为双靶标在减缓炎症中发挥作用[23]。目前已证实肥大细胞对控制小鼠的感染性休克至关重要。研究发现,非受体酪氨酸激酶IL-2诱导T细胞激酶和Bruton酪氨酸激酶对LPS诱导的肥大细胞炎性反应发挥负向调节作用,其机制主要通过调节肥大细胞LPS受体(Toll样受体4)功能下游信号通路核因子κB、磷脂酰肌醇活化-4,5-二磷酸3激酶/AK和p38实现[90]。另一项研究发现,IL-6可以促进人肥大细胞增生,并通过抑制可溶性IL-6受体的裂解和抑制细胞因子信号3自身抑制信号通路的下调而产生一种激活表型[91]。
最近一篇综述聚焦在鉴定的Mas相关G蛋白偶联受体X2(Mas related G protein coupled receptor X2,MRGPRX2),该受体由肥大细胞表达并且参与非IgE介导的肽类药物过敏反应[92]。这篇综述总结了MRGPRX2在多种应答(包括疼痛、发痒、荨麻疹、哮喘和药物反应)中发挥作用的研究进展,强调了抑制MRGPRX2的可能路径。大量研究都聚焦于肥大细胞的急性活化,例如给予单次剂量的抗IgE刺激,但是变态反应可能涉及变应原的重复暴露。最近的一项研究报道了利用RNA测序方法评估FcεRI介导的肥大细胞活化情况,研究人员发现289个基因在抗IgE重复刺激后明显上调而在单次刺激后这些基因中的大多数并无表达。有趣的是,鉴定出的基因与慢性鼻炎组织中表达的基因表达谱有重叠,可以为变态反应性疾病的发生机制研究提供新的认识[93]。
最近,研究人员报道了一种新的皮肤微生物信号机制,通过利用脂质体刺激角质形成细胞而产生干细胞因子,从而使皮肤内肥大细胞被招募并成熟[94]。肥大细胞浸润与腹腔疾病和黏膜损伤的严重程度有关,提示存在新的疾病类型。有趣的是,肥大细胞可以直接与无免疫原性的麦醇蛋白片段反应而释放促炎因子介质[95]。研究对肥大细胞释放蛋白进行了质谱分析,发现其中最丰富的一种蛋白是谷氨酰胺转移酶凝血因子ⅩⅢA,在肥大细胞缺陷小鼠的研究中证实了肥大细胞的作用,尤其是糜蛋白酶在调节谷氨酰胺转移酶促凝因子ⅩⅢA血浆活动水平和出血时间方面的作用[96]。
参考文献请见原文:
J Allergy Clin Immunol, 2017,140(6):1622-1631
专家点评
何韶衡锦州医科大学变态反应与临床免疫研究中心
本篇综述总结了2016年变态反应性疾病机制研究的一些进展,包括2型固有淋巴样细胞对臭氧的应答、参与食物过敏反应及其受上皮警报素IL-33的调节;Th2型淋巴细胞,尤其是发现去乙酰化酶-1(Ⅲ型组蛋白去乙酰化酶)表观调控GATA-3表达从而调节Th2型细胞的新路径;进一步提高了类二十烷酸对炎症调节的认识,主要集中在磷酯酶A2新的特性、前列腺素D2及其受体的新功能以及抑制性前列腺素E2的信号通路、胞外膜泡释放的机制及其在变态反应中的作用。人们还进一步加深了对黏膜屏障功能、IL-33以及微生物组学的认识。在变态反应性炎症细胞(肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞)的研究上也取得了进展。这些研究成果不仅使人们对变态反应性疾病的发病机制有了新的认识,拓宽了人们观察此类疾病的视野,还对此类疾病的新治疗策略的决策具有重大影响,因此是一篇很有价值的文章。然而,正如绝大多数综述一样,本文很难在有限的篇幅中涵盖所有的内容,如发表在NatImmunol上的自身膜型IgE信号防止IgE记忆形成这样的文章都没有提及,因此本人认为此文的题目有些过大,应当写成“一些重要进展”等字样。由于文章的参考文献主要来自于JAllergyClinImmunol,因此在某些观点及认识上有可能出现偏颇,读者在阅读时要引起注意。

何韶衡何韶衡,博士、博士后,曾在英国、美国留学12年。1999年在世界著名的英国南安普顿大学呼吸细胞与分子生物学分院任高级研究员、博士生导师,领导班子成员。2001年起为教育部“长江学者”特聘教授,现任沈阳医学院整合医学研究院执行院长、转化医学研究中心主任。主要从事变态反应性疾病发病机制及诊治手段的研发工作,是国际变态反应学领域的知名专家。“十二五”国家科技支撑计划、国家自然科学基金重点项目、国家林业局行业计划专项及辽宁省高等学校重大科技平台———“炎症性疾病诊治工程研究中心”等项目负责人。获国家发明专利授权19项,实用新型专利授权12项,软件著作权1项,医疗器械生产批文1项。获省科技进步奖一等奖1项,二、三等奖各2项,均排名第一。主编过敏学专著5部。
