不同湿地土壤中真菌群落分析以及纤维素降解菌的筛选
2018-09-05夏俊
夏俊
(江西省科学院应用化学研究所,江西南昌 330096)
纤维素是地球上最丰富、来源最广泛的碳水化合物,也是最大的可再生资源,占地球生物量的近50%[1]。纤维素、半纤维素和木质纤维素的致密结构形成的保护层造成纤维素不易降解,而难以作为碳源被直接转化利用[2]。目前,以纤维素、半纤维素和木质素形式存在的可再生性木质纤维素资源的再生转化,通过微生物降解转化为可利用性还原糖并用以生产生物乙醇、生物柴油等可再生能源正成为世界产业发展的一个重要趋势[3]。目前发现的具有木质纤维素降解能力的微生物种类十分广泛,但相关研究多集中于真菌,如里氏木霉、白腐真菌、黑曲霉等[4-6]。但大部分用于纤维素酶生产的菌株存在酶活力较低的问题。
本项目采集来自于湿地公园树木聚集区的表层土壤,提取土壤原样基因组,通过Illumina高通量测序方法对各样品基因组中的ITS(真菌)进行测定,然后对样品中的真菌的种类以及所占比例进行分析和比较,得出各样品中真菌的组成成分,同时从土壤中筛选分离能高效降解纤维素的真菌。
1 材料与方法
1.1 样品及培养基
样品采集:在南昌湿地公园选取三处树木茂密的区域SY1、SY2、SY3,除去表面腐殖层在土层5~10 cm深度取样,土样过筛去除根及石块,存储于-80 ℃冰箱中待用。
Mandel营 养 液:NaNO32 g,K2HPO41.5 g,CaCl21.5 g,MgSO40.3 g,FeSO4·7H2O 0.005 g,MnSO4·H2O 0.001 6 g,ZnSO4·H2O 0.001 4 g,CoCl20.0005 g,H2O 100 mL,pH 5.5。
羧甲基纤维素(CMC)平板培养基:Mandel营养液,2%羧甲基纤维素,0.08%的脱氧胆酸钠,1.5%的琼脂。
纤维素滤纸液体培养基:Mandel营养液,1 cm×6 cm的滤纸条一张。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,H2O 1 000 mL,115 ℃高压灭菌30 min。
1.2 基因组DNA提取及测序
使用土壤基因组提取试剂盒(上海生工)按说明提取土壤基因组DNA,提取的DNA溶液送至生工生物工程(上海)股份有限公司测序。
1.3 测序结果分析
将测序初始序列去除接头、barcode和前引物序列,再去除低质量序列后得到的优质序列用于后续分析研究。用mothur对所得序列进行分析,以97%相似性为标准划分操作分类单元(OTU)并进行多样性指数分析计算:群落丰度的指数Chao和Ace;群落多样性的指数Shannon指数和Simpson指数;测序深度指数Coverage。在OTU聚类结果的基础上,获取每一个OTU聚类中的代表性序列与RDP classifier数据库(http://rdp.cme.msu.edu/misc/resources.jsp)中的已知数据进行比对,得到各OTU代表序列的分类学信息,并在门纲目科属种水平统计各个样品的群落组成。
1.4 纤维素降解菌的筛选
1.4.1 初筛
称取土样10 g,加入90 mL无菌水,振荡充分混合 后制 成 10-3、10-4、10-5、10-6、10-7、10-8和 10-9稀释度的土壤溶液。吸取200 µL稀释溶液涂布于羧甲基纤维素平板培养基中,培养4天后上挑取长势明显的丝状真菌菌落接种于羧甲基纤维素平板培养基上,30 ℃静置培养3~4天,待菌丝长出后,再次接种于新的羧甲基纤维素培养基,直至获得纯菌株。
1.4.2 刚果红染色
加入10 mL染色液于培养基中,浸染30 min;染色结束后用1 mol/L氯化钠溶液和蒸馏水洗交替脱相,洗去残留菌丝,再用氯化钠反复洗脱至洗液透明;观察菌落大小,测透明圈直径,并计算透明圈直径与菌落直径之比(HC)。
1.4.3 复筛
将初筛获得的菌株按10%的接种量分别接种于液体CMC培养基中,30 ℃、150 r/min培养7天后测其羧甲基纤维素酶活。
1.5 菌种鉴定
利用通用引物ITS1/ITS4对筛选所得菌种的保守序列进行PCR扩增,PCR引序列为ITS1(5’-TCCGTAGGGAACCTGCGG-3’),ITS4(5’-TCCTCCGCTTATTGATATGC-3’)[7]。PCR 反应体系为25 μL,反应条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s;循环 30 次;72 ℃ 10 min。PCR扩增产物测序获得DNA序列后,经NCBI数据库Blast分析鉴定所得纤维素降解真菌。
2 结果与分析
2.1 土壤中真菌群落结构
2.1.1 测序数据统计学分析
利用Illumina测序方法,经优化后得到各样地土壤样品中微生物18S rDNA 基因序列118 083条,平均长度为439 bp。样品物种稀释性曲线如图1所示,土壤样品的稀释曲线已处在平稳期,因此本次测序能代表土壤中真菌的真实情况。
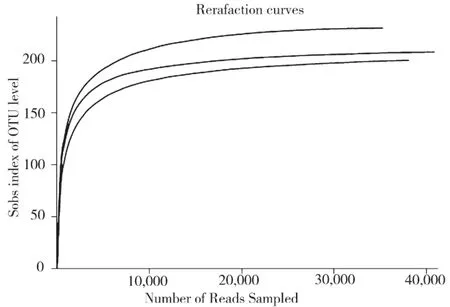
图1 稀释性曲线
2.1.2 土壤真菌群落结构分析
土壤真菌群落多样性分析见表1,各样本的Coverage都大于0.999,表明取样深度都比较合适。3个样本的Shannon指数平均值由高到低依次为SY2>SY1>SY3,Simpson指数平均值由低到高依次SY2<SY1<SY3。由此可见,样本SY2的真菌多样性较为丰富。
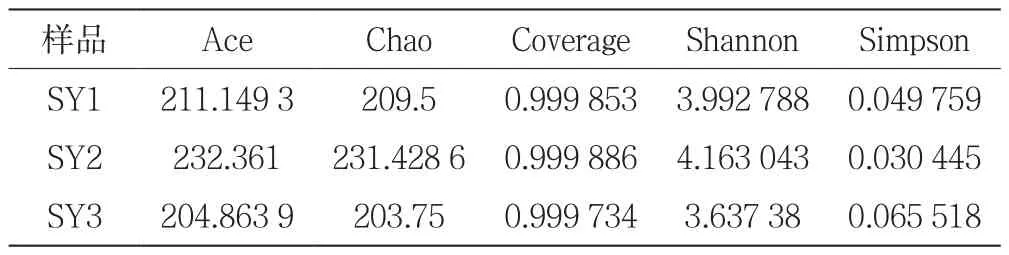
表1 土壤真菌群落多样性分析
三个样本中共有6个真菌门(图2)。其中子囊菌门(Ascomycota)相对丰度最大,在各样品中均占75%以上,且SY1和SY3中的相对丰度大于SY2。其次是担子菌(Basidiomycota)和接合菌(Zygomycota),SY3的担子菌丰度大于SY1和SY2,而接合菌丰度小于另外两者。
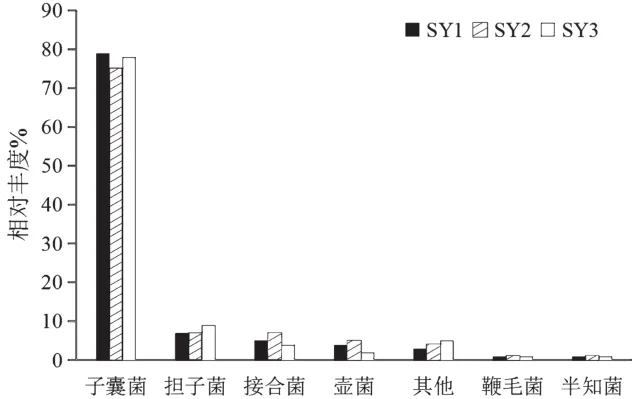
图2 各土样中真菌门相对丰度
三个真菌群落中相对丰度大于1%的优势真菌属共有15个(图3)。其中SY1中粘帚霉属(Gliocladium)丰度最高,而SY3中没有粘帚霉;其次是镰刀霉属(Fusarium)和漆斑霉属(Myrothecium),但它们在SY2和SY3中丰度都较低;SY2中丰度较高的木霉属(Trichoderma)、绿僵菌属(Metarhizium)和枝氯霉属(Ramichloridium)在另外两个样本中含量也不高;SY3中丰度最高的是毛束霉属(Trichurus)和枝孢酶属(Cladosporium),毛束霉属在SY1中不存在,而枝孢酶属在另外两者丰度也较低。由此可见,各土样中的真菌菌群存在很大的差异。
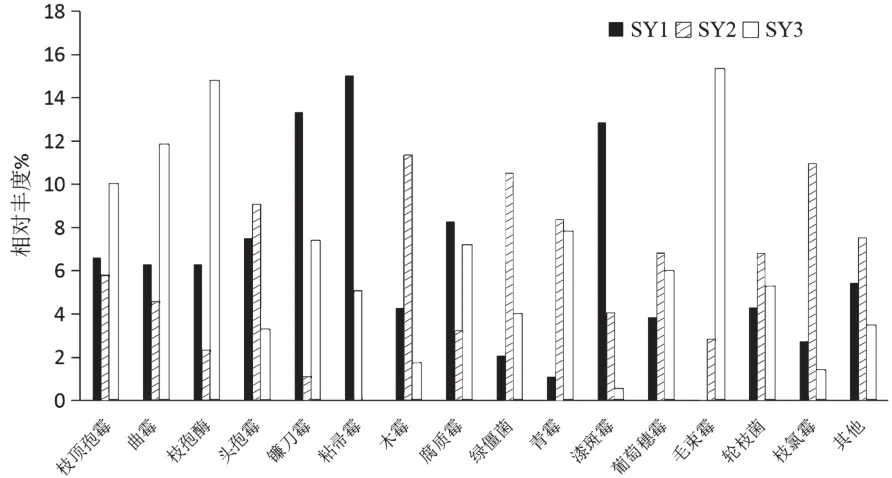
图3 各样本中优势菌属的相对丰度
2.2 纤维素降解菌的筛选与鉴定
2.2.1 维素降解菌的筛选
挑取在以纤维素为唯一碳源的培养基上生长迅速的丝状真菌,进行刚果红染色,以透明圈的形成和大小大致反映该菌的产酶能力。本实验挑取了17个霉菌,在双层平板上培养3天,刚果红染色,测量透明圈的直径。具有纤维素降解能力的菌,经刚果红染色后形成了比较明显的透明圈,分析透明圈直径与菌落直径之比(HC),挑选出HC>1的菌12株如表2所示。

表2 刚果红染色结果:部分真菌的HC比较
将初筛的12株菌株接种到纤维素液体培养基中培养,7天后测其羧甲基纤维素酶活,结果见图4。从图4中可以看出,SY2-4、SY2-9、SY2-7、SY2-2、SY1-5、SY3-3这几株菌的酶活相对较高,达到80 U/mL以上,其它的都为24 U/mL以上。
2.2.2 纤维素降解菌的鉴定
本实验采用分子生物学分析法,对筛选到的真菌菌株进行鉴定。分别用通用ITS1/ITS4对SY2-4、SY2-9、SY2-7、SY2-2、SY1-5和 SY3-3的 ITS保守区域进行扩增并序列测定,经NCBI 数据库Blast分析表明初步判定SY2-4、SY2-9、SY2-7、SY2-2、SY1-5和SY3-3分别为木霉(Trichoderma sp.)、青霉(Penicillium sp.)、棘孢曲霉(Aspergillus aculeatus)、尖孢镰刀霉(Fusarium sp.)、黑曲霉(Aspergillusniger)和米曲霉 (Aspergilluoryzae)。
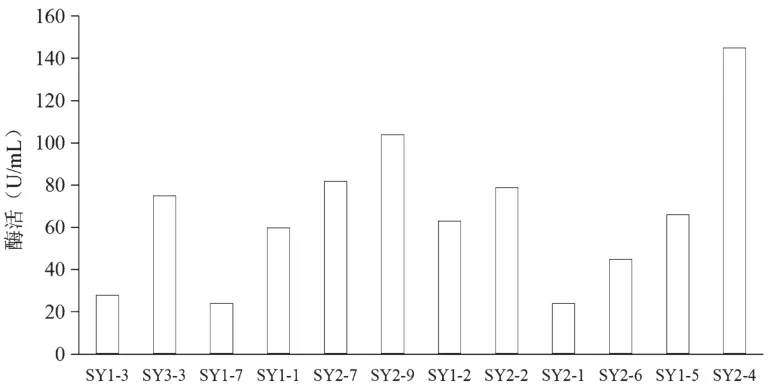
图4 液体发酵中真菌羧甲基纤维素酶活的测定
3 结论
三个样地中共有6个真菌门和15个优势真菌属,其中,子囊菌门和担子菌门丰度最高。粘帚霉属、镰刀霉属和漆斑霉属是SY1中的优势菌属,木霉属、绿僵菌属和枝氯霉属是SY2中的优势菌属;毛束霉属和枝孢酶属在SY3中丰度最高。由此可见,不同采样点的土壤菌群差异较大,这可能跟植被类型、土壤pH、湿度等条件有关。
通过分子生物学方法鉴定可知筛选得到的产酶能力较强的真菌分别为木霉(Trichoderma sp.)、青霉(Penicillium sp.)、棘孢曲霉(Aspergillus aculeatus)、尖孢镰刀霉(Fusarium sp.)、黑曲霉(Aspergillusniger)和米曲霉(Aspergilluoryzae)。对这些降解菌还需要更加深入的研究,为后续纤维素高效降解菌剂的构建以及降解菌种的改造提供基础。
