基于纳米金/蔗糖酶构建核酸适体传感器检测盐酸多巴胺
2018-08-31姜利英任林娇赵学伟王延峰
姜利英,刘 帅,任林娇,张 培,赵学伟,王延峰
临床实践中,多巴胺含量的检测对神经性食欲缺乏症、阿尔茨海默病和帕金森症等疾病的诊断和治疗有重要作用[1-3]。但是多巴胺化学性质不稳定,在空气环境中易被氧化,故实际检测中,一般以盐酸多巴胺[4-5](dopamine hydrochloride,DH)代替人体内的多巴胺。目前检测DH的方法主要有高效液相色谱法[6]、色谱-质谱联用法[7]、免疫分析法[8-9]。这些方法往往需要专业的实验设备,操作繁琐且检测成本较高。
核酸适体能与特定靶目标进行高特异性和强亲和力结合,功能与抗体相似,并且凭借其较抗体更易合成、易修饰、易保存和高稳定性的特点,被越来越多的用来制备核酸适体传感器[10-13]。便携式血糖仪[14-15]能够对血糖(葡萄糖)进行准确的测量,并且具有体积小、成本低和操作简单的特点,然而检测目标单一,限制了其应用和发展潜力。核酸适体传感器结合血糖仪用于检测非糖靶目标吸引了研究人员的兴趣与关注,Yu Xiang等[16]利用蔗糖酶作为中介物质,将被测物质浓度与蔗糖酶的催化产物葡萄糖浓度相关联,通过血糖仪检测葡萄糖浓度实现了对DNA分子的检测,目前已扩展到大肠杆菌[17]、肌红蛋白[18]、Cu2+[19]等非糖物质的检测。
近年来,纳米技术在分析和诊断领域应用广泛,纳米材料[20-22](金属纳米材料、量子点、硅纳米材料等)的合成及应用取得了较大进展。纳米金由于小尺寸效应[23-24]、催化活性[25-26]、易修饰等[27]独特性质,成为广泛关注的热点,用于新型传感系统的开发有助于构建简单、灵敏度高、选择性好的纳米金-适体传感器[28-32]。
本实验基于纳米金/蔗糖酶构建核酸适体传感器,利用纳米金较大的比表面积固定蔗糖酶实现对检测信号的转换与放大,基于核酸适体与靶目标强亲和力结合的竞争机制,结合血糖仪实现了对DH的检测,具有操作简便、检测成本低、特异性好的特点。通过选择合适的核酸适体容易实现对致病菌、抗生素等的特异灵敏检测,在医疗卫生和食品安全领域具有较大的研究价值。
1 材料与方法
1.1 材料与试剂
胶体金溶液(20 nm)、DH、蔗糖酶 南京诺唯赞生物科技有限公司;去甲肾上腺素、尿酸和引物上海生工生物工程有限公司;其中引物:DNA1(DH核酸适体):5’-GTC TCT GTG TGC GCC AGA GAA CAC TGG GGC AGA TAT GGG CCA GCA CAG AAT GAG GCC C-(CH2)3-SH-3’;DNA2(DNA1的互补链):5’-GTG TTC TCT GGC GCA CAC AGA GAC ACA GAA TGA GGC CC-(CH2)3-SH-3’;实验用水是电阻为18.2 MΩ的超纯水;磷酸缓冲盐溶液(phosphate buffer saline,PBS)(0.01 mol/L,pH 7.3);Tris-醋酸缓冲液(0.01 mol/L,pH 5.2);蔗糖溶液(0.5 mol/L)和蔗糖酶溶液(1 mg/mL),用PBS做溶剂配制;三(2-羧乙基)膦盐酸盐(tris(2-carboxyethyl)phosphine,TCEP)溶液(0.01 mol/L)和巯基乙醇溶液(1 mmol/L),用Tris-醋酸缓冲液做溶剂配制。
1.2 仪器与设备
GL-16II型离心机 上海安亭科学仪器厂;HZQ-F200型振荡培养箱 北京东联哈尔仪器制造有限公司;07HWS-2数显恒温磁力搅拌器 杭州仪表电机有限公司;电子天平 梅特勒-托利多仪器有限公司;罗氏血糖仪 强生医疗器械有限公司。
1.3 方法
1.3.1 传感器的构造及检测原理
核酸适体传感器结合血糖仪检测DH的原理如图1所示。首先将DNA1(DH核酸适体)固定于修饰有纳米金的96微孔板上做捕获探针,再加入纳米金-蔗糖酶-DNA2检测探针,两者通过碱基互补配对结合。未加入DH时,检测探针结合在微孔板上;加入DH,由于核酸适体与DH的特异性结合力大于碱基互补配对力,所以检测探针脱离微孔板进入上清液中,其脱离量与加入的DH量呈正相关。取出上清液加入蔗糖,蔗糖被检测探针上的蔗糖酶水解为葡萄糖,葡萄糖的量与检测探针的量呈正相关,故建立起葡萄糖与DH之间的线性关系,并通过血糖仪检测葡萄糖浓度间接检测DH浓度。

图1 基于血糖仪检测的DH核酸适体传感器Fig. 1 Schematic demonstration of dopamine hydrochloride aptasensor based on the detection of glucometer
1.3.2 捕获探针DNA1的固定
96微孔板作为DNA1的固定平台,第1步进行纳米金修饰,第2步进行DNA1固定。第1步,微孔中加50 μL 16 mol/L的浓硝酸处理2 h,纯水冲洗3 次,再加入100 μL胶体金溶液,37 ℃培养24 h,纯水冲洗3 次,其中微孔板的材料为聚苯乙烯,具有疏水性,与同为疏水性的纳米金通过疏水作用力结合[33],而进行浓硝酸处理,使表面被腐蚀,增大了纳米金的固定量。第2步,DNA1用TCEP稀释至0.5 μmol/L,活化1 h,取100 μL加入微孔中,DNA1通过S-Au键结合于纳米金,37 ℃培养16 h,再加入50 μL巯基乙醇,37 ℃封闭1 h,最后用50 μL的PBS冲洗3 次,至此完成捕获探针DNA1的固定。
1.3.3 纳米金-蔗糖酶-DNA2检测探针的制备
首先将500 μL蔗糖酶与1 mL胶体金混合,4 ℃培养6 h,再加10 μL 20 μmol/L DNA2(PBS作溶剂),37 ℃振荡16 h(50 r/min),混合液12 000 r/min离心15 min,离心底物用纯水冲洗3 次,洗掉未与纳米金结合的蔗糖酶和DNA2,最后离心底物加入1 mL PBS溶解,4 ℃保存备用,至此完成纳米金-蔗糖酶-DNA2检测探针的制备。
1.3.4 DH的检测
将100 μL检测探针加入到固定有DNA1的微孔中,检测探针与捕获探针通过碱基互补配对结合,37 ℃培养2 h,用PBS冲洗3 次(冲洗掉未结合的检测探针)。加入100 μL不同浓度DH溶液(PBS做溶剂),37 ℃培养2 h,取出微孔板的上清液,并用10 μL的PBS冲洗2 次,将上清液和冲洗液加入离心管,再加入30 μL的蔗糖溶液,37 ℃培养30 min,取2 μL最终培养液用血糖仪检测信号强度。
2 结果与分析
2.1 反应时间优化
由于实验过程涉及到生化反应,为了使反应进行充分,并且在最短的时间内获得较好的实验结果,需对反应时间进行优化。
2.1.1 DH孵育时间优化
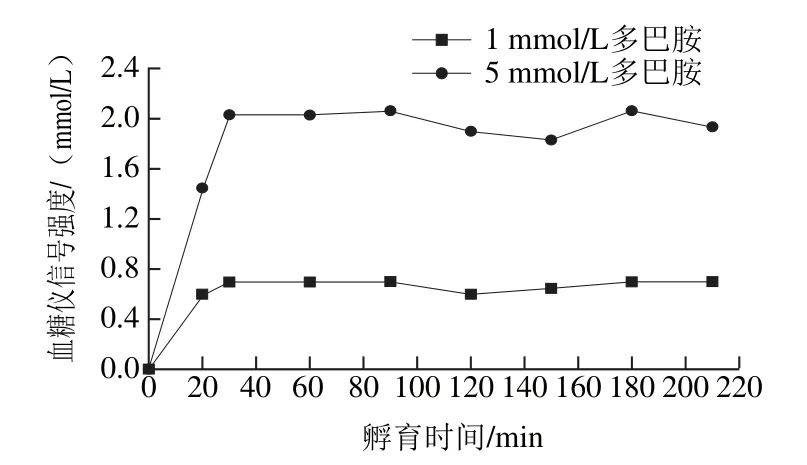
图2 DH孵育时间对血糖仪信号强度的影响Fig. 2 Influence of dopamine hydrochloride incubation time on the glucose meter signal intensity
选择1 mmol/L和5 mmol/L DH,在不同孵育时间下使用血糖仪检测最终葡萄糖浓度,对DH孵育时间进行优化,如图2所示。30 min之前,信号强度随时间延长而增强,此时DH与核酸适体的竞争结合使检测探针脱离捕获探针并催化蔗糖为葡萄糖,检测探针的脱离量随DH孵育时间的延长而增多;30 min之后,信号强度逐渐趋于稳定,此时DH与核酸适体竞争结合完成,检测探针的脱离量不变,其与多巴胺的孵育时间无关,只与DH的加入量有关。故DH的孵育时间最短应选择30 min。
2.1.2 蔗糖酶的催化反应时间优化
选择1 mmol/L和5 mmol/L DH,在不同催化时间下使用血糖仪检测最终葡萄糖浓度,对蔗糖酶催化时间进行优化,结果如图3所示。120 min之前,信号强度随时间的延长而增强,此时检测探针上的蔗糖酶催化蔗糖生成葡萄糖,葡萄糖的生成量与反应时间有关;120 min之后,信号强度逐渐趋于稳定,此时蔗糖酶完成催化,葡萄糖的生成量与反应时间无关,只与蔗糖酶的量(检测探针的量)有关。故蔗糖酶催化反应时间最短应选择120 min。
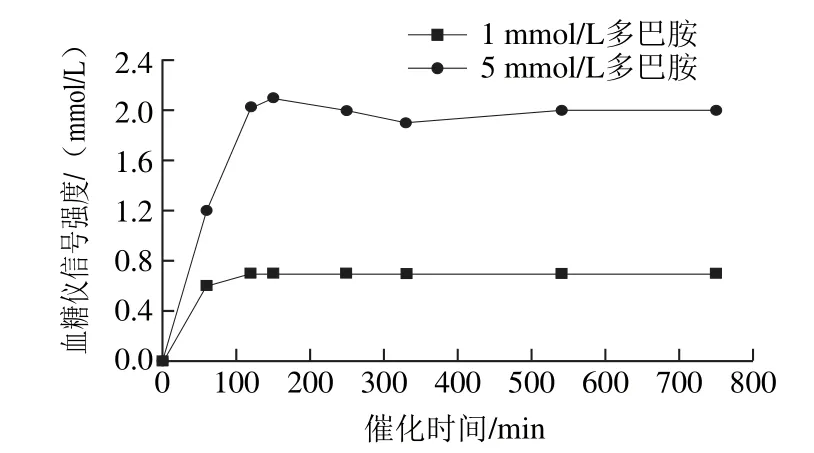
图3 酶的催化反应时间对血糖仪信号强度的影响Fig. 3 The influence of enzymatic reaction times on the signal intensity of glucose meter
2.2 传感器的线性检测范围
在上述实验条件下,加入不同浓度DH(0.45、0.70、1.00、1.50、2.00、2.50、4.00、5.00、10.00 mmol/L)进行检测,血糖仪的信号强度与DH浓度在0.45~10 mmol/L范围内具有良好的线性关系:Y=0.343 6+1.168 4X(其中Y为血糖仪信号强度,X为DH浓度),相关系数R为0.997,检出限(样品中目标分析物能被准确检出的最小量)为0.45 mmol/L。
2.3 传感器的准确性与精确性测定结果
使用血糖仪对DH标准曲线的高中低3 个水平(8.0、3.0、0.8 mmol/L)标准液进行测定(样本数n=5),最终的葡萄糖浓度如表1所示。将葡萄糖浓度代入标准曲线计算DH浓度,结果如表2所示。8.0、3.0、0.8 mmol/L的DH标准液使用该传感器的检测值分别为7.940、2.958、0.838 mmol/L,标准差为0.071 8、0.040 2、0.040 2 mmol/L,相对标准偏差(relative standard deviations,RSD)为0.9%、1.4%、4.8%。故该传感器对DH检测具有较好的准确性和精确性,且对高浓度DH检测的RSD较小。
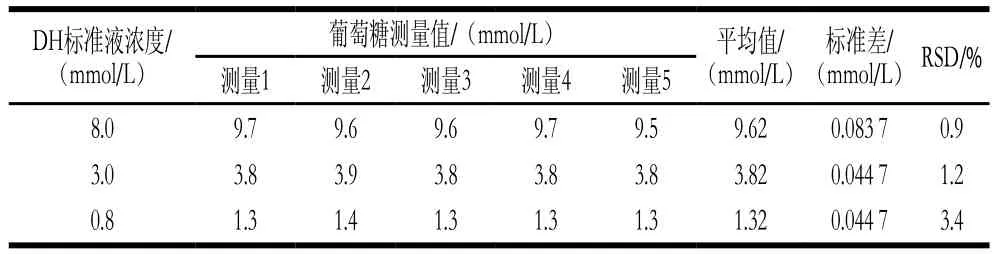
表1 葡萄糖的测量结果Table 1 Results of glucose detection after adding different concentrations of dopamine hydrochloride
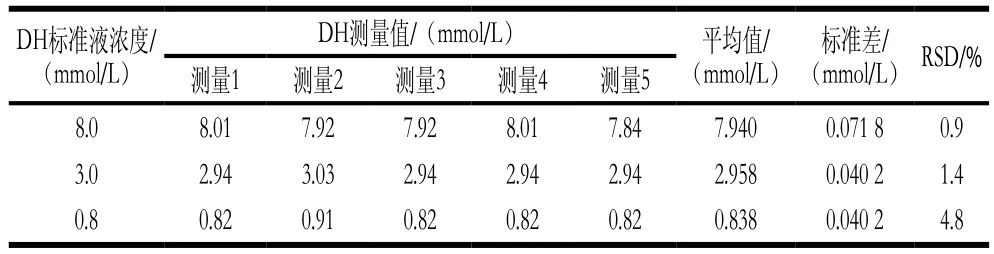
表2 DH的测量结果Table 2 Results of detection of different concentrations of dopamine hydrochloride
2.4 传感器的特异性测定结果
选择DH标准曲线上的一个浓度(0.45 mmol/L),在相同实验条件下,检测同浓度的尿酸、去甲肾上腺素、Na+、K+溶液,结果如图4所示。DH的血糖仪信号强度要明显强于尿酸等干扰物的信号强度,且在实验全程中,采用保鲜膜对微孔板进行物理封闭,减少非特异性背景信号,故该传感器对DH检测具有特异性。
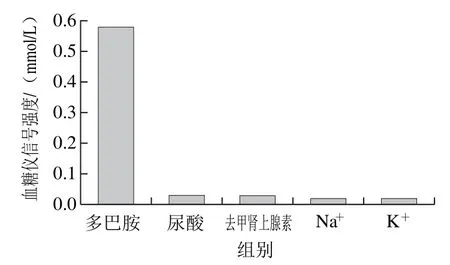
图4 DH检测的特异性(0.45 mmol/L)Fig. 4 Specific detection of dopamine hydrochloride (0.45 mmol/L)
3 结 论
利用核酸适体与靶目标的亲和力强于核酸适体与互补链间的碱基力原理,基于纳米金/蔗糖酶构建竞争型核酸适体传感器,并结合血糖仪实现对DH的检测。结果表明,靶目标孵育时间和蔗糖酶催化时间分别为30 min和120 min;DH的线性检测范围为0.45~10 mmol/L,相关系数为0.997,检出限为0.45 mmol/L。对该传感器的准确性和特异性进行实验验证,表明该方法具有选择性好、稳定性高、操作简单的特点,并在环境监测、食品安全的即时检测方面具有应用前景。目前该方法的检测范围还具有一定局限性,这是由血糖仪自身制备工艺所限制,未来可以通过实验条件的优化以及采取合理的信号放大等方法来改善。
