鸡源致病性奇异变形杆菌分离鉴定及药敏试验
2018-08-25何欣怡
何欣怡,徐 睿,任 丽,唐 强
(西昌学院动物科学院,四川 西昌 615000)
奇异变形杆菌为革兰氏阴性菌,无芽胞、无荚膜、周身鞭毛、形态成明显多形性,其生长繁殖对营养要求不高,4~7℃即可繁殖。该菌广泛存在于人与动物粪便、污水、土壤及临床标本中,其产生的毒素可以引起中毒,是一种常见的条件致病菌。奇异变形杆菌不仅感染鸡、鸽、山羊、奶牛和猪等常见家畜,也可感染猴、狐狸、熊猫和水貂等动物,在动物机体体抗力下降时能够引起外科感染、泌尿系统感染、腹泻和菌血症等[1-8]。近年来,我国河南、河北、山东、安徽、广西等地不断有鸡群暴发奇异变形杆菌病,尤其是在季节更替、环境变化、转群和混合感染其他病原时,鸡群体抗力下降,病情加重,病死率升高,给畜禽养殖带来较大的经济损失[9-10]。
本试验通过对西昌市月华乡、兴胜乡、太和镇、德昌县王所乡鸡场样品进行奇异变形杆菌的分离鉴定、药敏试验和致病力试验,证明该病原菌为奇异变形杆菌,且筛选出敏感药物,为污染控制、疾病防治提供了试验依据。
1 试验材料
1.1 主要试剂 营养肉汤、营养琼脂均购置于青岛高科园海博生物技术有限公司;麦康凯琼脂培养基、水解酪蛋白琼脂、药敏纸片均购置于杭州微生物试剂有限公司;DL 2000 DNA Marker、2×Tap PCR Master Mix、细菌基因组DNA提取试剂盒均购置于天根生化科技(北京)有限公司。
1.2 主要仪器 超净工作台(苏州净化设备有限公司)、基因扩增仪(珠海黑马医学仪器有限公司)、DYY-6C型电泳仪电源(北京市六一仪器厂)、水平电泳槽(北京市六一仪器厂)、切胶仪(天根生化科技(北京)有限公司)等。
1.3 试验动物3日龄健康雏鸡100只。
2 试验方法
2.1 病料的采集 在西昌市月华乡、兴胜乡、太和镇、德昌县王所乡鸡场对疑似奇异变形杆菌病的死鸡进行病理解剖,观察其内部器官,并对其出现病变的部位如肝脏、肠道、脾脏等器官进行病料采集,带回实验室备用。
2.2 细菌的分离培养 在无菌的条件下,将病变组织新鲜切面触压于普通营养琼脂平板,37℃恒温恒湿培养16~18 h,挑选单个典型菌落进行革兰氏染色及镜检。然后再将其接种于麦康凯琼脂平板,伊红美蓝琼脂平板,血平板,37℃培养16~18 h,观察菌落在平板上的生长情况及溶血特征,挑取单个典型菌落进行革兰氏染色后镜检,同时挑取单个菌落接种于营养肉汤培养基37℃180 r/min,震荡培养16~18 h,4℃存放备用。
2.3 分子生物学鉴定
2.3.1 引物设计 通过GenBank中已发表的序列,奇异变形杆菌16S rRNA通用引物。上游引物B27-F:AGAGTTTGATCCTGGCTCAG,下游引物B-1492R:TACGGYTACCTTGTTACGACTT,由上海杰李生物技术有限公司合成。
2.3.2 细菌DNA的制备 按照细菌基因组DNA试剂盒的步骤对纯化细菌进行DNA提取。细菌DNA于-20℃存放。
2.3.3 16S rRNA核苷酸序列扩增PCR 25 μL反应体系:上游引物B27-F:0.5 μL,下游引物B-1492R:0.5 μL,2×Tap PCR Master Mix:12.5 μL,ddH2O:9.5 μL,模板DNA:2 μL。
PCR反应程序:94℃预变性5 min;94℃变性45 s,56℃退火45 s,72℃延伸50 s,35个循环;72℃延伸5 min。反应产物-20℃存放。
2.3.4 琼脂糖凝胶电泳16S rRNA核苷酸序列扩增完成后,取10 μL PCR产物进行1.5%琼脂糖凝胶电泳检测,并置于SDS-PAGE凝胶成像系统成像,观察条带的亮度及初略大小,切下琼脂糖凝胶中目的条带,送往上海杰李生物技术有限公司测序。
2.3.5 序列分析 测序后,利用NCBI网站中Blast检索系统对测序得到的16S rRNA基因序列进行同源性分析,确定菌株的类型。
2.4 药敏试验 使用kirby-bauer(K-B)纸片法进行试验,然后根据美国临床标准委员会(NCCLS)标准将其分为敏感(S)、中介(I)、耐药(R)。
2.5 雏鸡致病力试验 将100只3日龄的健康雏鸡随机分成20组,每组5只。1~18组为试验组,19组为试验对照组,20组为空白对照组,试验组菌液用灭菌肉汤稀释到浑浊度与1.0个麦氏单位浑浊度一致(菌液浓度约为3×108cfu/mL),具体处理方案(如表1)处理后,每隔12 h观察并记录1次雏鸡的精神状况及死亡情况,并对死亡雏鸡进行病理解剖,无菌采集心脏、脾脏、肝脏等病变器官及组织,然后分离培养及鉴定,完成菌株的回收。
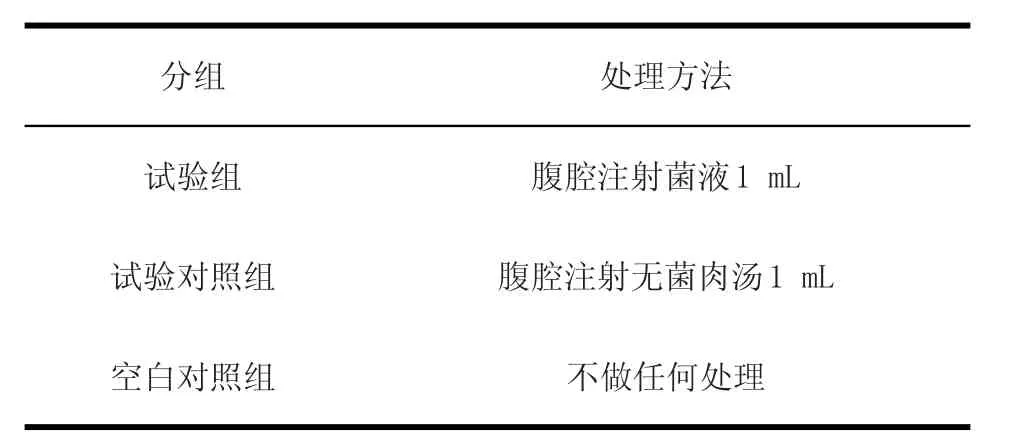
表1 处理方案Table 1 Plan to deal with
3 结果与分析
3.1 细菌的分离培养 营养琼脂上形成乳白色中等大小菌落,菌落边缘整齐,有明显迁徙生长现象,散发特殊的腐败性气味;麦康凯琼脂形成淡红色圆形扁平菌落,表面光滑湿润;鲜血平板上呈无色菌落。镜检结果为的革兰氏阴性细菌,以杆状为主,菌体多两端钝圆。详见图1~4。
3.2 分子学鉴定结果 经16S rRNA基因PCR扩增后,用SDS-PAGE凝胶成像系统成像,扩增得到的相应目的条带在1 000~2 000 bp之间,与预期条带大小初略一致,详见图5。经上海杰李生物技术有限公司测序后,利用NCBI网站中Blast检索系统对测序得到的16S rRNA基因序列进行同源性分析,结果表明扩增序列与GenBank上其他奇异变形杆菌的核苷酸同源性达到99%以上。

图1 营养琼脂平板Fig.1 General Nutrition Tablets

图2 麦康凯平板Fig.2 MacConkey Tablet
图3 鲜血平板Fig.3 Blood plate

图4 镜检Fig.4 Microscope inspection
3.3 药敏试验 随机挑选3个不同养殖场共7株奇异变形杆菌对头孢类、青霉素类、氨基糖苷类、氟喹诺酮类、大环内酯类及四环素类共6种类型抗生素进行药敏试验。根据美国临床标准委员会(NCCLS)标准将其分为敏感(S)、中介(I)、耐药(R)。药敏具体情况见表2。

图5 16S rRNA电泳图Fig.5 Electropherogram of 16S rRNA

表2 奇异变形杆菌药敏试验结果Table 2 Results of drug test of Proteusmirabilis
试验数据表明:7株奇异变形杆菌对头孢一代药物的耐药率为71.4%;对头孢二代药物的耐药率为71.4%;对头孢三代药物的耐药率为14.2%~71.4%;对青霉素类药物的耐药率为14.2%~85.0%;对氨基糖苷类药物的耐药率为0.00%~42.8%;对氟喹诺酮类药物的耐药率为28.5%;对大环内酯类、四环素类药物的耐药率为100%。
3.4 雏鸡致病力试验 试验组雏鸡,先后表现不同程度的精神萎靡,食欲减退,羽毛蓬乱,站立不稳,且喜卧,并且少数雏鸡死亡后还出现角弓反张(见图5)等精神症状。试验组的雏鸡在12 h左右陆续出现死亡,死亡情况详见表2。试验对照组和空白对照组雏鸡精神状况良好。将死亡的雏鸡进行病理解剖,发现主要病变有:脾脏、肾脏有不同程度的肿大;胸腺有出血点(见图6);胆囊肿大充盈;肝缘有淤血(见图7);脑膜有出血、充血(见图8)。在无菌条件下,将死亡雏鸡病变器官和组织用涂抹的方式接种于普通琼脂平板上,分离纯化、鉴定,回收到的菌株与注射的菌株一致。

图 5 角弓反张Fig.5 Antagonist

图 6 胸腺肿大Fig.6 Thymus enlargement
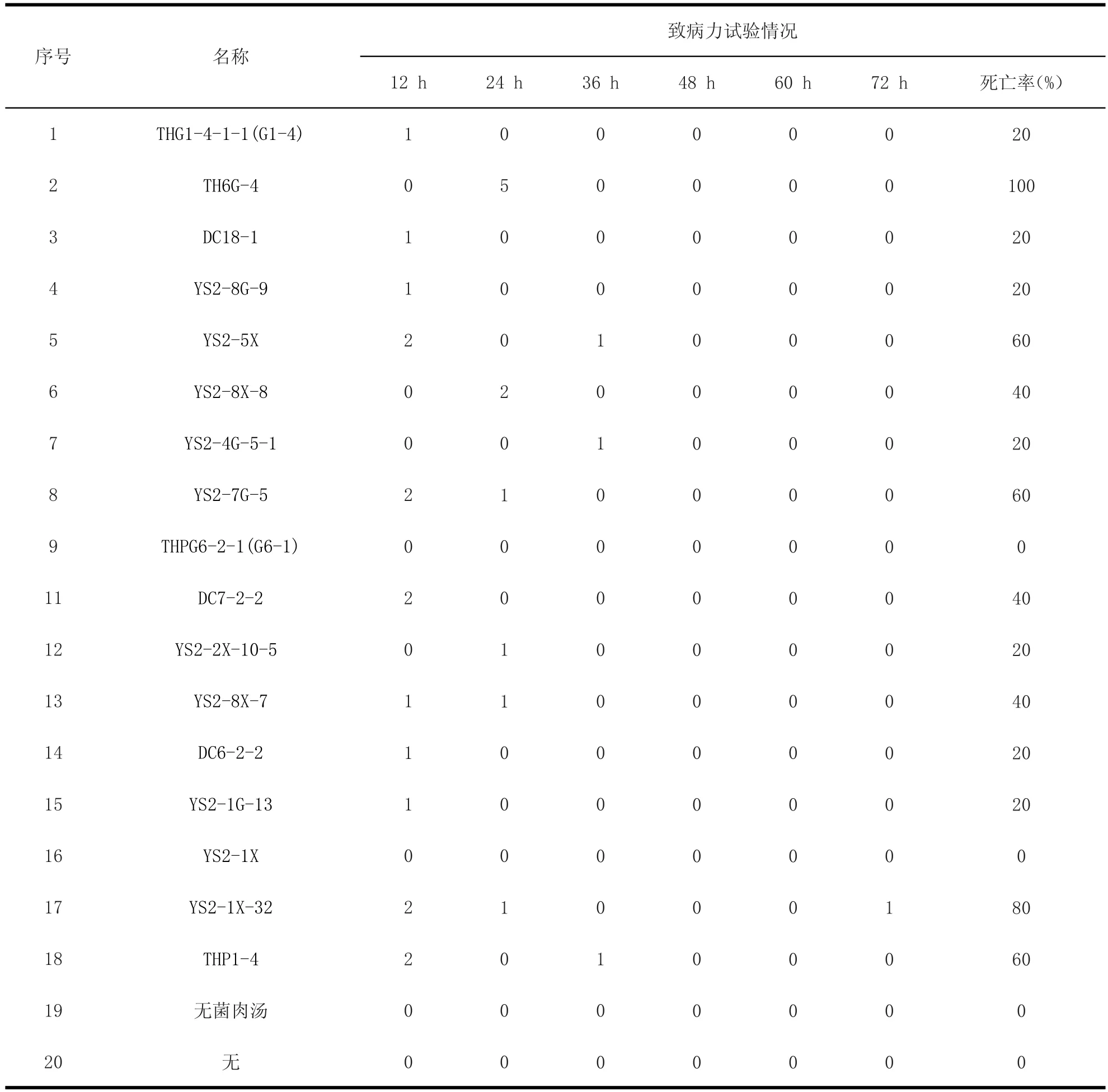
表 3 奇异变形杆菌的致病力试验结果Table 3 Results of pathogenicity test of Proteusmirabilis
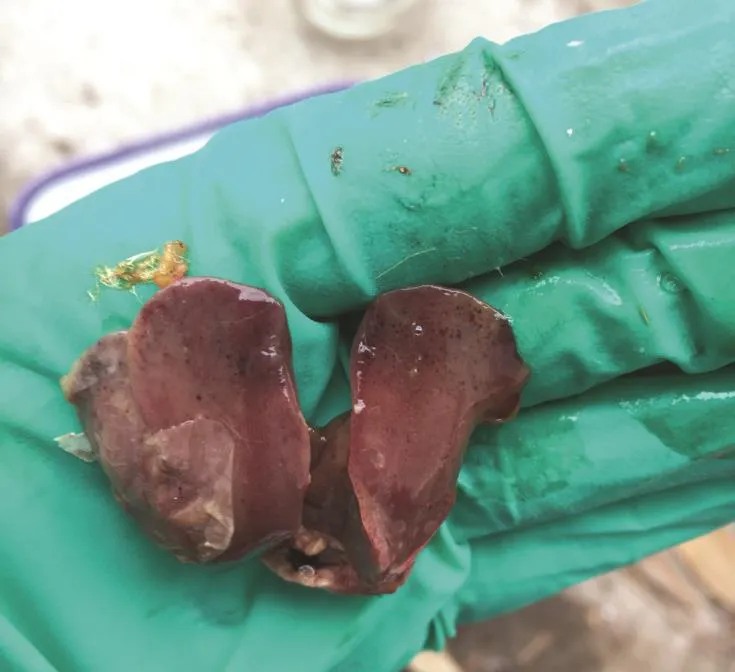
图 7 肝脏淤血Fig.7 Hepatic congestion

图 8 脑膜出血Fig.8 Meningeal Hemorrhage
4 讨论
致病力试验结果表明,18株奇异变形杆菌中有16株具有致死性,其中致死率高于60%有5株,有4株的致死率为40%,有7株的致死率为20%。奇异变形杆菌为条件致病菌,当其与宿主间的生态平衡在某些情况下被打破,就会形成生态失调,从而正常不致病的正常菌群就成为条件致病菌。细菌的寄生部位发生改变、机体免疫功能下降、菌群失调[11]都有可能打破这种平衡,从而导致疾病的发生。
药敏试验结果显示,7株奇异变形杆菌都出现多重耐药性,但因不同地区养殖场使用抗生素情况不同,其耐药情况不完全一致。从总体上看,7株奇异变形杆菌都出现了严重的耐药性,表现为同时对红霉素、麦迪霉素、多西环素、米诺环素共4种抗生素耐药,其中红霉素、麦迪霉素、多西环素的抑菌圈直径均为0。头孢类药物的耐药率为14.2%~71.4%,明显高于年华等[12]相同药物5.4%~59.0%的耐药率,可能由本地区用药情况及耐药菌株的不断衍化造成。丁胺卡那在试验中表现出高敏性,可作为治疗该地区奇异变形杆菌病的首选药物。
结合各采样场实际情况,造成细菌多重耐药的主要原因可能有以下几点:①养殖场为了提高动物性能、改善饲料转化率、预防疾病而在饲料中添加大剂量的抗生素;②在治疗过程中盲目使用抗生素,或使用抗生素治疗不彻底。
临床上,应加大对畜禽舍消毒强度,并提高畜禽自身免疫力;在使用抗生素时,应严格掌握抗菌药物的类型、剂量、给药次数、给药途径、疗程、联合用药及交叉用药,避免出现超剂量使用、长期低剂量使用及无针对性用药等滥用抗生素的现象。有条件最好先进行药敏试验,筛选出敏感药物再进行治疗。
