低温等离子体对蓝莓果实的杀菌效果及对其品质的影响
2018-08-24周丹丹马佩沛
王 卓,周丹丹,彭 菁,屠 康*,马佩沛
(南京农业大学食品科技学院,江苏 南京 210095)
蓝莓为杜鹃花科(Ericaceae)越橘属(Vaccinium spp.)植物的果实,其营养丰富,风味独特,富含多酚,尤其是花青素,具有强抗氧化活性。研究表明,蓝莓具有多种保健功效,如抗氧化、抗糖尿病、抗恶性细胞增生、护肝、抗炎症、预防癌症、保护心脏等功效[1]。近年来蓝莓的种植和消费都呈快速增长趋势,已成为世界上消费量仅次于草莓的第二大浆果。然而由于失水作用和微生物侵染,蓝莓鲜果极易腐烂,货架期短[2]。
软化是限制蓝莓货架期的主要因素。蓝莓采后软化会影响果实的品质、货架期、可运输性和抗病性[3]。微生物侵染是导致蓝莓采后腐败、快速软化的因素之一[4-5]。蓝莓表面附着着大量的酵母、霉菌及潜在的致腐微生物,如:链格孢菌(Alternaria spp. )、灰葡萄孢菌(Botrytis cinerea)、炭疽菌(Colletotrichum spp.)。此外,蓝莓表面的大肠杆菌等病原菌也会对消费者的健康造成威胁[6]。
近年来,低温等离子体技术作为一种新兴的冷杀菌技术应用于食品杀菌领域,受到国内外研究者的关注[7-9]。研究表明,低温等离子体能有效地杀死或钝化细菌、霉菌、酵母及其他有害的微生物,甚至使孢子和生物菌膜失活[10]。在高压电场条件下,介质气体处于高度电离状态,即等离子体,其中含有的多种活性基团和粒子(臭氧、自由电子、自由基、活性氧、NOx、UV光)能破坏细胞结构,破坏微生物的细胞膜和蛋白质,最终导致微生物死亡[11]。与传统化学杀菌方法相比,低温等离子体杀菌时间短、杀菌效果好,且无化学试剂残留,在果蔬杀菌上有着广阔的应用前景[12-14]。Baier等[15]利用氩气等离子体射流处理野苣、黄瓜、苹果和樱桃番茄,发现等离子体处理30 s能有效降低果蔬表面的大肠杆菌。Misra等[16]发现60 kV下低温等离子体处理5 min能减少番茄樱桃上的微生物菌落数量。然而,目前的研究多关注低温等离子体的杀菌效果,对处理后产品贮藏期品质的影响研究较少。
本研究利用介质阻挡放电等离子体设备对蓝莓鲜果进行杀菌处理,探讨低温等离子体对蓝莓表面的杀菌效果及其常温贮藏期间品质的影响,并对蓝莓总抗氧化能力和抗氧化酶活力进行了研究,为低温等离子体应用于蓝莓杀菌保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
供试蓝莓品种为‘灿烂’(Vaccinium ashei cv.Brilliant),2016年7月28日手工采摘于江苏省南京市白马镇蓝莓种植基地。果实在商业成熟时采收,并在2 h内运送至实验室。挑选大小、颜色基本一致,无机械损伤和腐烂的蓝莓果实,置于4 ℃、相对湿度80%~90%条件下预冷24 h。
聚丙烯塑料托盘(130 mm×80 mm×15 mm)购于广东林生公司。
磷酸二氢钠、磷酸氢二钠、氮蓝四唑(nitro-blue tetrazolium,NBT)、交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVPP)、三氯乙酸、硫代巴比妥酸、愈创木酚(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
介质阻挡放电型(dielectric barrier discharge,DBD)低温等离子体设备 美国Phenix Technologies公司;TA. new plus质构仪 美国ISENSO公司;PAL-1型便携式色差计 日本ATAGO公司;UV1800型紫外-可见分光光度计 日本Shimadzu公司;CTHI-250B恒温恒湿箱上海施都凯设备公司。
1.3 方法
1.3.1 低温等离子体处理
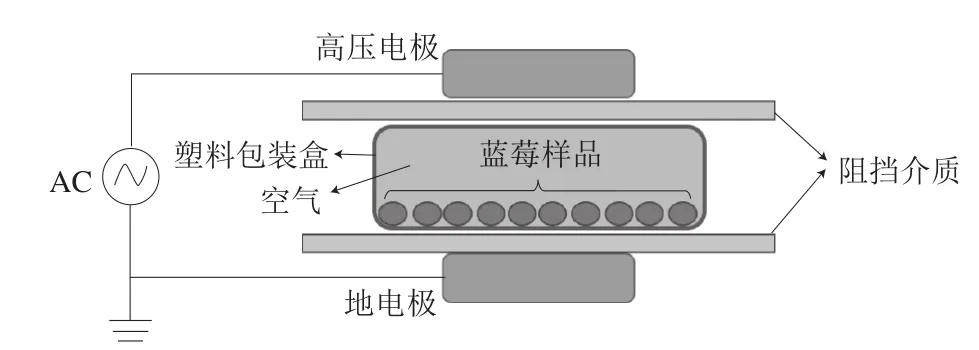
图 1 DBD低温等离子体发生装置示意图Fig. 1 Schematic diagram of DBD cold plasma generator set-up for blueblerry treatment
图1为本实验所用DBD低温等离子体发生装置的示意图。在两个放电电极之间的密闭包装中产生等离子体,主要起杀菌或抑菌作用的是干燥空气中的臭氧和紫外光。通过预实验确定了低温等离子体处理条件,筛选出杀菌效果好且对蓝莓果实特征无影响的处理时间和电压范围。将果实分装于塑料托盘中,用塑料薄膜密封,每盒装120 g(约70 个)蓝莓果实。随机分成2 组,低温等离子体处理组利用DBD低温等离子体设备在工作电压45 kV下处理50 s(工作气体为温度20 ℃、相对湿度48%的空气),对照组不进行低温等离子体处理。处理后立即检测蓝莓表面微生物数量,并将样品置于20 ℃、相对湿度85%的恒温恒湿箱中贮藏8 d,每隔1 d取样检测各项指标,每组3 个重复。
1.3.2 微生物指标的测定
微生物菌落总数:参考Lacombe等[17]的方法,采用涂布平板计数法测定。每组取8 个蓝莓果实(约14 g)于100 mL锥形瓶中,加入25 mL无菌生理盐水,用漩涡仪振荡1 min制成样品液,设置3 个稀释度,分别吸取0.1 mL 样品稀释液于平板计数琼脂 (plate count agar,PCA)培养基和马铃薯葡萄糖琼脂 (potato dextrose agar,PDA)培养基上,涂布均匀。PCA平板在37 ℃培养24~48 h,PDA平板在28 ℃培养5~7 d,分别用以计数细菌菌落总数和酵母霉菌菌落总数。杀菌处理后立即进行微生物指标检测,之后每48 h检测1 次。
1.3.3 蓝莓品质指标测定
腐烂率采用计数法测定[18],果实表面有可见菌丝体生长或汁液外露即为腐烂,腐烂率的计算见公式(1)。
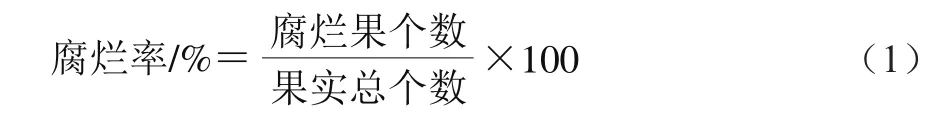
果实硬度采用TA. new plus质构仪测定,选用柱形探头TA/2(直径为2 mm),测试速率为1 mm/s,穿刺深度为5 mm,测定穿刺过程中的最大力即蓝莓硬度。每组测10 个果实,每个果实测2 次。
每组取10 个蓝莓果实,去皮破碎后用3 层纱布过滤,采用PAL-1型数显折光仪测定可溶性固形物质量分数。
可滴定酸质量分数采用电位滴定法测定[19]。用0.1 mol/L NaOH溶液滴定至pH 8.1,以柠檬酸质量分数表示。
VC含量采取钼酸铵比色法测定[20]。称取2.0 g样品果肉,加5 mL草酸-EDTA,冰浴研磨,4 ℃、6 000 r/min离心15 min,取2 mL上清液,依次加入3 mL 0.05 mol/L草酸-EDTA、0.5 mL 1 mg/mL偏磷酸-乙酸、1.0 mL体积分数5%硫酸溶液、2.0 mL质量分数5%钼酸铵溶液,用蒸馏水定容至20 mL。80 ℃水浴1 h,在760 nm波长处测定吸光度。
总酚含量采用乙醇酸比色法测定[21]。取1.0 g样品,加少许体积分数1%盐酸-乙醇溶液冰浴研磨,定容至50 mL。在40 ℃下超声提取1 h后进行10 000 r/min离心5 min,取滤液测定其在240 nm波长处的吸光度。以不同质量浓度的没食子酸(2.0~20.0 mg/L)制作标准曲线,样品总酚含量以每克鲜样中含有的没食子酸质量表示。
花青素含量采用pH示差法测定[22]。根据花青素的发色基团在pH 1.0和pH 4.5间结构的不同,以吸光度之差表示相对花青素含量。利用紫外-可见分光光度计测定pH 1.0和pH 4.5的样品缓冲液在520 nm和700 nm波长处的吸光度。花青素含量计算见式(2)。

式中:M表示矢车菊素-3-葡萄糖苷的摩尔质量,为449.2 g/mol;F表示稀释倍数,为10;e表示矢车菊素-3-葡萄糖苷的摩尔吸光系数,为26 900 L/(mol·cm);L表示比色皿光路长,为1 cm。
总抗氧化能力采用亚铁还原能力(ferric reducing ability of plasma,FRAP)法测定[23]。称取0.5 g样品,加10 mL体积分数1%盐酸-乙醇溶液,冰浴研磨,于4 ℃、8 000×g离心10 min,取上清液备用。取5 μL样品提取液,加入180 μL FRAP工作液(含150 μL 0.3mol/L醋酸缓冲液(pH 3.6)、15 μL 10 mmol/L 三吡啶基三嗪溶液、15 μL 20 mmol/L FeCl3溶液),混匀,反应6 min,用酶标仪测定593 nm波长处的吸光度。
1.3.4 抗氧化酶活力的测定
超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、多酚氧化酶(ascorbate peroxidase,PPO)活力的测定参照《果蔬采后生理生化实验指导》[19]中的方法并稍作修改。
抗氧化酶液的提取:准确称取1.0 g样品于研钵中,加入3.0 mL 0.1 mol/L磷酸盐缓冲液,冰浴研磨,于4 ℃、12 000×g离心30 min,取上清液备用。
S O D活力采用比色法测定。在试管中依次加入1.7 mL 50 mmol/L pH 7.5的磷酸盐缓冲液、0.3 mL 130 mmol/L蛋氨酸溶液、0.3 mL 750 μmol/L NBT溶液、0.3 mL 100 μmol/L乙二胺四乙酸二钠溶液、0.3 mL 20 μmol/L核黄素溶液和0.1 mL酶提取液。将对照管置于暗处,其他各管置于4 000 lx日光灯下反应5 min后取出,置于暗处终止反应。以不照光管作空白参比调零,于560 nm波长处测其他各管吸光度。以每克样品的反应体系对NBT光化还原抑制50%时所需的酶量为一个SOD活力单位。
CAT活力采用比色法测定。取2.8 mL 20 mmol/L H2O2溶液和200 μL酶提取液。以蒸馏水为参比空白,在反应15 s时开始记录反应体系在240 nm波长处吸光度。以每克样品每分钟吸光度减少0.01为一个CAT活力单位。
POD活力采用愈创木酚法测定。取3.0 mL 25 mmol/L愈创木酚溶液和0.5 mL酶提取液,再加入20 μL 0.5 mol/L H2O2溶液迅速混合启动反应,同时开始计时。以蒸馏水为参比,在反应15 s时开始记录反应体系在470 nm波长处的吸光度。以每克样品每分钟吸光度增加0.01为一个POD活力单位。
P P O活力采用比色法测定。在试管中加入2.0 mL 0.1 mol/L pH 6.4磷酸盐缓冲液和1.0 mL 50 mmol/L邻苯二酚溶液,最后加入0.5 mL酶提取液,同时开始计时。在反应15 s时开始记录反应体系在420 nm波长处吸光度。以每克样品每分钟吸光度变化1为一个PPO活力单位。
1.4 数据分析
数据表示为平均值±标准差。采用SPSS 22进行数据统计分析,差异显著性采用邓肯多重比较检验,P<0.05表示差异显著。
2 结果与分析
2.1 低温等离子体处理对蓝莓的杀菌效果
图2为等离子体处理组和对照组蓝莓在贮藏期间表面微生物菌落总数的变化。蓝莓表面微生物数量在20 ℃贮藏期间呈上升趋势,低温等离子体处理可有效降低蓝莓微生物数量(细菌、霉菌和酵母),且在整个贮藏期间微生物数量都明显低于对照组。低温等离子体处理后立即检测蓝莓表面微生物数量,发现细菌、霉菌和酵母菌落总数分别下降了1.75(lg(CFU/g))和1.77(lg(CFU/g)),贮藏第8天时,细菌、霉菌和酵母菌落总数分别比对照组低2.01(lg(CFU/g))和2.09(lg(CFU/g)),可见低温等离子体能够有效抑制微生物的生长,对蓝莓常温贮藏期间表面微生物数量具有良好的控制作用。

图 2 低温等离子体处理后蓝莓在20 ℃贮藏期间表面细菌(A)和酵母、霉菌(B)菌落总数变化Fig. 2 Effect of CP treatment on total aerobic mesophilic bacteria (A),and yeast/mold (B) counts on blueberries stored at 20 ℃
2.2 低温等离子体处理对蓝莓果实品质的影响
2.2.1 腐烂率和硬度

图 3 低温等离子体处理后蓝莓在20 ℃贮藏期间腐烂率(A)和硬度(B)变化Fig. 3 Effect of CP treatment on decay incidence (A) and firmness (B)of blueberries stored at 20 ℃
蓝莓果实在贮藏期间易受微生物侵染而发生腐烂。腐烂率直接影响蓝莓鲜果货架期的长短。由图3A可知,蓝莓在贮藏期间腐烂率持续上升。贮藏前2 d,基本没有腐烂;对照组从第4天开始腐烂率明显升高,为10.24%;到第8天时,腐烂率达到39.36%。低温等离子体处理组在贮藏期间,腐烂率明显低于对照组,在贮藏结束时腐烂率仅为11.18%。可能是因为低温等离子体抑制了微生物的生长,从而降低腐烂率,延长了蓝莓鲜果的货架期。
果实硬度是影响蓝莓品质的主要因素之一,过度软化会导致蓝莓品质下降,降低鲜果的商品价值。如图3B所示,蓝莓在贮藏过程中,果实硬度逐渐下降,在贮藏第8天,果实硬度已下降至1.2 N。经低温等离子体处理的蓝莓在贮藏2~4 d硬度增大,且在之后的贮藏过程中能较好地维持果实硬度。从贮藏第4天起,处理组蓝莓的硬度显著高于对照组。低温等离子体处理可能抑制了蓝莓细胞壁水解酶的活力,抑制了果胶、半纤维素、纤维素等物质的水解,同时可能促进了木质素等的合成,从而抑制了果实硬度的下降。
2.2.2 可溶性固形物和可滴定酸质量分数

图 4 低温等离子体处理后蓝莓在20 ℃贮藏期间可溶性固形物(A)和可滴定酸(B)质量分数变化Fig. 4 Effect of CP treatment on soluble solid (A) and titratable acidity(B) contents of blueberries stored at 20 ℃
可溶性固形物质量分数在果实贮藏过程中的变化一方面是由于大分子物质的降解;另一方面是作为呼吸的底物被消耗。从图4A可以看出,对照组的可溶性固形物由于作为果实呼吸底物被消耗,可溶性固形物质量分数在贮藏前期下降,贮藏后期由于果实软化而上升。低温等离子体处理组在贮藏后期可溶性固形物质量分数低于对照组,可能是由于低温等离子体延缓了果实软化,抑制了大分子物质的降解。图4B为蓝莓贮藏期间可滴定酸质量分数的变化。对照组的可滴定酸作为呼吸底物之一被消耗,在贮藏前期其质量分数逐渐下降,在第4天降至最低值0.68%,之后可滴定酸质量分数开始上升,可能是腐烂导致的。而低温等离子体处理组在贮藏后期未引起可滴定酸质量分数的明显上升,可能是由于低温等离子体处理抑制了蓝莓表面微生物生长,减少了腐烂的发生。
2.2.3 VC、总酚、花青素含量

图 5 低温等离子体处理后蓝莓在20 ℃贮藏期间VC(A)、总酚(B)、花青素(C)含量的变化Fig. 5 Effect of CP treatment on VC (A), total phenolics (B) and total anthocyanin (C) contents of blueberries stored at 20 ℃
如图5A所示,蓝莓在20 ℃贮藏期间VC含量呈逐渐下降的趋势。低温等离子体处理组在贮藏2~4 d VC含量上升,在第4天比对照组高23.82 mg/100 g。贮藏4 d后,处理组VC含量显著高于对照组。到贮藏第8 天,处理组VC含量比对照组高11.11 mg/100 g。
蓝莓中酚类物质主要由类黄酮(主要为花青素)和酚酸组成。如图5B所示,对照组蓝莓在20 ℃贮藏期间,总酚含量呈先上升后下降的趋势,在贮藏第2天达到最高值。低温等离子体处理组在贮藏前期总酚含量较对照组低,可能是由于等离子体含有自由基等很多反应活性物质,引起了酚类等生物活性物质的氧化,但在贮藏后期,总酚含量保持平稳,没有明显下降。花青素具有强抗氧化作用,主要存在于蓝莓果皮中。如图5C所示,蓝莓在贮藏期间花青素含量也呈先上升后下降趋势。贮藏前期,可能是由于果实中的原花青素分解,从而对照组花青素含量增加。在贮藏2 d后,青素含量开始逐渐下降,可能是衰老引起了花青素的氧化分解。低温等离子体处理组在贮藏前期组花青素含量有所下降,但贮藏后期花青素含量基本保持稳定,未有明显下降,与对照组相比能更好地保持花青素的含量。
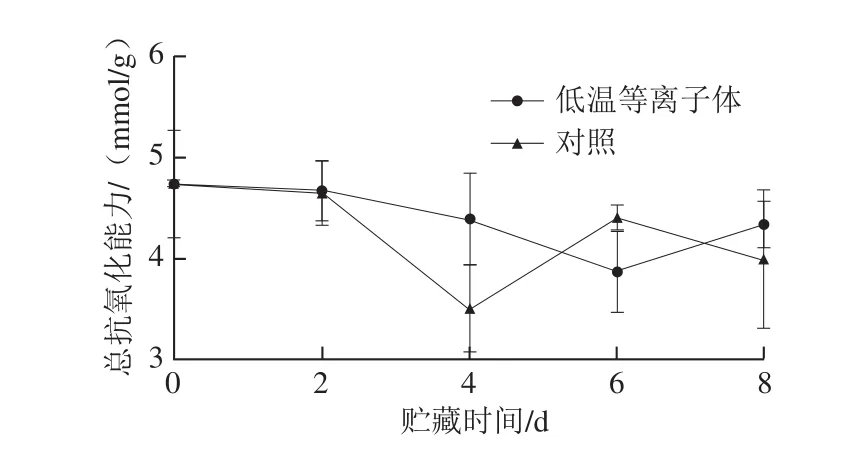
图 6 低温等离子体处理后蓝莓在20 ℃贮藏期间的总抗氧化能力的变化Fig. 6 Effect of CP treatment on total antioxidant capacity of blueberries stored at 20 ℃
2.2.4 总抗氧化能力蓝莓总抗氧化能力主要由类黄酮(花青素为主)、单宁、酚酸、VC等物质含量决定。由图6可以看出,低温等离子体处理组蓝莓总抗氧化能力与对照组相比没有显著性差异,且在整个贮藏期间,蓝莓总抗氧化能力变化不大。低温等离子体处理引起了花青素等酚类含量的降低,促进了VC的积累,可能由于这些抗氧化物质共同作用,维持了蓝莓总抗氧化能力的平衡。由此可以推断,低温等离子体处理对蓝莓总抗氧化能力没有显著影响。
2.3 低温等离子体处理对蓝莓抗氧化酶系活力的影响

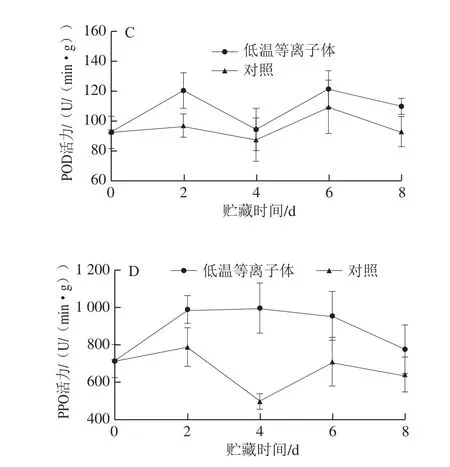
图 7 低温等离子体处理后蓝莓在20 ℃贮藏期间SOD(A)、CAT(B)、POD(C)和PPO(D)活力的变化Fig. 7 Effect of CP treatment on SOD (A), CAT (B), POD (C) and PPO (D) activities in blueberries stored at 20 ℃
SOD、CAT、POD是蓝莓体内重要的抗氧化酶。SOD能够催化超氧阴离子自由基发生歧化反应,将其快速歧化为H2O2和H2O,从而清除超氧阴离子自由基,产生的H2O2由CAT、POD等酶再分解为H2O和O2,以减少H2O2对果实细胞组织可能造成的氧化伤害。如图7所示,4 d后,蓝莓SOD和CAT活力逐渐下降,POD活力先上升后又下降。从图7A可以看出,处理组SOD活力在贮藏期间始终高于对照组,在贮藏第2 天,处理组与对照组SOD活力分别为498.16 U/(min·g)和408.10 U/(min·g),可能是低温等离子体诱导了蓝莓SOD活力。从图7B可以看出,处理组CAT活力先上升后下降,在贮藏第4天时达到最大值13 615 U/(min·g)。图7C表明,处理组和对照组POD活力在前2 d均上升,第2天时处理组为120.48 U/(min·g),而对照组为97.24 U/(min·g)。由此推断,等离子体处理可能诱导了蓝莓SOD、CAT和POD活力,从而促进体内H2O2的清除,减轻了自由基对组织的侵害。
PPO可以催化多种简单酚类物质氧化形成醌类物质,醌类物质进一步聚合形成深色的聚合物,同时可以催化木质素的合成。从图7D可以看出,对照组蓝莓在贮藏期间PPO活力先下降后上升。而处理组PPO活力呈先上升后下降的趋势,且在贮藏期间PPO活力显著高于对照组,这可能是由于低温等离子体处理诱导了蓝莓贮藏初期PPO活力的上升。由此推断,等离子体处理可能是通过提高蓝莓PPO活力,促进花青素的降解和木质素的合成,从而引起贮藏前期总酚和花青素含量的下降,抑制了硬度的降低。
3 讨 论
目前应用于蓝莓的杀菌方法主要为氯水消毒[24],但其杀菌能力有限,且易造成化学残留。紫外线、超声和臭氧等非热杀菌技术,通常需要20~60 min才能有效降低病原菌和腐败微生物数量[25-28]。本研究结果表明,利用45 kV电压下产生的低温等离子体处理蓝莓50 s,能显著降低蓝莓表面微生物数量,细菌和霉菌酵母分别下降1.75(lg(CFU/g))和1.77(lg(CFU/g)),且在20℃贮藏期间也能较好地抑制微生物的生长,贮藏第8天时,细菌和霉菌酵母数量分别比对照组低2.01(lg(CFU/g))和2.09(lg(CFU/g))。低温等离子体处理组在20 ℃贮藏8 d后,腐烂率仅为11.18%,而对照组腐烂率达到39.36%,可见低温等离子体能够有效抑制蓝莓表面微生物的生长,减少腐烂的发生。这与Lacombe等[17]利用低温等离子体射流处理蓝莓并在4 ℃贮藏条件下的研究结果一致。由于低温等离子体含有多种活性物质,可能产生了协同杀菌作用,因而比单一的紫外或电子辐照等杀菌方法更快速高效。
然而,低温等离子体中的带电粒子和反应活性物质可能会对果蔬物理化学性质和营养成分产生不利影响。等离子体可能引起酚类、花青素等的氧化,从而降低其抗氧化能力,但是在一定范围内,轻微的氧化是可以被接受的[29]。也有研究表明,由于采后酚类物质的代谢,蓝莓贮藏期间抗氧化能力无显著变化[30-31]。本实验对低温等离子体处理后的蓝莓在20 ℃贮藏期间的品质进行了初步评价,研究结果显示,低温等离子体处理抑制了蓝莓的硬度和VC含量的下降,花青素和总酚含量在贮藏初期略有下降,但对总抗氧化能力无显著影响。与对照组相比,低温等离子体处理可提高蓝莓抗氧化酶SOD、CAT、POD的活力,促进超氧阴离子自由基的清除,同时可提高PPO活力,促进蓝莓酚类氧化形成醌类,催化木质素合成。
综上,低温等离子体对蓝莓表面的微生物具有良好的抑制作用,能提高蓝莓常温贮藏期间的品质,能够作为一种冷杀菌方法应用于蓝莓杀菌保鲜中。目前低温等离子体技术在食品方面的应用研究仍处于初级阶段,其杀菌机理还有待进一步研究。
