蛇床子素对大鼠颈动脉内膜增生的影响
2018-08-20张宇孙淑娴马威李昌义王斌王兆祥亢小丽纪征
张宇,孙淑娴,马威,李昌义,王斌,王兆祥,亢小丽,纪征
(河北省唐山工人医院 心内一科,河北 唐山 063000)
冠状动脉疾病通过经皮冠状动脉介入治疗,虽然可以改善患者的心肌血流灌注,但是术后再狭窄成为主要临床问题。由于术后受损血管的自我修复,导致炎症的发生、血管平滑肌细胞增殖并向内膜迁移,从而使血管内膜增厚及再狭窄发生[1]。有研究表明,Toll样受体TLR4(toll-like receptor, TLR4)与核转录因子κB(nuclear transcription factor kappa B, NF-κB)信号通路参与受损血管内膜增生[2-4]。因此阻断TLR4/NF-κB表达,可有效抑制炎症反应、减轻细胞增殖、防止术后再狭窄。蛇床子素为香豆素化合物,常见于蛇床、当归等伞形科中药材,具有抗炎、抗氧化、调节血脂、改善记忆等药理作用[5-6]。本研究采用大鼠颈动脉内皮损伤的模型,予以蛇床子素后,观察其对血管内膜和平滑肌细胞增殖的影响,并对其机制进行探讨。
1 材料与方法
1.1 材料
蛇床子素(中国药品检验所,纯度>98%),小鼠增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体、DyLight 594红色荧光二抗购自美国Santa Cruz公司,BSA封闭液、DAB显色试剂盒、TBST缓冲液、枸橼酸盐缓冲液购自北京索莱宝生物技术有限公司,TNF-α、IL-1β酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA) 试剂盒购自大连凡邦生物科技有限公司,切片机(德国Leica公司CM1900),自动染色机(德国Leica公司AUTOSTAINERXL),自动封片机(德国Leica公司CV5030),光学显微镜(日本Olympus公司BX51),病理图像分析软件Image-Pro Plus 6.0(美国Media Cybernetics公司)。
1.2 动物模型的复制与分组
1.2.1 大鼠颈动脉球囊损伤模型的复制 SD大鼠腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉,颈正中线切口,通过颈外静脉注射肝素钠(100 u/kg),夹闭颈总动脉近心端和颈内动脉远心端,进而阻断血流。于颈外动脉远心端处,剪出斜形切口,在颈外动脉切口处将导引钢丝和PTCA球囊导管(l.5 mm×20.0 mm)逆行插入颈总动脉,距颈外动脉分叉处2.5 cm,向球囊内注入生理盐水直至球囊充盈,抽动并旋转球囊,从而剥脱内膜。假手术组不插入球囊导管,其余各组平行操作。给药干预16 d后处死所有动物,分离左颈总动脉进行实验[7]。
1.2.2 实验动物分组 健康雄性SD大鼠,体重250~300 g,由北京大学实验动物学部提供。实验动物随机分为4组:①假手术组;②模型组:颈动脉球囊损伤组+0.9% NaCl;③低剂量蛇床子素组:颈动脉球囊损伤+10 mg/(kg·d)蛇床子素,1次/d;④高剂量蛇床子素组:颈动脉球囊损伤+30 mg/(kg·d)蛇床子素,1次/d。
1.3 苏木精-伊红染色法
采用苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,显微镜下观察血管内膜的病理变化,通过Image-Pro Plus 6.0图像分析软件,测量各组血管内膜和中膜面积比(intima/media,I/M)[8]。
1.4 免疫组织化学法荧光染色
采用免疫组织化学法检测斑块内PCNA[9-10],组织切片脱蜡后,抗原修复15 min,一抗4℃孵育过夜,荧光二抗37℃避光孵育40 min,PBS漂洗,中性树胶封片。每张切片随机观察3个不同视野,计算PCNA阳性表达指数,PCNA阳性表达指数=PCNA阳性细胞数/细胞总数×100%。
1.5 ELISA
采用ELISA检测损伤血管TNF-α和IL-1β水平。受损血管预冷PBS洗涤,滤纸吸干水分,加入RIPA裂解液后,在冰水中充分研磨5 min,低温高速离心机4℃、12 000 r/min离心10 min,取上清,按照试剂盒说明书检测TNF-α和IL-1β水平。
1.6 Western blot检测
收集各组血管,PBS洗2次,用蛋白裂解液在冰上研磨血管3 min,提取蛋白,4℃、12 000 r/min离心10 min,取上清液测定蛋白浓度,配平各组蛋白浓度,蛋白变性,SDS-PAGE电泳后转膜至PVDF膜上,5%脱脂牛奶封闭2 h,NF-κB p65(1∶500)或TLR4(1∶200)4℃冰箱过夜,弃一抗,TBST洗膜3次,5 min/次;将膜转入杂交袋,室温孵育二抗(1∶5 000)2 h,弃二抗,TBST洗膜3次,5 min/次;ECL系统显影,采用β-actin作为内参,计算相对灰度值,实验重复3次。
1.7 统计学方法
数据处理采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,多组比较用单因素方差分析(One-way ANOVA),组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠血管结构的改变
大鼠球囊损伤后可见动脉内皮剥脱,部分内弹力板由正常的波浪状变平坦,失去弹性;并且新生内膜形成并增厚,新生内膜中可见大量血管平滑肌细胞,纤维成分增多,管腔呈向心或偏心性狭窄,中膜可见血管平滑肌细胞排列紊乱。假手术组、模型组和高、低剂量蛇床子素组的I/M比值分别为(0.14±0.03)、(0.87±0.13)、(0.45±0.14)和(0.56±0.16),经方差分析,差异有统计学意义(F=25.768,P=0.000)。进一步两两比较经LSD-t检验,与假手术组比较,模型组I/M比值升高(t=5.864,P=0.000);低剂量和高剂量蛇床子素组的I/M比值与模型组比较,差异有统计学意义(t=3.004和3.281,P=0.032和0.027),低剂量和高剂量蛇床子素组血管壁厚度减小,抑制了新生内膜的形成。见图1。
2.2 新生血管内膜中PCNA的表达
PCNA染色阳性细胞呈红色荧光。假手术组、模型组和高、低剂量蛇床子素组的PCNA表达指数分别为(20.1±1.2)%、(54.8±4.9)%、(28.3±3.9)%和(41.2±4.1)%,经方差分析,差异有统计学意义(F=17.476,P=0.000)。进一步两两比较经LSD-t检验,模型组与假手术组比较,差异有统计学意义(t=7.104,P=0.000),模型组新生平滑基层可见大量的阳性表达细胞;低剂量和高剂量蛇床子素组与模型组比较,差异有统计学意义(t=2.564和4.132,P=0.034和0.028),低剂量和高剂量蛇床子素组的新生平滑基层PCNA阳性细胞数较少。见图2。
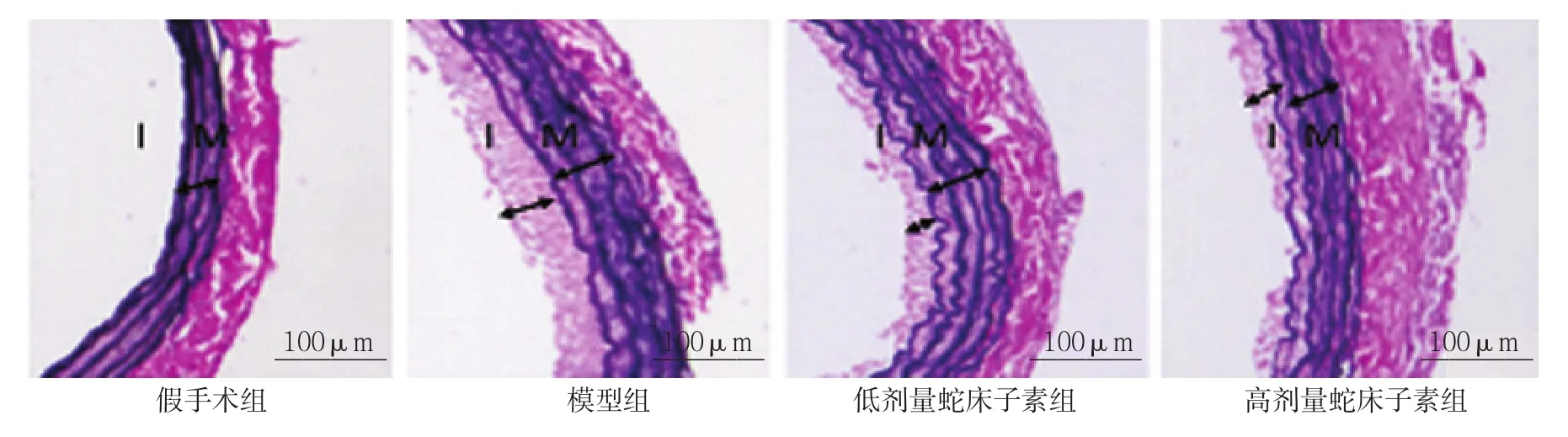
图1 各组大鼠颈动脉 (HE)
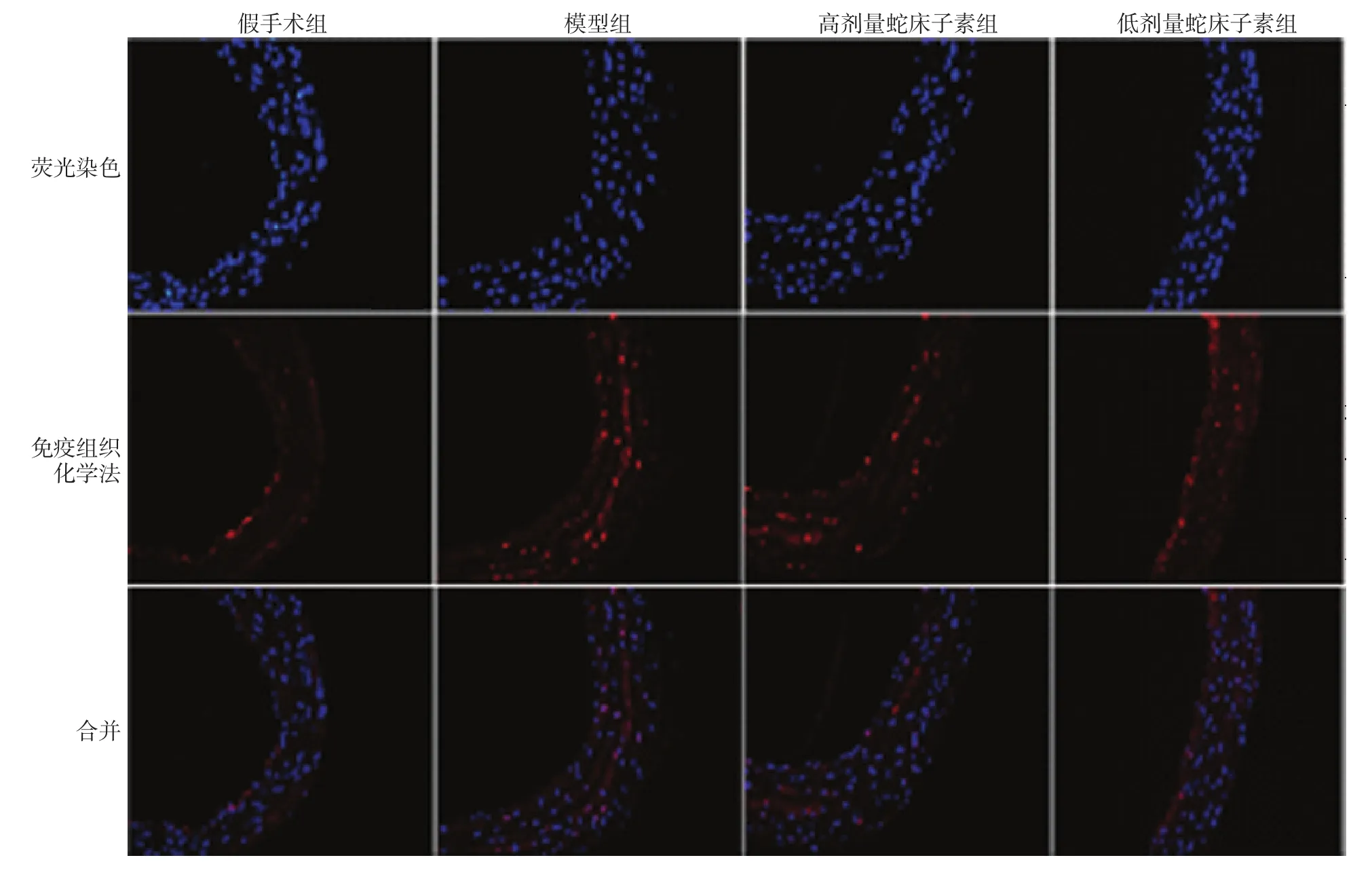
图2 各组新生血管内膜中PCNA的表达 (×400)
2.3 受损血管TNF-α和IL-1β水平
各组TNF-α和IL-1β水平比较,经方差分析,差异有统计学意义(P<0.05),模型成立。模型组较假手术组大鼠血管TNF-α和IL-1β水平升高(P<0.05)。进一步两两比较经LSD-t检验,低剂量蛇床子素组TNF-α和IL-1β水平低于模型组(P<0.05);高剂量蛇床子素组TNF-α和IL-1β水平低于模型组(P<0.05)。见表1。
表1 各组受损血管TNF-α和IL-1β水平比较(pg/ml,±s)

表1 各组受损血管TNF-α和IL-1β水平比较(pg/ml,±s)
注:1)与假手术组比较,P <0.05;2)与模型组比较,P <0.05
组别 TNF-α IL-1β假手术组(n =8) 38.7±4.2 22.5±2.5模型组(n =7) 103.8±5.21) 59.1±4.31)低剂量蛇床子素组(n =7) 83.5±8.12) 41.9±5.22)高剂量蛇床子素组(n =8) 56.2±5.32) 34.3±5.52)F值 74.080 34.424 P值 0.000 0.000
2.4 各组血管NF-κB和TLR4蛋白表达的变化
各组NF-κB和TLR4蛋白表达水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,模型组NF-κB蛋白表达水平较假手术组升高(P<0.05);不同剂量蛇床子素给药干预后,较模型组NF-κB蛋白表达水平降低(P<0.05)。模型组TLR4蛋白表达水平较假手术组升高(P<0.05);而给予高、低剂量蛇床子素后,可抑制TLR4蛋白过表达(P<0.05)。见表2和图3。
表2 各组血管NF-κB 和TLR4蛋白表达水平比较 (±s)

表2 各组血管NF-κB 和TLR4蛋白表达水平比较 (±s)
注:1)与假手术组比较,P <0.05;2)与模型组比较,P <0.05
组别 NF-κB TLR4假手术组(n =8) 0.156±0.017 0.214±0.065模型组(n =7) 0.643±0.0181) 0.582±0.0601)低剂量蛇床子素组(n =7) 0.359±0.0202) 0.317 ± 0.0412)高剂量蛇床子素组(n =8) 0.282±0.0422) 0.257 ± 0.0432)F值 184.069 28.827 P值 0.000 0.000

图3 各组血管NF-κB和TLR4蛋白的表达
3 讨论
预防术后再狭窄是当前心血管病学研究领域所面临的重要课题之一。研究表明,球囊扩张对血管壁的直接损伤导致多种炎症应答、细胞生长因子的释放和血管平滑肌细胞的增殖、迁移、表型改变,以及血管内膜增生,共同造成术后再狭窄的发生[11-12]。本实验采用不同剂量蛇床子素治疗颈动脉球囊损伤大鼠。HE染色结果表明,模型组I/M比值高于假手术组,蛇床子素给药干预后,与模型组比较I/M比值降低,表明蛇床子素具有抑制内膜增生的作用。
PCNA只存在于正常增殖细胞和肿瘤细胞,参与细胞DNA的合成,反映细胞增殖状态。因此,通过其表达的高低可以间接反映血管平滑肌细胞的增殖情况。实验结果显示,模型组大鼠新生内膜中PCNA阳性表达指数最高,在蛇床子素组,新生内膜中PCNA阳性表达指数较模型组降低,说明蛇床子素通过抑制血管平滑肌细胞的增殖,从而降低新生内膜的增生。
TLR可以调控获得性免疫应答类,TLR4介导的炎症细胞发挥重要作用,其与增殖的血管平滑肌细胞参与动脉粥样硬化形成和再狭窄[13]。激活状态的TLR4可活化NF-κB,产生趋化因子和细胞因子,如IL-1β、TNFα[14-15]。NF-κB激活介导炎症级联反应,血栓形成,刺激炎症基因持续表达,促进TNF-α、IL-lβ的分泌,导致新生内膜形成,促使其增殖、迁移,最终导致血管壁发生病理改变。因此,有效控制炎症反应是控制术后再狭窄发生、发展的有效途径之一[16]。抑制TLR4/NF-κB激活便可有效阻止其介导的下游炎症反应,阻断其调节血管平滑肌细胞增殖。本研究结果发现,蛇床子素可以降低球囊损伤大鼠动脉血管TLR4/NF-κB的表达和炎症介质TNF-α、IL-lβ水平,进而延缓或减轻移植静脉再狭窄的病变程度。
总之,蛇床子素通过抑制TLR4/NF-κB的表达,减少炎症因子TNF-α和IL-1β的生成,抑制大鼠颈动脉球囊损伤后诱导的内膜增生、血管平滑肌细胞增殖。本研究为临床应用蛇床子素,预防术后再狭窄的发生提供了实验依据。
