CDH17对那可丁耐药性结肠癌细胞裸鼠移植瘤模型的影响*
2018-08-20朱庆曦黄晓东刘蒙韩峥谭洁刘维洁陈巍田霞
朱庆曦,黄晓东,刘蒙,韩峥,谭洁,刘维洁,陈巍,田霞
[武汉大学同仁医院(湖北省武汉市第三医院) 消化内科,湖北 武汉 430060]
结肠癌是全球常见的消化道恶性肿瘤之一,居世界癌症相关致死率的第2位,每年约70万患者死于结肠癌。目前结肠癌的治疗是以手术切除为主的综合治疗,化学治疗为辅,但是大多数患者在治疗后容易复发[1]。市面上有多种抗肿瘤药物,其中那可丁作为一种外周性镇咳药,能抑制肺牵张反射引起的咳嗽[2]。其可通过与微管结合、线粒体途径诱导部分肿瘤或影响正常细胞周期进程,从而促进细胞凋亡[3-5]。尽管实验证实那可丁没有明显的毒副作用[6-7],但是肿瘤细胞存在对那可丁产生耐药性问题。本研究主要探索如何增强那可丁抗肿瘤的作用,同时降低其耐药性。
1 材料与方法
1.1 材料
那可丁(美国Sigma-Aldrich公司),逆转录试剂盒、荧光染料SYBR试剂盒购自日本TaKaRa公司,Western blot检测试剂盒(上海碧云天生物技术有限公司),Annexin V、碘化物(propidium iodide,PI)购自美国BioVision公司。
1.2 方法
1.2.1 载体构建 通过软件设计合成4组针对靶向基因肝肠钙黏连蛋白(liver-intestine cadherin,CDH17)的pre-siRNA干扰序列,构建带有绿色荧光蛋白(green fluorescent protein,GFP)基因的siCDH17干扰质粒,鉴定正确后转染那可丁耐药性结肠癌细胞,选出干扰效果最好的RNA干扰序列,构建慢病毒表达载体。最终成功完成siCDH17(阳性干扰组)和siNC(非特异性对照组)慢病毒表达载体的构建,慢病毒载体感染细胞感染率高达95%,并且作用时间长。
1.2.2 实时聚合酶链反应(real-time polymerase chain reaction,real-time PCR) 以 人 β-actin作为内参,CDH17正向引物:5’-GGACAGAGAAGC CGGAAGTC-3’;反向引物 5’-GAACAAGCCCGTG TAGTCCTT-3’。根据SYBR Premix Taq试剂盒说明书进行real-time PCR检测,PCR反应条件:95℃预变性5 min,95℃变性1 min,58℃退火30 s,72℃延伸60 s,共40个循环,72℃继续延伸8 min,最后保存于4℃。
1.2.3 Western blot检测 药物作用时间结束后,收集细胞,进行常规细胞裂解提取并测定总蛋白浓度。取40μg蛋白加热变性10 min后进行SDS-PAGE电泳,然后转移到硝酸纤维素膜上。转膜结束后加脱脂奶粉封闭,4℃过夜。使用TBST洗涤3次,分别加入一抗CDH17(ab109190)(1∶1 000)和GAPDH(ab9485)(1∶2 500)抗体,4℃孵育过夜,TBST洗涤,加入辣根过氧化物酶标记的二抗IgG(1∶5 000),25℃孵育1 h,使用电化学发光试剂盒显色,X射线片曝光。每份样品检测重复3次。
1.2.4 肿瘤异种移植模型 将裸鼠随机分成空白组、非特异性对照组、阳性干扰组,每组7只。在裸鼠右侧背部皮下接种人结肠癌细胞悬液,复制裸鼠移植瘤模型,当瘤体积达100~150 mm3时,每3天注射5 mg/kg那可丁,同时每3天观察移植瘤生长情况,进行瘤重和瘤体积的比较。
1.2.5 末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL) 采用TUNEL检测细胞凋亡。将材料用二甲苯浸洗2次,5 min/次,过梯度酒精,磷酸盐缓冲溶液(phosphate buffer saline,PBS)漂洗2次,用细胞通透液处理8 min,PBS漂洗3次,加入蛋白酶K,双蒸水漂洗后用3%过氧化氢封闭,加入dUTP和过氧化氢酶培养后进行观察。当基因组DNA断裂时,在暴露的3’端加入异硫氰酸荧光素,通过荧光显微镜或者流式细胞仪检测细胞凋亡情况。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒载体干扰CDH17的表达
2.1.1 CDH17 mRNA 空白组、非特异性对照组、阳性干扰组的CDH17 mRNA相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经SNK-q检验,非特异性对照组与空白组CDH17 mRNA表达水平比较,差异无统计学意义(P>0.05);阳性干扰组与空白组比较,CDH17 mRNA表达量降低(P<0.05)。见表 1。
2.1.2 CDH17蛋白 空白组、非特异性对照组、阳性干扰组的CDH17蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较经SNK-q检验,阳性干扰组的CDH17蛋白表达受到抑制,较空白组和非特异性干扰组降低(P<0.05);非特异性对照组与空白组比较,差异无统计学意义(P>0.05)。mRNA和蛋白水平结果说明,转染慢病毒表达载体成功干扰CDH17的表达。见表1和图1。
2.2 下调CDH17基因抑制结肠癌细胞增殖
2.2.1 肿瘤体积 空白组、非特异性对照组、阳性干扰组肿瘤异种移植模型在移植后2、4、6、8、12和16 d的肿瘤体积比较,采用重复测量设计的方差分析,结果:①不同时间点动物体内肿瘤体积有差别(F=14.582,P=0.000)。从第6天开始,阳性干扰组与空白组、非特异性对照组肿瘤体积比较,差异有统计学意义(P<0.05),阳性干扰组肿瘤体积大于空白组和非特异性对照组。②3组动物体内肿瘤体积有差别(F=189.081,P=0.000),阳性干扰组较空白组、非特异性对照组动物体内肿瘤体积小(P<0.05),抑瘤效果较好;非特异性对照组与空白组动物体内肿瘤体积比较,差异无统计学意义(P>0.05)。③3组肿瘤体积变化趋势有差异(F=5.731,P=0.018)。见表2和图2。
表1 各组CDH17 mRNA和蛋白的表达水平比较 (n =7,±s)

表1 各组CDH17 mRNA和蛋白的表达水平比较 (n =7,±s)
注:1)与空白组比较,P <0.05;2)与非特异性对照组比较,P <0.05
组别 CDH17 mRNA CDH17蛋白空白组 1.002±0.068 0.861±0.006非特异性对照组 0.910±0.085 0.851±0.008阳性干扰组 0.217±0.0761)2) 0.229±0.0091)2)F值 94.676 4165.432 P值 0.000 0.000

图1 慢病毒载体干扰CDH17蛋白的表达
2.2.2 肿瘤重量 移植后16 d,空白组、非特异性对照组、阳性干扰组动物模型体内肿瘤重量分别为(0.956±0.023)、(0.908±0.026)和(0.321±0.037)g,经单因素方差分析,差异有统计意义(F=304.337,P=0.000),阳性干扰组肿瘤重量低于空白组和非特异性对照组。见图3。
2.3 下调CDH17基因促进细胞凋亡
利用慢病毒表达载体干扰结肠癌细胞,与空白组结肠癌细胞和慢病毒干扰载体结肠癌非特异性对照组相比,TUNEL检测发现阳性干扰组肿瘤异种移植模型体内结肠癌细胞凋亡数明显增多。见图4。
表2 各组不同时间点动物模型体内肿瘤体积比较 (n =7,mm3,±s)

表2 各组不同时间点动物模型体内肿瘤体积比较 (n =7,mm3,±s)
注:1)与空白组比较,P <0.05;2)与非特异性对照组比较,P <0.05
组别 2 d 4 d 6 d 8 d 12 d 16 d空白组 107.712±17.371 206.997±27.176 339.189±32.375 614.772±79.036 923.893±80.393 1382.926±92.188非特异性对照组 106.418±15.147 205.290±26.383 333.373±29.674 593.399±64.778 912.509±60.511 1299.444±74.942阳性干扰组 107.781±14.307 207.926±20.681 238.861±25.7011)2) 256.232±49.5841)2) 288.722±58.9791)2) 303.473±56.5291)2)
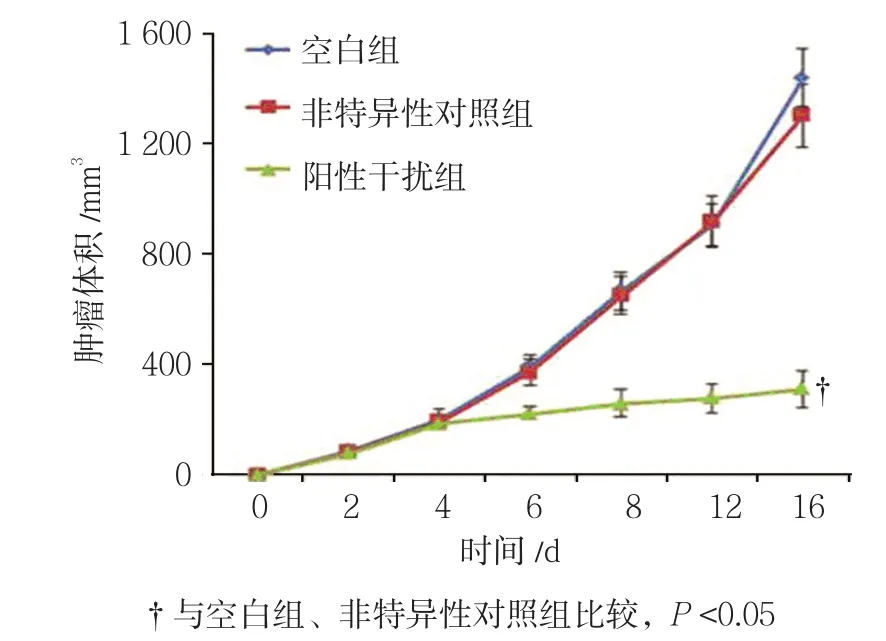
图2 各组动物模型体内肿瘤体积不同时间点变化趋势(±s)
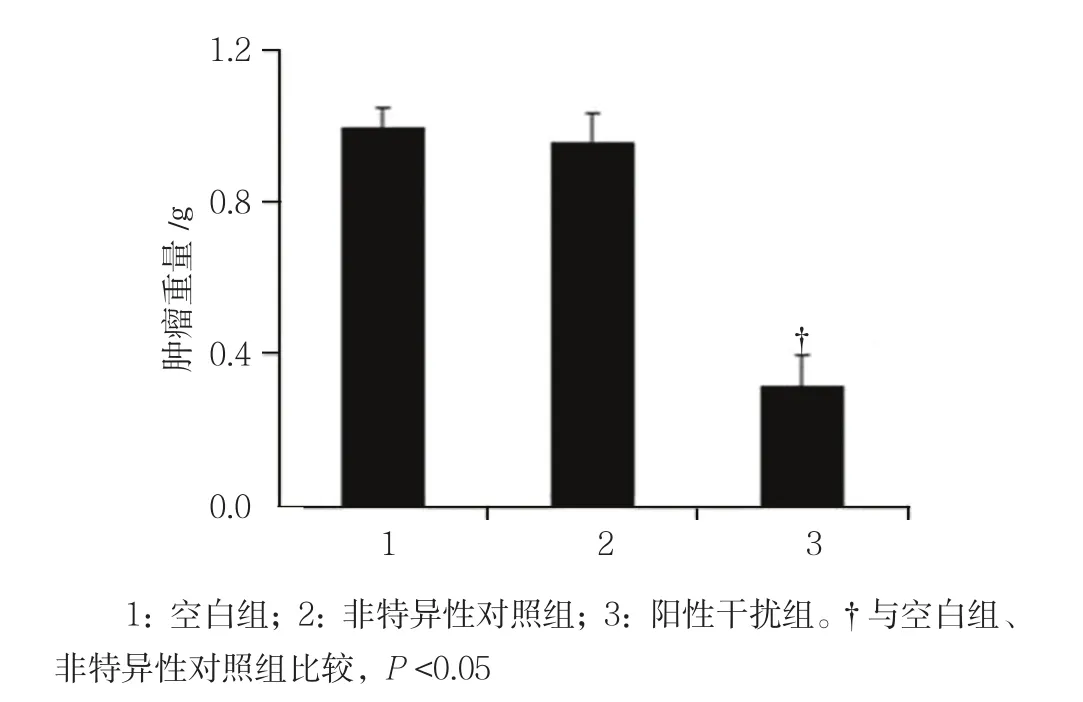
图3 各组动物模型体内肿瘤重量比较 (n =7,±s)

图4 各组细胞凋亡情况 (×200)
3 讨论
近年来结肠癌患者的生存率无明显改善,且发病率呈上升趋势,每年新增900万确诊病例,其中东欧、南美和东亚地区发病率最高[8]。我国结肠癌的发病率较高,其致死率高于其他恶性肿瘤[9]。随着分子生物学的发展,以及人类对疾病与基因关系认识的提高,联合化学治疗的基因治疗得到越来越多的认可。化学基因治疗可以增加肿瘤细胞对化学药物的敏感性,而肿瘤基因治疗即针对肿瘤发生、发展过程中的遗传性背景,明确缺失、突变等缺陷基因的作用,过表达或者下调肿瘤细胞,以及其他体细胞中特定基因已补偿或者纠正错误基因,达到治疗肿瘤的目的。
细胞间的黏附机制在肿瘤侵袭转移过程中起双重作用。一方面肿瘤细胞必须先从其原发病灶黏附部位脱离,故黏附可抑制侵袭;另一方面,肿瘤细胞需要从连续的黏附和去黏附过程中获得牵引力来进行移动。细胞黏附分子与肿瘤的侵袭转移密切相关,起至关重要的作用。CDH17是钙黏连蛋白超家族中结构特殊的一员,是对经典钙黏连蛋白和桥粒钙黏连蛋白功能的补充,CDH17通常在人肠道上皮细胞及部分胰管上皮细胞中表达[10-11]。目前还没有CDH17在正常人结肠癌中表达的报道,而其在胃癌、肝癌中都有表达[12-14],这说明CDH17可能在肿瘤进程中扮演重要角色,与结肠癌的发生密切相关。
近几年国内针对那可丁对肿瘤细胞的影响有所研究,有研究者通过那可丁联合顺铂作用于体外培养人卵巢癌SKOV3细胞,结果显示那可丁可以协同顺铂作用于SKOV3细胞,并提高顺铂对SKOV3细胞的敏感性[15]。在针对卵巢癌的研究过程中发现,那可丁可以通过抑制介导肿瘤生存的关键因子—低氧诱导因子-1,提高卵巢癌细胞对化疗药物的敏感性[16]。已经证实,那可丁作为抗癌新药能通过线粒体途径促进肿瘤细胞的凋亡,但具有耐药性,如何能增强那可丁抗肿瘤的作用,同时降低其耐药性是本实验的主要内容。
本实验从动物模型探讨下调CDH17基因表达对那可丁耐药的结肠癌细胞的抑制作用。实验结果从基因和蛋白水平分别验证siCDH17慢病毒载体的成功构建。小鼠模型是可以进行肿瘤临床和基础研究的主要方法,涉及各个领域。实验结果说明,siCDH17对动物模型体内肿瘤的发生、发展有较好的抑制作用。为研究siCDH17对耐药性结肠癌细胞的影响,采用TUNEL结合Annexin V/PI双染色法检测细胞凋亡情况。TUNEL检测结果显示,阳性干扰组细胞凋亡数量远多于其他两组。有研究发现,CDH17的表达与人胃癌、肝癌、胰腺癌、结肠癌有相关性,CDH17的表达水平在肠型癌症组织中比肝、胃型癌组织要高[10]。
综上所述,本实验结果表明,下调CDH17基因对那可丁耐药的结肠癌细胞具有明显的抑制作用,主要表现在早期细胞的凋亡及后续发展上。本研究在分子水平上探讨CDH17在耐药性肿瘤中的作用,是对临床治疗肿瘤新药物耐药性的研究,也是对前人在肿瘤分子机制方面研究的基础上,在临床药物方面的延伸,为临床治疗耐药性肿瘤提供相关数据及研究方向。
