表达禽网状内皮组织增生病病毒env基因的重组马立克病毒的生物学特性
2018-08-07周忠文林桂芳王好好崔治中孙淑红
周忠文,林桂芳,王好好,苏 帅,崔治中,孙淑红*
(1. 山东农业大学动物医学院,泰安 271018;2. 山东省动物生物工程与疾病防治重点实验室,泰安 271018;3. 山东省畜禽疫病防制工程技术研究中心,泰安 271018)
马立克病(Marek’s disease, MD)以及禽网状内皮组织增生病(reticuloendotheliosis, RE)是危害鸡群重要的肿瘤病,给养禽业造成极大的危害。MD是由马立克病病毒(Marek’s disease virus,MDV)引起以感染鸡肝、肾等内脏器官的肿瘤以及T淋巴细胞的大量增生为主要特征的一种高度传染性疾病,对未经疫苗免疫的鸡群可造成极高的死亡率[1-2]。MD是目前唯一能用疫苗免疫的家禽肿瘤病,疫苗的使用有效预防了MD的暴发。随着疫苗的使用,病毒毒力呈现增强的趋势,由弱毒株、强毒株、超强毒株逐渐演变为特超强毒株[3-4],MD疫苗也由最初的HPRS-16/att、火鸡疱疹病毒(herpesvirus of turkeys, HVT)疫苗发展到由血清Ⅰ型MDV传代致弱毒力的CVI988/Rispens疫苗[5-7]。近年来,国内外鸡群MD频发,CVI988/Rispens疫苗已经不能提供完全的免疫保护[8-10]。Witter等[11]利用细胞传代致弱MDV毒力的方法制备了近10株MD疫苗候选株,其免疫保护效果均没有CVI988/Rispens好。
GX0101是从国内免疫CVI988/Rispens疫苗发生MD肿瘤的鸡群分离的MDV超强毒株[12]。利用细菌人工染色体(bacterial artificial chromosome, BAC)技术,笔者实验室构建了GX0101的感染性克隆bac-GX0101[13-14],基于Red E/T同源重组技术,敲除bac-GX0101的meq基因构建了MDV SC9-1[15]。SC9-1对鸡完全丧失致病性,不再诱发接种鸡产生肿瘤,无论是SPF鸡还是海兰褐鸡SC9-1均能诱导比商品化疫苗CVI988/Rispens更好的免疫保护效果。
RE是由禽网状内皮组织增生病病毒(reticuloendotheliosis virus, REV)引起的禽类病理综合征,表现为从亚临床感染到明显的生长迟缓、免疫抑制和肿瘤等不同的临床和病理变化。研究表明,REV能引起接种鸡早期严重的免疫抑制,可持续性地抑制鸡对灭活疫苗的抗体反应[16]。近年来,大量的研究显示国内鸡群普遍存在REV流行,严重危害养禽业的健康发展,对于REV的免疫防控越来越引起人们的重视[17]。
本研究以前期构建的血清Ⅰ型MDVmeq基因缺失株SC9-1为载体,利用同源重组技术将REVenv基因插入SC9-1的meq基因位点,构建重组MDV,并对重组MDV的生物学特性进行了初步研究,为其他重组MDV的构建提供思路,也为REV的免疫防控奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 大肠杆菌(Escherichiacoli)DH5α和DH10B由本实验室保存。DMEM、Opti-MEM、转染试剂LipfactamineTM2000及真核表达载体pcDNA3.1购自Invitrogen公司。Red/ET重组系统Counter-Selection BAC Modification Kit购自德国Gene Bridge公司。FITC标记的抗鼠IgG二抗购自Sigma公司。plasmid Maxi kit购自QIAGEN公司。MDV 1型毒株pp38基因特异性的单克隆抗体H19、REVenv基因特异性的单克隆抗体11B118均为本实验室保存。
1.1.2 SPF鸡和MDV毒株 9~10日龄SPF鸡胚和SPF鸡均购自济南斯帕法斯家禽有限公司,MDV SC9-1株[15]、MDV rMd5株[18]以及REV SNV株[19]均由本实验室保存。H9禽流感、新城疫二联灭活苗购自青岛易邦生物工程有限公司(批号:161880701)。
1.2 方法
1.2.1 REVenv基因真核表达质粒的构建及鉴定 构建策略见图1。按常规方法提取REV SNV株的感染性克隆DNA作为模板,利用Env-F/R引物扩增env基因(表1),回收的PCR产物与真核表达载体pcDNA3.1 (+) 质粒共同用Hind Ⅲ与XbaⅠ双酶切后进行连接,提取重组质粒进行酶切鉴定,鉴定的阳性克隆命名为pcDNA-env(图1)。使用QIAGEN plasmid Midi kit试剂盒提取并纯化质粒pcDNA-env,按照转染试剂LipfectamineTM2000的说明书将pcDNA-env转染进CEF中。转染后放置在37 ℃,5%CO2培养箱中培养,72 h后,吸出孔中的细胞培养液,倒掉,用预冷的丙酮∶乙醇(体积比3∶2)固定液固定10 min,用PBS清洗1次,加入0.5 mL (1∶100稀释)REV单抗11B118,放置在37 ℃ 生化恒温箱中反应1 h,用PBS清洗3次,将水分甩干,加入0.5 mL FITC标记的抗鼠IgG荧光抗体,放置在37 ℃生化恒温箱反应1 h,用PBS洗3次, 在倒置荧光显微镜下观察。
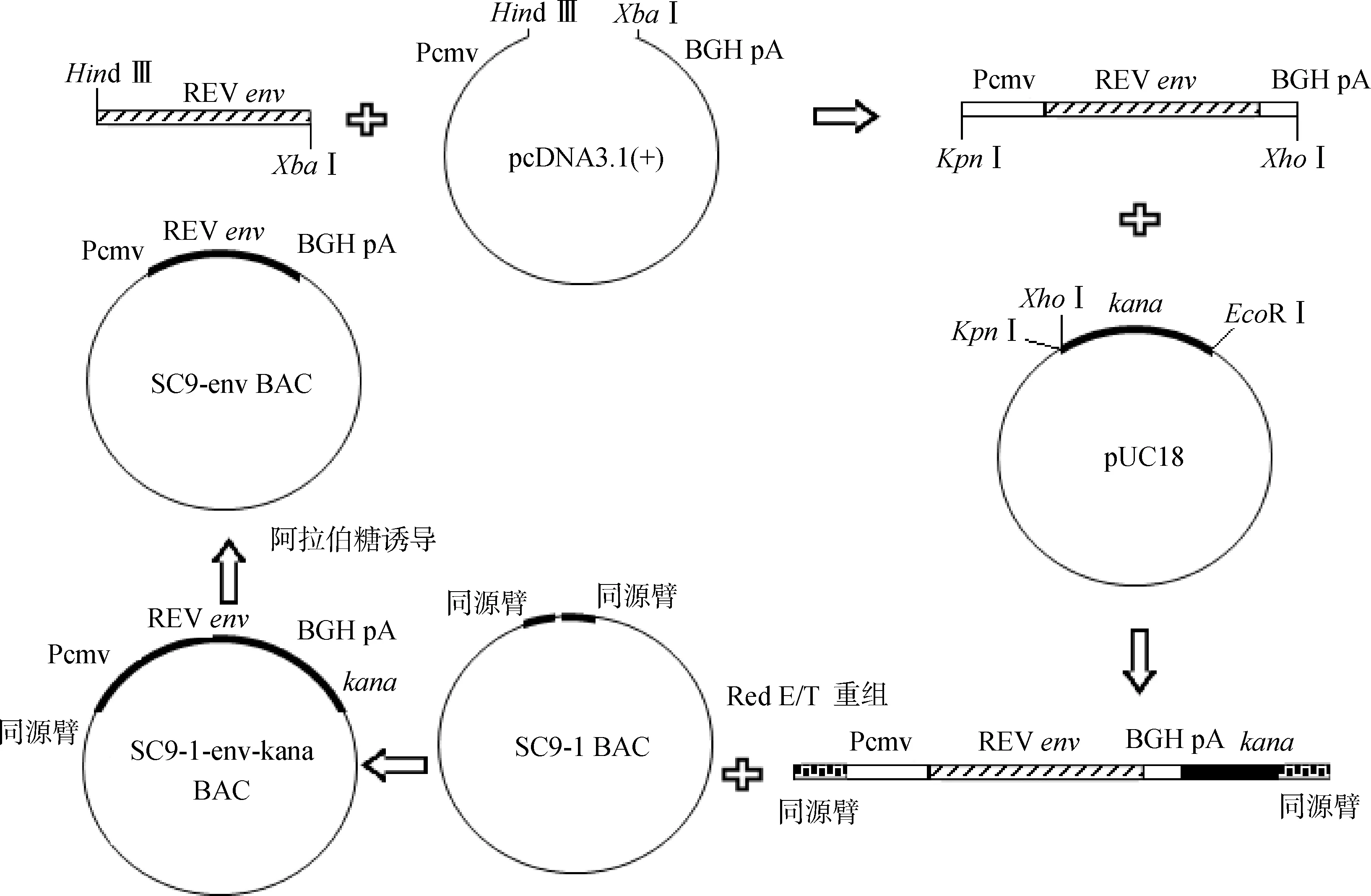
图1 SC9-env BAC构建过程示意图Fig.1 Construction of SC9-env BAC
1.2.2 REVenv基因表达盒以及kana抗性基因克隆进pUC18载体 以质粒pKD13为模板,Kana-F/R引物(表1)经PCR扩增卡那霉素抗性基因(kanamycin resistance gene, kanr),回收PCR产物,经KpnⅠ、EcoRⅠ双酶切后,克隆进pUC18载体,构建pUC18-kana重组质粒。以pcDNA-env质粒为模板,Biao-F/R引物(表1)经PCR扩增REVenv基因的完整真核表达盒,回收PCR产物,经KpnⅠ、XhoⅠ双酶切后,克隆进pUC18-kana载体,构建pUC18-env-kana重组质粒。按照上述方法鉴定pUC18-env-kana重组质粒中REVenv基因在CEF细胞中的真核表达。
表1PCR扩增引物表
Table1PrimersforPCRamplification

引物Primer序列(5'→3') Sequence目的基因Target geneEnv-FEnv-RagcAAGCTTGAAatggactgtctcaccaacgccTCTAGAtcattgacctagggtatccatc扩增长1 782 bp含Hind Ⅲ、XbaⅠ酶切位点的REV env基因Biao-FBiao-RgcgGGTACCGTTGACATTGATTATTGACataCTCGAGCCATAGAGCCCACCGCATC扩增长2 728 bp含KpnⅠ、XhoⅠ酶切位点的REV env基因表达盒Kana-FKana-RattaGGTACCCTCGAGattccggggatccgtcgacaggaGAATTCgtgtaggctggagctgcttc扩增长1 330 bp含KpnⅠ、XhoⅠ、EcoRⅠ酶切位点的kana基因Recombine-FTcagggtctcccgtcacctggaaaccaccagaccgtagactgagtatccgGTTGACATTGATTATTGACTAG扩增长4 120 bp含meq基因两侧同源臂的env基因表达盒以及kana基因Recombine-RatgtctcaggagccagagccgggcgctatgccctacagtcccgctgacgaGTGTAGGCTGGAGCTGCTTCJC-FJC-RTAATGCCTTTAACCCTTTCAGTCAAACCGCTATCCAC扩增长605 bp嵌合基因(部分SC9-1基因以及部分env基因表达盒)
1.2.3 将REVenv基因表达盒以及kana抗性基因插入MDV SC9-1基因组meq基因位点 以pUC18-env-kana重组质粒为模板,Recombine-F/R引物(表1)经PCR扩增包含meq基因插入位点前后50 bp序列同源臂的REVenv基因表达盒以及kana抗性基因,利用同源重组技术插入MDV SC9-1基因组meq基因位点[20]。PCR产物用DpnⅠ酶消化1 h,在2 000 V/100 Ω/25 μF的条件下,利用电转化仪将PCR产物转化进已含有SC9-1-BAC的大肠杆菌EL250中,转化后的菌涂于含有卡那霉素抗性的LB平板中。16 h后挑取单菌落利用JC-F/R引物经PCR鉴定REVenv基因表达盒以及kana抗性基因是否插入MDV SC9-1基因组meq基因位点。鉴定阳性菌落,用0.1%的阿拉伯糖诱导表达flp重组酶,通过位点特异性重组将kanr去除,命名为SC9-env BAC(图1)。
1.2.4 SC9-env 重组病毒的拯救以及在CEF细胞上的增殖 利用QIAGEN plasmid Midi kit试剂盒提取并纯化质粒SC9-env BAC。以LipfectamineTM2000进行转染,转染后4~6 d,待出现病毒蚀斑后,分别以MDV单抗H19以及REV 单抗11B118进行间接免疫荧光鉴定。收获阳性重组病毒,用0.25%胰酶消化含有重组病毒的细胞,用冻存液重悬细胞后将其冻存于液氮中,重组病毒命名为SC9-env。为了比较SC9-1与SC9-env在CEF细胞上的复制能力,将SC9-1与SC9-env按100 PFU·孔-1的剂量分别接种长满单层CEF细胞的6孔板中,放置在含有5%CO2、37 ℃的细胞培养箱内培养。分别在接种后0、24、48、72、96、120、144 h计算MDV蚀斑数。绘制MDV的生长曲线,比较SC9-1与SC9-env在CEF细胞上复制水平的差异。
1.2.5 重组病毒SC9-env 对SPF鸡的致病性 将75只1日龄SPF鸡随机分为3组(每组25只),分别饲养在正压过滤空气的消毒隔离罩内,饲料、饮用水均经过高压灭菌后分别饲喂。第1、2组鸡分别以2 000 PFU·只-1的剂量腹腔接种SC9-env、SC9-1,第3组鸡作为空白对照组。分别在接种MDV后7、14、21、28 d称量各组鸡的体重,评价SC9-1、SC9-env对SPF鸡生长性能的影响。接种后每天观察各组鸡的临床症状并记录鸡的死亡数。试验期间,对各组死亡鸡进行剖检,并取有病变的脏器做石蜡切片,HE染色后进行病理组织学观察,判定是否由MDV引起的死亡。在接种MDV 90 d后,所有存活鸡均采用CO2安乐死并剖检,观察记录鸡的病变。
1.2.6 重组病毒SC9-env对SPF鸡的免疫保护 为了比较SC9-env 对SPF鸡感染vv MDV rMd5 的免疫保护效果。将100只1日龄SPF 鸡,随机分为4组(每组25只),第1、2组鸡分别以2 000 PFU·只-1的剂量腹腔接种SC9-env、SC9-1,第3、4组分别作为攻毒对照组、空白对照组。免疫5 d后,第1、2、3组分别以1 000 PFU·只-1的剂量腹腔接种vv MDV rMd5。攻毒后每天观察各组鸡的临床症状并记录鸡的死亡数。饲养90 d后,所有存活鸡均采用CO2安乐死并剖检观察其病变。选取病变的组织、脏器,并且每组随机选取3只分别取其心、肾、肝做石蜡切片,HE染色,进行病理组织学观察。疫苗免疫保护效力由保护指数(protective index, PI)来评价,免疫组PI计算方法:
为了比较SC9-env对SPF鸡感染REV SNV 的免疫保护效果。将100只1日龄SPF 鸡,按照上述试验方式进行分组、免疫。免疫14 d后,第1、2、3组分别以2 000 TCID50·只-1的剂量腹腔接种REV SNV。SNV接种后14 d,各组鸡均免疫NDV、AIV H9灭活苗。分别在接种SNV后7、14、21、28 d称量各组鸡的体重,攻毒后每天观察各组鸡的临床症状并记录鸡的死亡数。饲养70 d后,所有存活鸡均采用CO2安乐死并剖检观察其病变。
2 结 果
2.1 REV env基因的真核表达重组质粒的鉴定
利用PCR扩增长1 782 bp的REVenv基因,克隆进pcDNA3.1 (+)载体,构建的重组质粒pcDNA-env转染CEF细胞,以REV单抗11B118进行IFA鉴定,发出亮绿色荧光。将pcDNA-env的env基因表达盒与卡那霉素抗性基因串联克隆进pUC18载体,构建重组质粒pUC18-env-kana。将pUC18-env-kana质粒转染CEF细胞,以REV单抗11B118进行IFA鉴定,发出亮绿色荧光(图2A,黑白图中未能体现,下同);pUC18-kana质粒转染CEF细胞以及空白CEF细胞以REV单抗11B118进行IFA鉴定,均没有发出亮绿色荧光(图2B、C);证实pUC18-env-kana质粒在CEF细胞能够表达REVenv基因。
2.2 重组MDV SC9-env的拯救及鉴定
利用同源重组技术将REVenv基因表达盒插入SC9-1基因组的meq基因位点,构建了 SC9-env BAC,转染CEF细胞7 d后出现典型的MDV蚀斑(图3A),以MDV单抗H19、REV单抗11B118进行IFA鉴定,蚀斑均能发出亮绿色荧光(图3C、D),重组MDV命名为SC9-env;而SC9-1蚀斑仅能与MDV单抗H19发生反应,发出亮绿色荧光(图3E、F);空白CEF细胞没有亮绿色荧光(图3G、H)。结果表明,SC9-env能够表达REV env蛋白。
2.3 重组MDV SC9-env在CEF细胞的复制水平
将SC9-env与SC9-1分别感染CEF细胞进行病毒复制动态测定,结果显示:在病毒感染后的24、48、72、96、120、144 h,SC9-env可在CEF细胞良好的复制,与SC9-1相比,SC9-env在CEF细胞的复制减慢,但是差异不显著(图4)。
2.4 重组MDV SC9-env对SPF鸡的致病性
SC9-env接种组鸡个体大小均一,生长良好,没有MD特有的临床症状,体重与SC9-1组以及空白对照组鸡相比差异不显著(表2)。整个试验期间,SC9-env接种组鸡没有出现鸡只死亡,存活率100%,剖检所有鸡,均没有发现MDV引起的肿瘤。SC9-1组与空白对照组鸡同样没有出现鸡死亡以及MDV诱发的肿瘤(表3)。结果表明,SC9-env对SPF鸡没有明显的致病性以及致肿瘤性,对接种鸡的体重没有显著影响。

A. MDV SC9-env形成的蚀斑;B. 空白CEF细胞;C. SC9-env蚀斑H19单抗IFA鉴定;D. SC9-env蚀斑11B118单抗IFA鉴定;E. SC9-1蚀斑H19单抗IFA鉴定;F. SC9-1蚀斑11B118单抗IFA鉴定;G. 空白CEF细胞H19单抗IFA鉴定;H.空白CEF细胞11B118单抗IFA鉴定A. Plaque formed by MDV SC9-env; B. Blank CEF cells; C. IFA analysis of SC9-env plaque by H19 monoclonal antibody; D. IFA analysis of SC9-env plaque by 11B118 monoclonal antibody; E. IFA analysis of SC9-1 plaque by H19 monoclonal antibody; F. IFA analysis of SC9-1 plaque by 11B118 monoclonal antibody; G. IFA analysis of blank CEF cells by H19 monoclonal antibody; H. IFA analysis of blank CEF cells by 11B118 monoclonal antibody图3 重组MDV SC9-env的拯救及IFA鉴定(100×)Fig.3 Rescue and IFA identification of recombinant MDV SC9-env (100×)
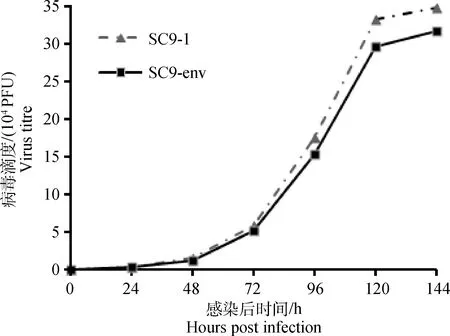
图4 SC9-env在CEF细胞上的复制曲线Fig.4 Replication kinetics of SC9-env in CEF cells
2.5 重组病毒SC9-env 对SPF鸡的免疫保护
SC9-env 对SPF鸡感染vv MDV rMd5的免疫保护效果。与空白对照组相比,rMd5攻毒对照组鸡群个体明显偏小,大小不均,鸡出现明显的瘫痪症状,攻毒后2周鸡陆续出现死亡(图5)。SC9-env免疫攻毒组、SC9-1免疫攻毒组鸡长势正常,没有出现MD临床症状。试验期间,SC9-env免疫攻毒组有2只鸡死亡,SC9-1免疫攻毒组有1只鸡死亡,剖检,均没有发现肉眼可见的肿瘤结节,心、肝组织病理切片可见少量淋巴细胞浸润(图6A、B、E、F);rMd5攻毒对照组有23只鸡死亡,其中6只鸡出现肉眼可见的肿瘤结节,心、肝组织病理切片可见肿瘤淋巴细胞浸润,心肌细胞被肿瘤细胞取代(图6C、G)。rMd5攻毒后90 d剖检所有存活鸡,空白对照组、SC9-env免疫攻毒组以及SC9-1免疫攻毒组鸡正常,没有出现肉眼可见的肿瘤结节;rMd5攻毒对照组有1只鸡肝出现明显的肿瘤结节。基于攻毒对照组vv MDV rMd5引起感染鸡的病变率,SC9-env对SPF鸡能够提供92%的免疫保护,SC9-1对SPF鸡能够提供96%的免疫保护(表3,图5)。


毒株Strain7日龄7 days of age14日龄14 days of age21日龄21 days of age28日龄28 days of ageSC9-env66.4±6.2a112.5±14.2a187.3±19.1a278.6±28.5aSC9-167.2±5.5a114.0±12.2a185.2±17.8a273.5±32.0aControl68.8±4.4a118.0±10.7a192.6±15.4a285.8±28.2a
同一字母表示数据差异不显著(P>0.05)
The same letters indicate the differences of the data were not significant (P>0.05)
表3SC9-env对SPF鸡的致病性及免疫保护效果
Table3PathogenicityandimmuneprotectiveefficacyofSC9-envonSPFchickens

毒株Virus攻毒Challenged死亡率/%Mortality病变率/%Lesion rate免疫保护指数/% PIαSC9-envrMd58(2/25)8(2/25)92SC9-1rMd54(1/25)4(1/25)96—rMd592(23/25)100(25/25)———0(0/25)0(0/25)—SC9-env—0(0/25)0(0/25)—SC9-1—0(0/25)0(0/25)—
α表示两组间免疫保护指数(PI)无显著差异(P>0.05)
PI=protection index.α.Indicates no significant difference (P>0.05) in PI among the two experimental groups
SC9-env对SPF鸡感染REV SNV的免疫保护效果。整个试验周期,各组鸡均没有出现死亡,剖检均没有发现肉眼所见的肿瘤结节。与空白对照组相比,除SC9-env+SNV组攻毒后7 d外,各SNV攻毒组体重均显著降低(P<0.05)(表4)。SC9-env免疫攻毒组鸡的体重在7、14、21、28 d 均显著高于SNV攻毒组以及SC9-1免疫攻毒组(P<0.05)。SC9-env免疫攻毒组鸡的NDV、AIV H9抗体水平均显著高于SNV攻毒组以及SC9-1免疫攻毒组(P<0.05)(图7)。

图5 疫苗免疫后接种MDV rMd5各组鸡的生存曲线Fig.5 Survival curves of chickens challenged with MDV rMd5 after immunization
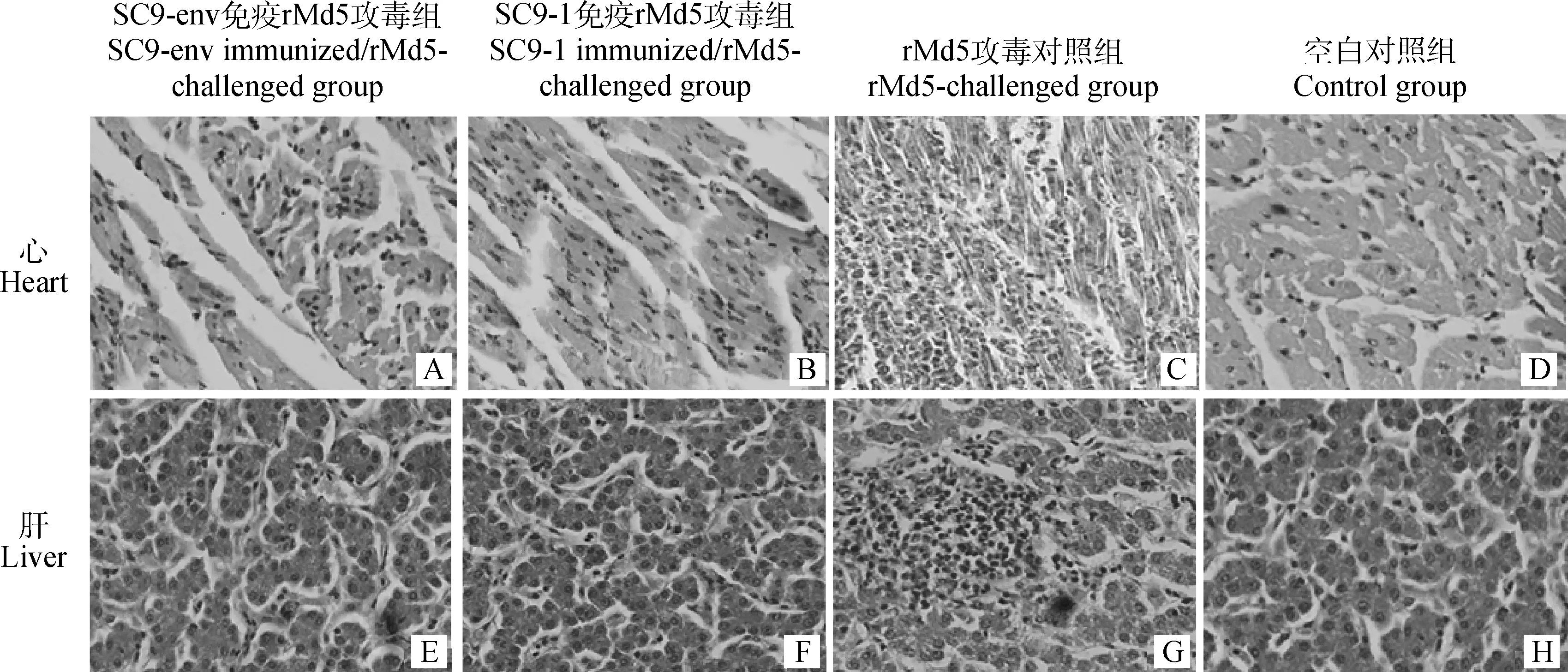
图6 心、肝病理组织切片图(HE,205×)Fig.6 Pathologic section of heart and liver (HE,205×)


毒株Virus攻毒后7 d7 dpi攻毒后14 d14 dpi攻毒后21 d21 dpi攻毒后28 d28 dpiSC9-env+SNV271.1±29.1a353.8±62.5b487.2±76.0b543.6±53.1bSC9-1+SNV254.6±26.1b297.1±60.3c407.7±68.9c511.9±73.7cSNV251.0±20.3b305.4±47.2c420.4±54.5c504.3±69.1cControl282.3±34.5a383.2±44.9a536.9±59.6a613.9±72.2a
同一字母表示数据差异不显著(P>0.05);不同字母表示数据差异显著(P<0.05)
The same letters indicate the differences of the data were not significant (P>0.05), the different letters indicate the differences of the data were significant (P<0.05)

同一字母表示数据差异不显著(P>0.05);不同字母表示数据差异显著(P<0.05)The same letters indicate the differences of the data were not significant (P>0.05), the different letters indicate the differences of the data were significant (P<0.05)图7 接种REV SNV各组鸡AIV H9、NDV抗体水平Fig.7 The antibody levels induced by AIV H9 and NDV inactivated vaccines in chickens challenged with REV SNV
3 讨 论
MDV分为Ⅰ、Ⅱ、Ⅲ三个血清型,其中血清Ⅰ型为致病型,近年来MDV毒力不断增强[21]。Lee等[22-23]利用黏粒系统构建了MDV Md5的meq基因缺失株rMd5Δmeq,比MD商品疫苗CVI988/Rispens具有更好的免疫保护效果。本实验室利用BAC技术构建的MDVmeq基因缺失株SC9-1,不但对鸡群的免疫保护效果优于CVI988/Rispens,而且具有良好的生物安全性。MDV载体疫苗具有抗母源抗体干扰、免疫持续期长等优点,一直是人们研究的热点。以血清Ⅲ型MD疫苗HVT作为载体,构建的重组MDV能够稳定地表达NDV、AIV、IBDV等外源病毒基因,并且对鸡群ND、AI、IBD以及MD具有一定的免疫保护[24-26]。随着MDV超强毒株、特超强毒株的出现,HVT疫苗对鸡群MD已经不能提供理想的免疫保护。以血清Ⅰ型MDV CVI988/Rispens、814株构建的重组MDV对鸡群ND、IB、IBD以及MD均具有良好的免疫保护[27-29]。
前期的研究已经证实我国鸡群普遍存在REV的感染,虽然REV感染鸡群的致死率较低,但是REV引起的免疫抑制较强,尤其可显著抑制对NDV、AIV灭活疫苗免疫后的抗体反应,继发的细菌感染更是增加了对养禽业的危害[17]。迄今为止,国内外尚没有用于预防REV感染的疫苗,研究发现构建的REVgp90基因真核表达质粒及其蛋白对于预防鸡群REV的感染均具有良好的免疫效果[30-31]。基于本实验室构建的免疫效果比CVI988/Rispens更好的MD疫苗候选株SC9-1,利用Red E/T同源重组技术将REVenv基因表达盒插入SC9-1基因组的meq基因位点,构建了重组MDV SC9-env。利用REV单抗11B118作为一抗经IFA鉴定,SC9-env在CEF细胞稳定的表达REV的env蛋白,表明SC9-1的meq位点能够插入外源基因并且稳定表达。病毒在CEF细胞的增殖试验显示SC9-env与SC9-1在细胞上的复制水平相似,表明REVenv基因的插入没有显著影响重组MDV的复制。1日龄SPF鸡接种SC9-env,鸡群没有死亡以及肿瘤的发生,体重与空白对照组相比差异不显著,表明SC9-env对SPF鸡没有明显的致病性。动物免疫保护试验结果表明SC9-1对感染MDV rMd5的SPF鸡提供96%的免疫保护;SC9-env提供92%的免疫保护,差异不显著,证实SC9-env对于MDV rMd5能够提供良好的免疫保护。本实验室前期研究表明SC9-1对于MDV rMd5提供92%~100%的免疫保护,而CVI988/Rispens提供60%~70%的免疫保护。虽然试验不是同时进行,但是SC9-1的免疫效果相似,因此可以推测SC9-env能够提供比CVI988/Rispens更好的免疫效果,然而这一推测尚需要试验验证。相比空白对照组鸡,感染REV SNV的SPF鸡呈现较强的免疫抑制,鸡的体重以及免疫AIV、NDV灭活苗诱导的抗体水平均显著下降,而SC9-env免疫组鸡的体重以及免疫AIV、NDV灭活苗诱导的抗体水平均显著高于SNV攻毒组,证实SC9-env能够降低SNV感染SPF鸡引起的体重减轻以及灭活苗抗体水平的下降。
总之,MDV疫苗候选株SC9-1作为病毒载体能够稳定表达外源基因,构建的重组MDV SC9-env对SPF鸡没有明显的致病性,对SPF鸡感染MDV、REV均具有良好的免疫保护效果。然而,SC9-env作为免疫防控REV感染的重组MDV载体疫苗,其生物安全性尤其是转基因生物安全评价尚需进一步全面系统研究。SC9-env作为疫苗候选株不同免疫方式、不同免疫剂量以及对不同靶动物(海兰褐、海兰白等品系鸡)的免疫效力,同样需要大规模的田间试验进行比较分析。
4 结 论
利用同源重组技术构建的表达禽网状内皮组织增生病病毒env基因的重组马立克病毒 SC9-env能够稳定复制,对感染马立克病毒、禽网状内皮组织增生病病毒的SPF鸡具有良好的免疫保护效果,为鸡群马立克病、禽网状内皮组织增生病的免疫防控奠定基础。
