牦牛Smad 4基因3′UTR区双荧光素酶载体构建及与bta-miR-146a的靶向验证
2018-08-07牛家强王玉恒索朗斯珠强巴央宗徐业芬程玲华杨士承
牛家强,王玉恒,索朗斯珠,强巴央宗,徐业芬*,郭 敏,程玲华,杨士承
(1.西藏农牧学院动物科学学院,林芝 860000; 2.西藏农牧学院西藏高原动物疫病研究自治区高校重点实验室,林芝 860000; 3.中国农业大学动物科技学院,北京 100193)
微小RNA(microRNA, miRNA)是一类内源性非蛋白质编码的RNA分子,约含有18~24个核苷酸,其一般通过作用于靶基因的3′UTR引起靶基因降解或者翻译受阻,从而调控基因表达[1-2]。1993年Lee等[3]在秀丽隐杆线虫中首次发现微小RNA-Lin-4,它能通过与其3′UTR结合,调控线虫细胞的发育。从此越来越多的学者展开对miRNA的相关研究。迄今为止,已通过克隆和测序技术分析出人[4]、小鼠[5-6]、猪[7]、牛[8]、羊[9]等多个物种的卵巢组织miRNA的表达谱,而且对颗粒细胞[10]、卵母细胞[11]、卵泡液[12]和黄体[13]等特定卵巢组织的miRNA的研究也有重大发现。Otsuka等[14-16]在小鼠卵巢中敲除miRNA生成过程的关键酶Dicerl(dicerl hypomorphic)后,导致雌鼠不育;Medeiros等[17]研究发现,miR-290-295缺陷会引起原始生殖细胞的丢失,从而导致雌性小鼠不育;Yin等[18]研究发现,miR-383通过靶定RNA结合基序单链结合蛋白1(RNA binding motif,single stranded interacting protein 1,RBMS 1)基因能促进小鼠颗粒细胞增殖和激素分泌;Pangas等[19-20]研究发现,miR-224通过调控Smad4基因表达,从而促进小鼠颗粒细胞增殖和芳香酶表达;Yan等[21]研究发现,miR-145通过靶定细胞周期素D2(cyclinB 1,Ccnd 2)基因抑制小鼠颗粒细胞的增殖;Lin等[22]在猪卵巢卵泡中发现,miR-26b通过靶向DNA损伤相关基因的铵转运蛋白(ammonium transporter,AMT)基因,从而调控颗粒细胞凋亡;Ma和Xu 等[13, 23]在猪和牛颗粒细胞中均发现miR-378直接靶向芳香酶,从而调控雌二醇的分泌,这些研究进一步表明,miRNA在动物卵巢卵泡中发挥着不可替代的作用[24-26]。前期的研究发现,bta-miR-146a在牦牛心、肝、脾、肺、肾、淋巴结、卵巢等组织中均有表达,其中在卵巢组织中的表达量较高[27]。然而关于bta-miR-146a靶基因的研究鲜见报道。
因此,本试验通过生物信息学软件分析bta-miR-146a的靶基因并从中选取卵巢卵泡发育相关的靶基因进行靶基因验证,为bta-miR-146a在牦牛卵巢卵泡发育中可能发挥的功能机制提供理论基础。
1 材料与方法
1.1 主要的试剂与仪器
293T细胞株(广州吉妮欧生物科技有限公司);限制性内切酶(Thermo Fisher);无内毒素质粒提取试剂盒(D6915,Omega);连接酶(EL0011,Thermo Fisher);PCR 产物回收试剂盒(D6492,Omega);KOD酶(KOD-FX,Toyobo);DMEM(11965-092,Gibico);Fetal Bovine Serum(10099-141,Gibico);Trypsin-EDTA (25300-062,Gibico);Lipofectamine 2000 Reagent(11668-019,Thermo Fisher);Dual-Luciferase Reporter Assay System(E1910,Promega)。
荧光倒置显微镜(1X71,OLYMPUS);离心机(3K15,Sigma);电泳槽(JK-SPFT,北京君意东方电泳设备有限公司);电泳仪(JY300C,北京君意东方电泳设备有限公司);二氧化碳培养箱(NCO15AC,Sanyo);凝胶成像系统(JY04S-3C, 北京君意东方电泳设备有限公司);其他试剂均为国产分析纯。
1.2 生物信息软件预测及保守性分析
1.2.1 miR-146a 在不同物种中的保守性分析 在miRBase数据库(http://www.mirbase.org)中查询并下载牛(Bostaurus)、人(Homosaspiens)、小鼠(Musmusculus)、大鼠(Rattusnorvegicus)、黑猩猩(Gorillagorilla)、猕猴(Macacamulatta)、狗(dog)、鸡(chicken)等8个物种的miR-146a成熟序列,再运用MEGA6.0软件分析其保守性。
1.2.2 miR-146a靶基因预测 由于牦牛miRNA尚无合适的数据库,因此选择在牛miRNA数据库中进行靶基因预测。利用生物信息学软件TargetScan(http://www.targetscan.org)在线预测,以miR-146a 为miRNA,预测其靶基因,再从中挑选可能与哺乳动物卵巢卵泡生长发育相关的靶基因为研究对象。
1.3 牦牛Smad 4基因3′UTR野生型载体构建
1.3.1 引物设计和PCR扩增 根据GenBank ID: ENST00000398417.2确定的牛Smad4基因3′UTR区,再利用BLAST对基因序列及载体序列比对分析后,发现XhoI与NotI两个限制性内切酶可以将目的片段克隆到载体中,因此选择psiCHECK2载体(图1)。设计合成特异引物(F:5′-CCGCTCGAGGGTCTTTTAACTTAACGTTG-3′;R:5′-ATAAGAATGCGGCCGCCGG TAAGATATTAGATGGAG -3′),其中导入了XhoⅠ与NotⅠ内切酶酶切位点(引物斜体下划线部分),用于PCR扩增牦牛Smad4基因的 3′UTR,预期扩增目的片段总长度为1 123 bp。
以牦牛卵巢组织基因组DNA为模板,进行PCR扩增,反应体系为50 μL:2× KOD-FX Buffer 25 μL,dNTP 10 μL,上下游引物(10 μmol·L-1)各1.5 μL,KOD-FX DNA聚合酶 1 μL,DNA模板2 μL,ddH2O 9 μL。反应条件:95 ℃ 预变性5 min;95 ℃ 变性20 s,60 ℃ 退火 10 s,72 ℃延伸30 s,进行40个循环;72 ℃ 延伸7 min;4 ℃保存。PCR产物进行1%琼脂糖电泳检测确定特异性产物。
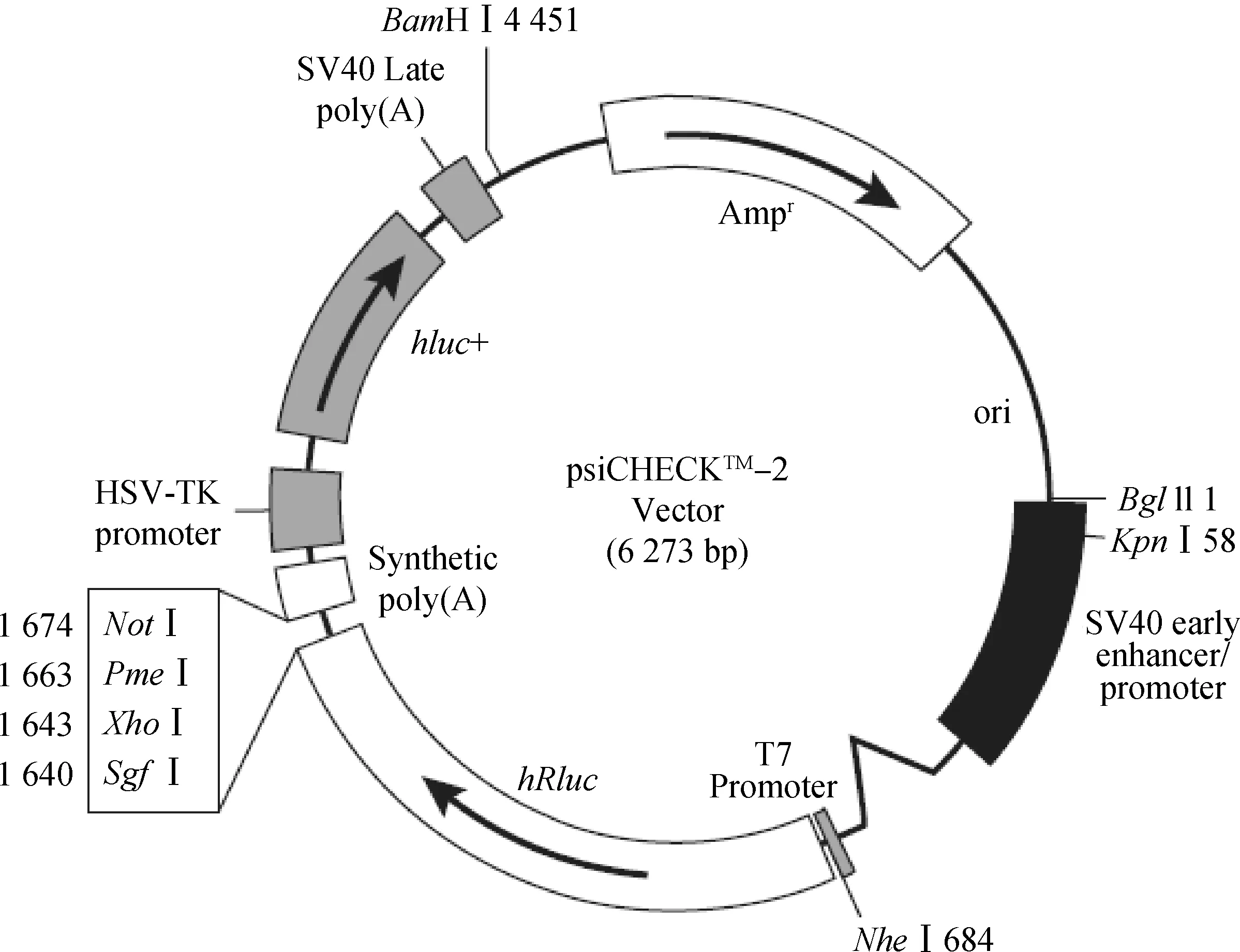
图1 载体图谱Fig.1 Vector map
1.3.2 扩增产物回收 按照Omega回收试剂盒说明书操作:200 μL PCR反应体积加入800 μL Buffer CP到1.5 mL离心管,剧烈震荡,短暂离心;将上述混合物转入吸附柱,13 000 r·min-1离心1 min,弃滤液;加入700 μL洗脱液,13 000 r·min-1离心1 min,弃滤液;加入500 μL洗脱液,13 000 r·min-1离心1 min,弃滤液;13 000 r·min-1离心2 min,甩去吸附柱上的残留液体;把吸附柱转移到一个新的1.5 mL离心管,在吸附柱中加入30 μL ddH2O,室温放置1 min;13 000 r·min-1离心2 min,剩余滤液即是回收的DNA。
1.3.3 酶切和产物纯化 用XhoⅠ与NotⅠ双酶切Smad4启动子基因的PCR产物和载体,酶切反应体系:10×FastDigest Green Buffer 2 μL,vector 10 μL,内切酶各1 μL,ddH2O补足到20 μL。反应条件:37 ℃ 4 h。酶切后按照上述1.3.2方法回收并纯化酶切产物。
1.3.4 连接、转化和菌落鉴定 取纯化酶切产物进行连接反应,反应总体系为20 μL:10×Reaction Buffer 2 μL,Target 10 μL,Vector 5 μL,T4 DNA Ligase 1 μL,ddH2O补足到20 μL。反应条件:16 ℃ 30 min。将连接产物加到100 μL Top10感受态细胞中混匀,冰浴30 min后置于42 ℃水浴90 s,取出后立即于冰浴中放置2 min, 加入800 μL 37 ℃ 预热的LB液体培养基(不含抗生素),37 ℃振荡培养45 min复苏;8 000 r·min-1离心1 min,弃上清液,将100 μL混匀菌液加到含抗生素LB固体琼脂培养基上,倒置于37 ℃培养箱中,培养12~16 h长出菌落。
挑取上述平板上的单菌落,溶到3 μL水中,取0.5 μL做模板,按照上述步骤进行PCR扩增。试验共挑取8个菌落,用载体上游和下游引物进行PCR反应,再用1%琼脂糖电泳检测扩增产物,然后将阳性克隆产物送北京信诺金达生物科技有限公司进行测序鉴定。
1.4 牦牛Smad 4基因3′-UTR突变型载体构建
利用突变PCR的方法, 将牦牛Smad4基因3′UTR 靶序列AGTTCTC突变为CTGGAGA。突变引物F:5′-TGGTTAATAGTACATACTGTGAGAGCAAATGAA-3′;R:5′-CTCACAGTATGTACTATTAACCAGCTGCACAAC-3′。Smad4基因3′UTR 双荧光素酶报告基因突变型载体(以下简称“Smad4-3′UTR-MT载体”)构建的基本过程: 以上述野生型载体(以下简称“Smad4-3′UTR-WT载体”)为模板, 分别扩增含突变序列的两段序列,并进行拼接, 之后进行酶切、连接和转化,最后突变载体同样进行测序分析和扩增。
1.5 细胞培养与转染
复苏293T细胞,用细胞培养液(DMEM+10% FBS)培养于37 ℃、5%CO2、95%相对湿度的培养箱中,经2~3次传代,细胞生长状态较好并呈对数生长期时,开始准备转染。在96孔板中,每孔接种1×104个细胞,每孔加100 μL细胞培养液,放入37 ℃、5% CO2、95%相对湿度的培养箱中培养24 h。然后按照Lipofectamine 2000 转染试剂说明书进行转染:10 μL OPTI-MEM培养基稀释mimic或mimic NC,15 μL OPTI-MEM培养基稀释载体,25 μL OPTI-MEM培养基稀释lipo2000转染试剂,室温放置5 min。将三者轻轻吹打混合,静置20 min 后,加入至细胞内。转染6 h后更换为新鲜细
胞培养液。bta-miR-146a mimics/NC均由广州市锐博生物科技有限公司合成。mimics转染浓度为20 μmol·L-1,质粒浓度为100 ng。总共设4个试验组,分别为Smad4-3′UTR-WT与mimic共转染组、Smad4-3′UTR-WT与mimic NC共转染组、Smad4-3′UTR-MT与mimic共转染组、Smad4-3′UTR-MT与mimic NC共转染组,每组4个重复。
1.6 荧光素酶活性测定
转染48 h后,各组细胞间用细胞裂解液裂解细胞,取5 μL 细胞裂解液与萤火虫荧光素酶缓冲液及底物5 μL,混合测定荧光强度,然后加入海肾荧光素酶反应缓冲液及腔肠素底物5 μL,混匀再次测定海肾荧光素酶活性。每个样品处理一致,比较海肾荧光素酶活性。
1.7 统计学方法
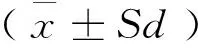
2 结 果
2.1 bta-miR-146a保守性分析
利用miRBase数据库(http://www.mirbase.org)中下载的牛(Bostaurus)、人(Homosaspiens)、小鼠(Musmusculus)、大鼠(Rattusnorvegicus)、黑猩猩(Gorillagorilla)、猕猴(Macacamulatta)、狗(dog)、鸡(chicken)8个物种的miR-146a成熟序列,再运用MEGA6.0软件分析其保守性(表1),结果发现,miR-146a的成熟序列在8个物种均为22个碱基,碱基基本一致,进一步表明miR-146a成熟序列在脊椎动物中具有高度的保守性。
2.2 bta-miR-146a 靶基因预测
采用TargetScan软件,以牛数据库为基础,搜索miR-146a的靶基因,结果发现,bta-miR-146a存在248个潜在靶基因,其中有178个潜在靶基因在卵巢组织中表达(表2),进一步分析发现,Smad4基因也是bta-miR-146a的一个潜在靶基因。前期研究发现,牦牛Smad4基因是一个表达谱很广的基因,尤其在卵巢、输卵管、子宫等组织中均有mRNA表达,而且牛Smad4基因3′UTR与bta-miR-146a在397~404 bp位置存在互补结合(图2),因此预测牦牛Smad4基因可能是bta-miR-146a的靶基因之一。
表1miR-146a在不同物种中的成熟序列比对分析
Table1ThealignmentofmaturemiR-146asequencesfrom8sepcies

物种 Species序列 Sequence牛 Bos taurusUGAGAACUGAAUUCCAUAGGUU人 Homo saspiensUGAGAACUGAAUUCCAUGGGUU小鼠 Mus musculusUGAGAACUGAAUUCCAUGGGUU大鼠 Rattus norvegicusUGAGAACUGAAUUCCAUGGGUU猕猴 Macaca mulattaUGAGAACUGAAUUCCAUGGGUU大猩猩 Gorilla gorillaUGAGAACUGAAUUCCAUGGGUU狗 DogUGAGAACUGAAUUCCAUGGGUU鸡 ChickenUGAGAACUGAAUUCCAUGGGUU
表2miR-146a靶基因相关信息
Table2Relatedinformationsofbta-miR-146atargetgenes
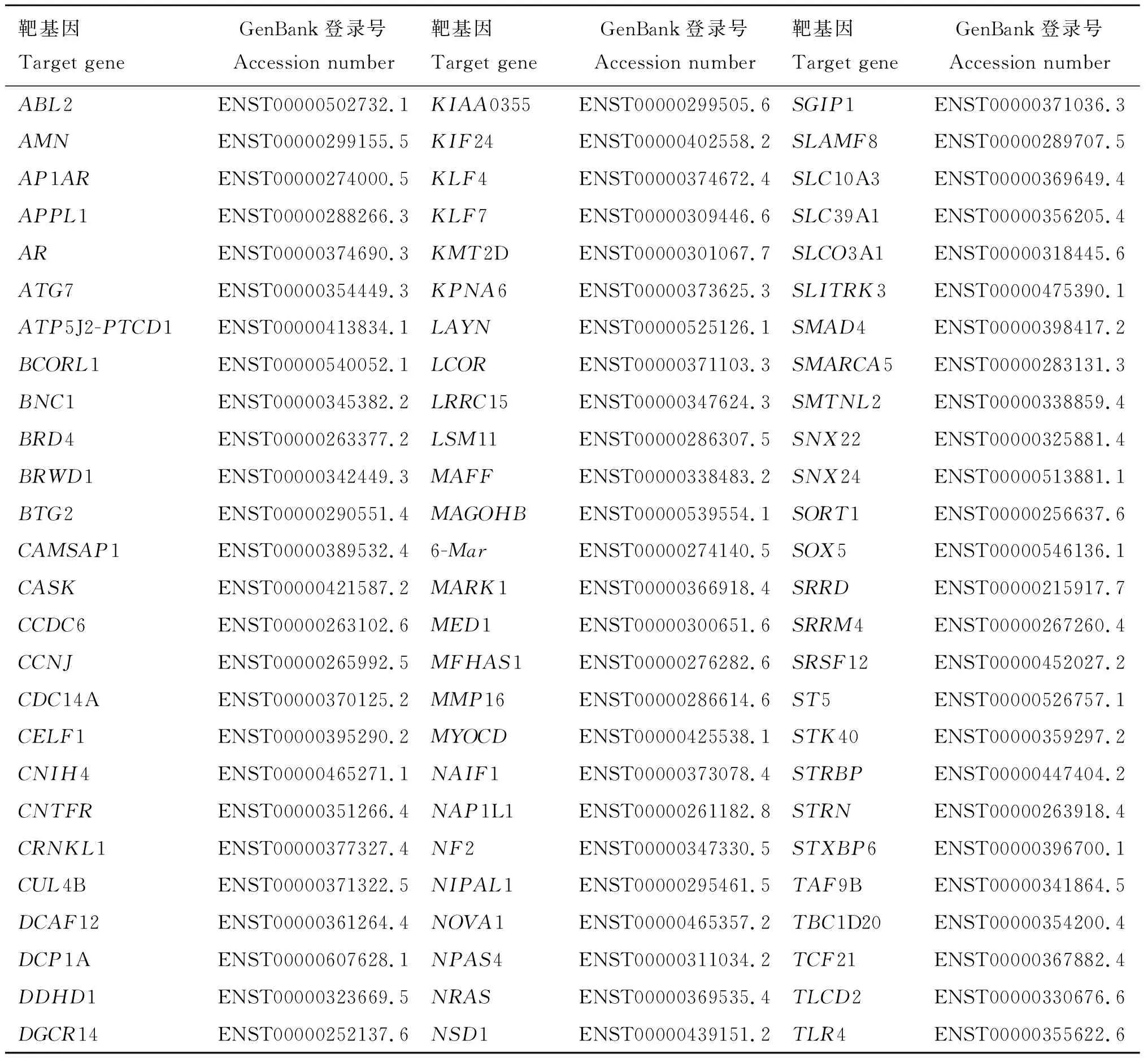
靶基因Target geneGenBank登录号Accession number靶基因Target geneGenBank登录号Accession number靶基因Target geneGenBank登录号Accession numberABL2ENST00000502732.1KIAA0355ENST00000299505.6SGIP1ENST00000371036.3AMNENST00000299155.5KIF24ENST00000402558.2SLAMF8ENST00000289707.5AP1ARENST00000274000.5KLF4ENST00000374672.4SLC10A3ENST00000369649.4APPL1ENST00000288266.3KLF7ENST00000309446.6SLC39A1ENST00000356205.4ARENST00000374690.3KMT2DENST00000301067.7SLCO3A1ENST00000318445.6ATG7ENST00000354449.3KPNA6ENST00000373625.3SLITRK3ENST00000475390.1ATP5J2-PTCD1ENST00000413834.1LAYNENST00000525126.1SMAD4ENST00000398417.2BCORL1ENST00000540052.1LCORENST00000371103.3SMARCA5ENST00000283131.3BNC1ENST00000345382.2LRRC15ENST00000347624.3SMTNL2ENST00000338859.4BRD4ENST00000263377.2LSM11ENST00000286307.5SNX22ENST00000325881.4BRWD1ENST00000342449.3MAFFENST00000338483.2SNX24ENST00000513881.1BTG2ENST00000290551.4MAGOHBENST00000539554.1SORT1ENST00000256637.6CAMSAP1ENST00000389532.46-MarENST00000274140.5SOX5ENST00000546136.1CASKENST00000421587.2MARK1ENST00000366918.4SRRDENST00000215917.7CCDC6ENST00000263102.6MED1ENST00000300651.6SRRM4ENST00000267260.4CCNJENST00000265992.5MFHAS1ENST00000276282.6SRSF12ENST00000452027.2CDC14AENST00000370125.2MMP16ENST00000286614.6ST5ENST00000526757.1CELF1ENST00000395290.2MYOCDENST00000425538.1STK40ENST00000359297.2CNIH4ENST00000465271.1NAIF1ENST00000373078.4STRBPENST00000447404.2CNTFRENST00000351266.4NAP1L1ENST00000261182.8STRNENST00000263918.4CRNKL1ENST00000377327.4NF2ENST00000347330.5STXBP6ENST00000396700.1CUL4BENST00000371322.5NIPAL1ENST00000295461.5TAF9BENST00000341864.5DCAF12ENST00000361264.4NOVA1ENST00000465357.2TBC1D20ENST00000354200.4DCP1AENST00000607628.1NPAS4ENST00000311034.2TCF21ENST00000367882.4DDHD1ENST00000323669.5NRASENST00000369535.4TLCD2ENST00000330676.6DGCR14ENST00000252137.6NSD1ENST00000439151.2TLR4ENST00000355622.6
(转下页 Carried forward)

图2 牛Smad 4基因3′UTR和bta-miR-146a相互结合靶位点预测Fig.2 Target point prediction for bovine Smad 4 gene 3′UTR to bta-miR-146a
2.3 牦牛Smad 4-3′UTR-WT载体构建
利用设计的特异性引物,以牦牛卵巢组织基因组DNA为模板PCR扩增Smad4基因3′UTR,并用1%琼脂糖凝胶电泳检测扩增产物,然后对经过酶切、连接和转化后的Smad4基因3′UTR载体菌落进行PCR扩增,用1%琼脂糖检测扩增产物。由图3、图4可知,PCR扩增产物在1 000~2 000 bp 之间出现特异性条带,并且其大小与预期片段大小一致。将阳性克隆产物送公司测序,测序结果(图5)证实牦牛Smad4基因3′UTR靶序列AGTTCTC成功地插入双荧光素酶报告载体psiCHECK2中,此Smad 4-3′UTR-WT载体可以用于荧光素酶活性的检测。
M. DNA 相对分子质量标准;1~2. PCR扩增产物N. DNA marker DL2000;1-2. PCR products of yak Smad 4 gene 3′UTR图3 牦牛Smad 4基因3′UTR区RT-PCR电泳图Fig.3 RT-PCR electrophoresis of yak Smad 4 gene 3′UTR
M. DNA 相对分子质量标准;1~8. 菌落扩增产物 N. DNA marker DL2000;1-8. Colonies amplification products图4 牦牛Smad 4基因载体菌落RT-PCR电泳图Fig.4 RT-PCR electrophoresis of yak Smad 4 vector colonies
2.4 牦牛Smad 4-3′UTR-MT载体构建
以牦牛Smad 4-3′UTR-WT载体为模板,进行PCR反应,扩增含突变序列的两段序列并进行拼接,之后进行酶切、连接、转化、提取质粒,并进行测序分析,测序结果证实牦牛Smad4基因3′UTR靶序列AGTTCTC突变为CTGGAGA(图5),此Smad 4-3′UTR-MT载体构建成功,可以用于后续荧光素酶活性的检测。
2.5 双荧光素酶活性检测结果
将牦牛Smad4基因3′UTR野生型/突变型载体与bta-miR-146a mimics/NC共转染293T细胞后,检测双荧光素酶活性。由图6可知,Smad 4-3′UTR-WT+ mimic组的荧光素酶活性显著低于 Smad 4-3′UTR-WT+ mimic NC组(P<0.05),而Smad 4-3′UTR-MT+ mimic组的荧光素酶活性与 Smad 4-3′UTR-MT+ mimic NC组差异不显著(P>0.05)。此结果表明,bta-miR-146a对Smad 4-3′UTR-WT的荧光素酶活性有显著抑制作用,而bta-miR-146a对Smad 4-3′UTR-MT的荧光素酶活性没有显著影响。
3 讨 论
miRNA是一类内源性的非编码RNA,大小为18~24个核苷酸,主要通过碱基互补配对的方式识别靶基因,并根据互补程度的不同指导沉默复合体降解靶基因或者阻遏靶基因的翻译[25]。有研究表明,miRNA对卵泡和卵母细胞的生长、成熟有不可替代的作用[26]。在小鼠的研究中发现,miR-383能促进颗粒细胞增殖、激素分泌[18];miR-224能促进颗粒细胞增殖[28-29]、激素分泌以及芳香酶表达[30],延迟卵丘卵母细胞成熟[31];miR-145能抑制颗粒细胞的增殖[21];miR-146能经过视黄酸信号途径调控精原细胞分化[32]。在猪的研究中发现,miR-26b抑制芳香酶表达和激素分泌,并且促进颗粒细胞的凋亡[22]。我们先前通过PCR半定量方法检测了Smad4基因和miRNA在牦牛各组织中的表达情
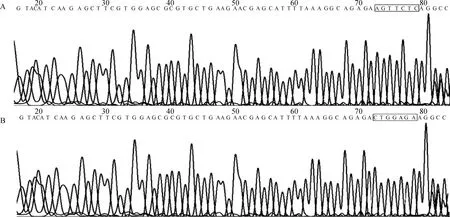
A. Smad 4-3′UTR-WT载体序列;B. Smad 4-3′UTR-MT载体序列A. Sequence of Smad 4-3′UTR-WT; B. Sequence of Smad 4-3′UTR-MT图5 牦牛Smad 4基因3′UTR构建载体序列测序图Fig.5 Yak Smad 4 gene 3′UTR vector sequencing map
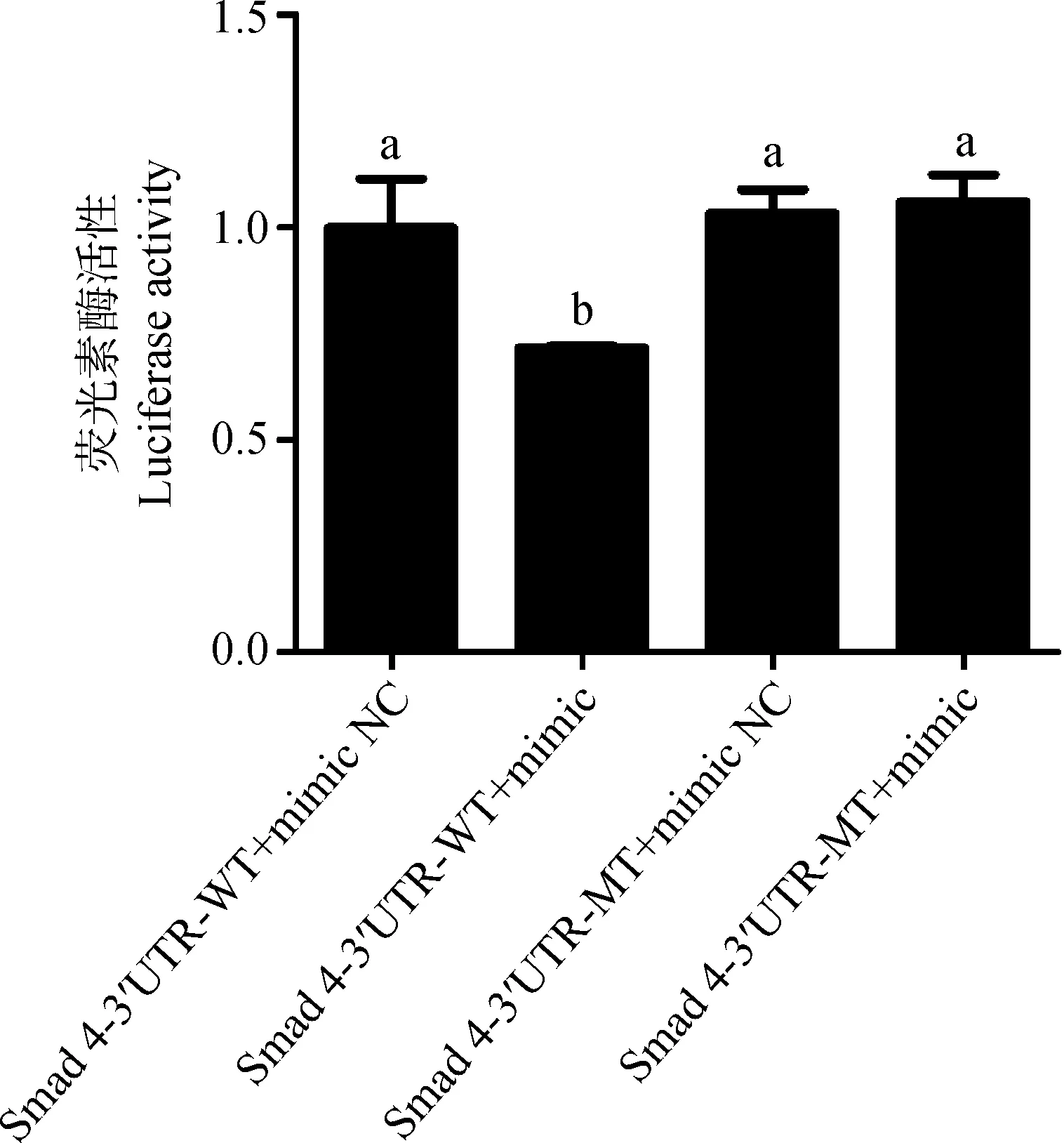
各组间,不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)Different letters indicate significant differences(P<0.05), the same letter indicate no significant difference(P>0.05) among different groups图6 双荧光素酶活性检测结果Fig.6 The results of dual-luciferase activity assay
况,结果发现,Smad4在牦牛卵巢、输卵管和子宫等生殖组织中均有表达,而且bta-miR-146a在牦牛卵巢组织中表达量较高,推测Samd4基因是bta-miR-146a的靶基因[27]。因此本试验首先利用miRBase数据库和MEGA 6.0分析了miR-146a成熟序列在牛、人、小鼠、大鼠、黑猩猩、猕猴、狗和鸡等8个物种中的保守性,结果发现,miR-146a成熟序列在脊椎动物中具有高度的保守性,暗示miR-146a在基本生命过程中发挥着一定的生物学功能。然后采用TargetScan软件,以牛数据库为基础,搜索miR-146a的靶基因并且分析bta-miR-146a与靶基因的结合位点,结果发现,Smad4是bta-miR-146a的248个潜在靶基因之一,而且Smad4基因3′UTR区AGUUCUC序列与bta-miR-146a成熟序列UCAAGAG存在保守的互补结合位点,更进一步提示Smad4基因可能是bta-miR-146a的靶基因之一。
在哺乳动物中,Smads蛋白是将转化生长因子-β(transforming growth factor-β,TGF-β)信号传导至细胞核的介导蛋白,在TGF-β信号传导过程中起着关键性作用[33-34]。目前已发现9种哺乳动物的Smads蛋白,根据功能不同分为受体激活型Smad蛋白(recepter activated smad,R-Smad)、抑制型Smad蛋白(inhibitory smads,I-Smads)和通用调节型Smad蛋白(common mediator smads,Co-Smads),其中Smad 4为唯一Co-Smads蛋白[35-36]。在TGF-β信号传导过程中,R-Smad首先被激活的受体磷酸化,然后与Smad 4结合形成异源性聚合体,进入细胞核,从而调控目的基因的表达[33,37]。当敲除Smad4基因时会阻断信号传导通路,使上游信号分子所携带的信息无法正常传递至细胞核,从而导致细胞损伤[19, 38-39]。故Smad4在TGF-β信号传导过程中起着中枢性作用[3, 33,37]。而且现研究也已证明,Smad4基因在小鼠多种组织中发挥着重要作用,例如,Smad4基因在卵巢中表达广泛,其中在卵泡中表达更加明显,而且随着卵巢的成熟,表达量逐渐上升[40];当敲除心内膜中Smad4基因会导致上皮细胞转化功能受阻、心内膜细胞增殖停止和心室心内膜结构异型等症状,从而影响心正常生长发育[41];敲除胚胎平滑肌细胞Smad4基因会对平滑肌细胞分化、增殖、迁移等产生影响,从而导致胚胎心血管机能不全[42];当敲除表皮Smad4基因会使毛囊干细胞持续性激活消耗,从而导致皮肤肿瘤形成[43];当特异性敲除Smad4基因后小鼠排卵数、产仔数等生殖能力随时间而逐渐下降,并且有腔卵泡明显减少,闭锁卵泡大大增加,表明Smad4基因在小鼠卵巢卵泡发育过程中确实发挥着关键性作用[19,39]。
为了验证牦牛Smad4基因与bta-miR-146a的靶向关系,本研究以牦牛卵巢基因组DNA为模板,克隆Smad4基因3′UTR区,并将结合序列AGTTCTC和突变序列CTGGAGA插入双荧光素酶报告载体psiCHECK2中,从而构建Smad4-3′UTR-WT和Smad4-3′UTR-MT载体,再通过载体与miRNA共转染细胞后,检测双荧光素酶活性,结果发现,bta-miR-146a可以直接与Smad4基因3′UTR区的部分碱基互补配对结合,表明Smad4基因是bta-miR-146a的靶基因。这在理论上直接证明bta-miR-146a可以抑制Samd4基因表达,此结果为进一步探索bta-miR-146a在牦牛卵巢卵泡发育中的功能奠定了理论基础。
4 结 论
本试验先利用miRBase数据库和MEGA 6.0软件分析发现miR-146a具有高度的保守性,再利用TargetScan软件成功预测到Smad4基因是bta-miR-146a的潜在靶基因之一,而且其3′UTR区部分序列与bta-miR-146a存在结合位点。然后通过成功构建Smad4基因3′UTR区双荧光素酶报告基因载体,初步证实Smad4基因是bta-miR-146a的靶基因,从而提示bta-miR-146a在牦牛卵泡发育过程中可能通过调控Smad4基因发挥作用,但有待深入研究。
