牛核移植胚胎中IGF2/H19基因簇父源印记控制区甲基化模式研究
2018-08-07方东辉付茂忠
王 巍,易 军,唐 慧,方东辉,甘 佳,石 溢,王 淮,付茂忠
(四川省畜牧科学研究院,动物遗传育种四川省重点实验室,成都 610066)
基因组印记(Genomic imprinting),又称为遗传印记(Genetic imprinting),是指在配子期或者合子期,父源和母源的等位基因或染色体进行特异性的修饰,并产生具有不同表达活性等位基因的一种由单亲传递遗传信息的特殊遗传现象,且该现象不遵从孟德尔定律[1-2]。具有这种现象的基因称为印记基因(Imprinted gene),绝大多数的印记基因都是成簇存在的,每个簇都包括若干能够翻译成蛋白的基因和一个非编码RNA(ncRNA)组成。在印记簇中基因的表达或沉默是由印记控制区(Imprinting control regions,ICRs),通过顺式作用来调控的[3],ICRs的本质是一段差异甲基化区域(Differentially methylated regions,DMRs),它的调控作用可以覆盖很长的染色体区域。ICR在生殖细胞中即发生了特定的印记,以便调控整个基因簇的基因沉默情况[4]。因此基因簇可以分为2种,即在卵母细胞发生过程中进行修饰产生的母源印记以及在精子发生过程中进行修饰产生的父源印记[5-6]。
IGF2/H19基因簇为父源印记基因簇,包括2个父源表达的基因 IGF2 和 INS 还包括 1 个 ncRNA(H19)[7]。该簇包括4个甲基化印记区(DMR),其中DMR1和DMR2分别定位在IGF2的启动子和外显子6上,呈父源印记[8];DMR0定位在 IGF2的外显子 U1上,呈母源印记状态[9];H19-DMD定位在H19转录起始点以前2 kb左右的区域内,呈父源印记状态[10]。敲除H19-DMD会导致H19基因表达上调和IGF2基因的表达抑制,该印记区为基因簇的 ICR[11]。
印记区作为一种反应甲基化动态模式的标记,已经成为基础理论研究的焦点。因此,选择父源印记区作为标签,通过甲基化测序手段检测克隆动物早期胚胎中这些印记区的甲基化水平,可以直观地反映克隆胚中父源染色体的甲基化模式,对于提高克隆胚胎的成功率具有重要的理论指导意义。
1 材料
1.1 试验样本
处于配子期(受精后8 h或激活后5 h)、S期、2-cell期、8-cell期和桑葚期的牛体外受精(IVF)胚胎和体细胞核移植(SCNT)胚胎各40枚,由四川农业大学动物遗传育种与繁殖实验室提供。
1.2 总DNA的亚硫酸盐变性及DNA提取
按照全细胞亚硫酸盐DNA甲基化修饰试剂盒(Epigentek)的操作说明,取20 μL的样品进行DNA的亚硫酸盐变性及提取。提取的DNA可立刻使用或存储在-20℃下以便以后使用。
1.3 引物设计
试验分别选取IGF2/H19基因簇的ICR区为主要研究对象。根据NCBI网站上公布的牛H19基因序列查找其启动子序列,使用methyl primer express software v1.0引物设计软件分别在2个基因的启动子内选取1个CPG岛设计引物,用于BSP测序。引物设计情况见图1。
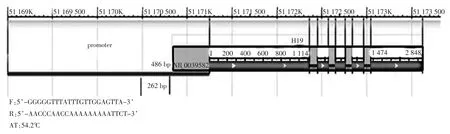
图1 H19启动子区选取扩增片段
1.4 目标片段的克隆
参照天根生化科技(北京)有限公司MasterMix PCR试剂盒的使用说明,在2×25 μL应体系中进行PCR反应,条件如下:94℃预变性 5 min;94℃变性 45 s,退火 45 s,72℃延伸 45 s,38个循环;72℃作用 10 min。
1.5 目标片段的扩增
用干净的手术刀割下含有要回收DNA片段的琼脂糖凝胶,放入1.5mL离心管中。采用UNIQ-10柱式DNA胶回收试剂盒(上海生物工程技术服务有限公司),按照说明书操作进行胶回收。回收的DNA通过pMD19-T载体(大连宝生物公司)进行连接,连接产物均匀加入到30 μL的大肠杆菌DH5α感受态细胞中,冰浴30 min;42℃水浴热激45 s,然后立即冰上放置冰浴1 min;每管中加入900 μL的LB肉汤培养基,37℃震荡培养2 h,使细菌复苏,并表达对抗生素的抗性;然后涂布于含Amp的LB琼脂平板中,37℃倒置培养过夜。
1.6 菌落PCR鉴定
挑选平板上的单个菌落,接种于含Amp的LB肉汤中培养过夜,用菌液作PCR模板进行菌落PCR鉴定,挑选3个基因(SCNT和IVF两个平行实验组)各个时间阶段的12~15个阳性克隆后送上海英俊公司进行序列测定。
1.7 数据分析
使用BIQ甲基化分析软件对获得序列的甲基化程度进行计算。使用SPSS统计分析各处理组相对表达量,以P<0.05和P<0.01为具有统计学差异。IVF与SCNT两种胚胎间不同胚胎发育阶段比较采用单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 目标基因扩增结果
PCR产物经1%琼脂糖凝胶电泳检测后,在250 bp至500 bp之间接近250 bp处出现目的条带,与目的片段的长度相符。结果见图2。

图2 PCR产物凝胶电泳检测结果
2.2 H19-IGF2基因簇ICR区在早期胚胎发育期中的印记模式
各个发育阶段的IVF胚胎和SCNT胚胎中,H19基因启动子的甲基化测序结果,见表1。
由表1可知,H19-IGF2基因簇ICR区甲基化水平在IVF组和SCNT组早期胚胎中的变化趋势相同,均为2-cell期之前呈下降趋势,在2-cell达到甲基化的最低点,8-cell甲基化值开始回升。IVF胚胎S期较配子期的甲基化水平下降较大,差异显著(P<0.05),与2-cell期的甲基化水平差异不显著(P>0.05)。SCNT胚胎的甲基化水平在这3个阶段均差异不显著(P>0.05)。SCNT胚胎的甲基化水平在早期胚胎发育的各个阶段均高于IVF的,2-cell和8-cell两组的甲基化水平差异显著(P<0.05),其他各阶段差异均不显著(P >0.05)。

表1 H19-IGF2基因簇ICR区在早期胚胎发育期中的甲基化值
2.3 H19启动子区10个甲基化位点在SCNT和IVF胚胎中的甲基化变化模式
如图3所示,H19转录起始点前468 bp开始的262 bp序列中包含有10个甲基化位点。

图3 H19启动子区的10个甲基化位点分布
如图4~5所示,将10个甲基化位点在IVF与SCNT早期胚胎发育过程中的甲基化情况分别进行统计。5号与7号甲基化位点在IVF与SCNT的2-cell期均未见甲基化,4号、9号和10号甲基化位点在SCNT胚胎的2-cell期出现了异常的甲基化升高,其余各位点的甲基化状态在IVF与SCNT早期胚胎发育过程中均呈2-cell期之前下降,2-cell期达到最低点,8-cell期开始回升的模式。

图4 10个甲基化位点在牛早期胚胎发育周期中甲基化趋势(IVF)

图5 10个甲基化位点在牛早期胚胎发育周期中甲基化趋势(SCNT)
将SCNT早期胚胎2个ICR区的各个甲基化位点在发育过程中相对于IVF的甲基化变异情况如图6所示。SCNT早期胚胎H19启动子的10个甲基化位点集中在2-cell期大量发生甲基化程度变异,其中4号、6号和9号位点的甲基化增加的百分比较高;SNRPN启动子的5个甲基化位点同样在2-cell期大量发生甲基化程度变异,且都为正向变化,其中5号位点的甲基化增加的百分比最高。

图6 SCNT胚胎H19启动子各甲基化位点相对于IVF胚胎甲基化的差异
3 讨论
3.1 SCNT胚胎父源DNA的异常甲基化动态模式
H19-IGF2基因簇表现为父源印迹,其ICR区在父源染色体呈甲基化状态并且随父源基因组一起经历甲基化的消除和重建[1,12],因此该ICR区在早期胚胎发育过程中的甲基化变化情况能够间接地反映父源DNA的甲基化动态变化模式。如表1所示,IVF胚胎S期较配子期的甲基化水平下降较大,差异显著(P<0.05),与2-cell期的甲基化水平差异不显著(P>0.05)。表明IVF胚胎的父源印迹ICR区由合子期至S期进行了激烈的去甲基化,由S期进入2-cell期的过程中去甲基化程度减缓,且该去甲基化是不依赖DNA复制的。间接证明了IVF胚胎中父源基因在S期之前进行主动的去甲基化,并于8-cell期开始DNA甲基化的重建,该结果与前面的免疫荧光结果相吻合,并支持Santos[3]的试验结果。SCNT胚胎的父源印迹ICR区甲基化模式虽然保持着与IVF胚胎相同的趋势,但8-cell之前各阶段的甲基化水平之间差异不显著(P>0.05)。通过计算H19基因启动子区在SCNT胚胎中各发育阶段的甲基化程度相对于IVF胚胎的差异百分比,发现S期之前的甲基化变化百分比之间差异极显著(P<0.01),而S期开始各阶段差值的差异不显著(P>0.05)。表明SCNT胚胎的父源基因组在进入S期,DNA发生大量复制之前去甲基化活动很微弱。两组胚胎之间在S期和2-cell期差异的百分比不显著(P>0.05),这就证明S期DNA大量开始复制后,父源染色体的去甲基化能力也很微弱。以上结论间接说明SCNT的父源基因组在S期之前极微弱地发生了主动去甲基化,伴随着DNA复制的开始,又发生了极微弱的被动去甲基化。父源染色体去甲基化能力的减退造成了2-ell期甲基化水平的异常升高。SCNT胚胎在8-cell期出现甲基化水平回升,由于2-cell期、8-cell期和桑葚胚时SCNT胚较IVF胚甲基化水平增长的百分比相同,说明SCNT胚胎父源基因组与IVF胚具备相当的甲基化重建的能力。最终造成SCNT胚父源基因组过高的直接原因为2-cell期前去甲基化的不完全[4],并且该去甲基化能力的降低包括主动和被动模式的同时降低。
3.2 H19-IGF2基因簇ICR区异常印记对胚胎的影响
印记控制区ICRs通过顺式作用调控着整个印记簇中基因的表达或沉默[13],其甲基化模式的正常与否就更加关键。试验选取的H19-IGF2基因簇对胚胎发育以及机体生理水平的调控至关重要。本试验研究发现,SCNT胚胎中这2个基因簇的ICR区甲基化模式均出现了较大的异常。SCNT胚胎H19-IGF2基因簇ICR的甲基化水平在早期胚胎发育的各个阶段均高于IVF胚胎,最终的桑葚胚仍保留着较高的甲基化水平,超甲基化水平必定会影响ICR区对于整个基因簇的调控情况。H19-IGF2基因簇包括2个重要的与胚胎发育相关的基因,即H19和IGF2。大量的研究表明,H19基因表达的紊乱将导致多种发育异常及死胎[14],更易导致机体内肿瘤的发生[15]。Ogura 等[7]检测发现,克隆小鼠发育到足月和出生后存活与印记基因的正常表达有着十分紧密的联系。Weksberg 等[16]和 Birnbacher等[17]研究发现,IGF2 基因印迹的松弛或丧失会导致胎儿出现生长过度、羊水过多、致死率升高、器官发育比例失调等BWS的症状。Forne研究发现,H19基因具有反式调节作用,其表达受到抑制,会引起IGF2基因DMR甲基化水平发生改变,从而引起IGF2基因过度表达,出现过度生长的表型[8]。
3.3 影响SCNT胚胎印迹区发生甲基化变异的关键甲基化位点的筛选
将SCNT胚胎H19基因启动子区的10个甲基化位点的甲基化水平与IVF胚胎做对比,可见大量位点甲基化水平发生变化的阶段集中在S期和2-cell期,也就是H19-IGF2基因簇ICR区甲基化模式出现重大异常的时间段。在这10个位点中,3号位点和4号位点分别在SCNT胚胎的S期与2-cell期较IVF胚出现了最大量的异常上调,为这2个时间段内该ICR区去甲基化作用的弱化提供了最大贡献。另外,4号位点在2-cell期相对于IVF胚胎的变异百分比最大,说明该位点受到去甲基化抑制机制的影响最大。
4 结论
SCNT的父源基因在S期之前发生了主动去甲基化,伴随着DNA复制的开始,又发生了被动去甲基化。SCNT胚胎父源基因与IVF胚的甲基化重建能力相当。筛选了1个去甲基化抑制机制的易感位点,H19的转录起始点前468 bp开始的262 bp序列中的4号甲基化位点。
