谷子脂氧合酶(LOX)活性测定条件的研究
2018-08-02郝瑞丽谢仲梅申慧芳刘晶陈利青韩渊怀李红英张彬
郝瑞丽,谢仲梅,申慧芳,刘晶,陈利青,韩渊怀,李红英,张彬*
(1.山西农业大学 文理学院,山西 太谷 030801;2.山西农业大学 农学院,山西 太谷030801)
谷子(Foxtailmillet),又名粟,经脱壳处理后又称小米[1]。作为五谷之首的谷子,起源于我国,距今有着8 000多年历史,是世界栽培史上最古老的作物之一,自夏商、先秦、隋唐以来一直占据着我国主粮地位,被誉为中华民族的哺育作物。谷子营养成分均衡,含有大量蛋白质、糖类、脂肪、多类维生素以及钙、铁等人体必需营养物质,与我国人民饮食等需求极其符合。谷子主要分布于山西、河北、河南、陕西、宁夏、内蒙古、甘肃等北方地区[2],且山西省具有自身先天的资源优势,生产的小米具有品质好等突出优点,并且有着“中国小米在山西,山西小米数第一”之美称[3]。
脂氧合酶(lipoxygenase),简写为LOX,也称之脂肪氧化酶、脂肪加氧酶、亚油酸氧化还原酶或脂肪氧合酶,是在哺乳动物、植物和微生物中广泛存在的一类非血红素铁蛋白。据相关研究可知,脂氧合酶(LOX)参与了植物的相关调控,主要包括生长、发育、成熟、衰老和防御等过程,它主要以亚油酸或亚麻酸作为底物,催化反应生成多种不饱和酸[4]。脂氧和酶(LOX)途径的最初反应是甘油脂类被水解并释放出游离的不饱和脂肪酸,其在有氧条件下,经LOX催化后生成了氢过氧化物脂肪酸[5]。脂氧合酶(LOX)最早被报道于粮食作物大豆中,而目前已经从许多植物中分离出了脂氧合酶(LOX)基因,例如,猕猴桃(Adlox1~Ad-Lox6),番茄(TomLoxA~TomLoxF)及拟南芥(AtLox1~AtLox6)等。同种植物中的不同脂氧合酶(LOX)基因的表达不同,意味着不同的LOX基因在植物生长发育过程中发挥着不同的功能[6]。
陈化,可理解为种子成熟收获之后所发生的劣变变质使得种子品质包括色泽度、气味等有所下降的过程。稻谷不耐储藏,一般第二年就开始陈化劣变,陈化前后,蛋白质发生明显变化,陈化后的蛋白质巯基明显氧化并有了去糖基化的趋势使得其种用品质、营养价值、食用品质等利用价值大大降低,引起了很大经济损失[7]。脂肪酶在脂肪分解代谢的过程中,调控了脂肪的转化速率,是脂肪酸败变质的原因之一[8]。小米在储存过程中发生劣变,其中最快的是脂肪。小米的陈化主要表现为两个方面的变化:一是生理方面的变化,酶活性及其代谢水平的变化;二是物理变化,主要表现为粮食的颜色和光泽度变暗淡,米质变脆硬化,淀粉的细胞变硬,细胞膜有所增强,吸水能力有所降低,糊化能力以及持水能力下降,并且伴有陈化气味的产生。
测定脂氧合酶(LOX)活性的方法有很多种,主要常见的有氧电极法、分光光度法、同位素标记法等,快速测定方法有淀粉-碘化钾法(KI-S)、亚钾蓝染色法(MBB)、胡萝卜素染色法(CB),而在诸多测定方法中分光光度法最简便、快速和易于连续测定,因此我们将采用最便捷、快速的方法“分光光度法”来进行谷子中LOX活性的测定[9]。
综上所述脂氧合酶与陈化密切相关,而对于谷子而言,避免谷子陈化所带来的品质下降、颜色、口感、种质下降等是很有必要的,因此对于脂氧合酶(LOX)的研究具有重要意义。
1 材料与方法
1.1 试验材料
以12个优质谷子品种为供试材料(晋谷21号、向阳谷、9806-1、九谷14号、豫谷11号、毛粟、鸭子嘴、糟皮一刀把齐、露米青谷、沁黄、济谷11号、黑龙江汤原-红粘谷),其中晋谷21号为主要试验材料,是山西省农业科学院经济作物研究所经使用60Co-r射线处理晋汾7号干种子后经南繁北育、多代选择的集高产优质于一体的新品种。
1.2 试验方法
1.2.1 样品的处理
试验中所用谷子经脱粒处理后,使用JLGJ-45型检验性砻谷机脱去麸壳,将混杂、破碎的米粒剔除并挑选大小均一的米粒存放于干净、遮光的牛皮纸袋中,室温保存,用于后续试验。
1.2.2 脂氧合酶提取与活性测定
将所挑选米粒使用磨粉机粉碎,过100目筛,获得小米粉,称取0.6 g,按料液比1∶10 (W/V)加入6 mL 0.1 mol·L-1pH 6.5的磷酸缓冲液,漩涡仪振荡充分混匀,冰水浴中浸提1 h,4 ℃ 12 000 r·min-1离心10 min,将上清转移至新的离心管中即获粗酶提取液。
取0.25 mL吐温-20溶解于10 mL 0.05 mol·L-1pH 9.0的硼酸-硼砂缓冲液中混匀,逐滴加入0.25 mL亚油酸,待混匀成乳浊液后再加入1 mL 1 M的NaOH并放置至澄清,最后用0.1 mol·L-1pH 6.5的磷酸缓冲液定容到100 mL,即得浓度为0.0 078 mol·L-1的亚油酸底物。
将 0.1 mL粗酶提取液与0.2 mL的亚油酸底物及2.7 mL 0.2 mol·L-1pH 7.0磷酸缓冲液放置于试管中混匀,在30 ℃条件下反应5 min后,立即放入100 ℃沸水浴5 min终止反应。使用紫外分光光度计测定234 nm 处吸光值A234。以pH 7.0磷酸缓冲液和亚油酸底物为空白对照,作3次重复。将 30 ℃条件下,每克小米每分钟吸光值上升0.001定义为1个酶活单位。LOX 活性表示为:△A×103AUmin-1g-1。
1.2.3 脂氧合酶最适pH的测定
将所提取的亚油酸底物和粗酶液置于不同pH(5、6、7、8、9)条件下,采用紫外分光光度法,待读数稳定后记录下数据,并进行3次重复,取平均值。LOX活力最大时的pH值即为谷子中脂氧合酶(LOX)的最适pH值。
1.2.4 脂氧合酶最适温度的测定
将试管置于不同温度(25、30、35、40、45 ℃)下,依次向试管中加pH7.0的磷酸氢二钠-磷酸二氢钠缓冲液,所配制的亚油酸底物、粗酶液,待反应5 min后使用分光光度法读数,每个温度下的反应都进行3次重复并取平均值,LOX活力最大时所对应的温度即为谷子中脂氧合酶(LOX)的最适温度。
1.2.5 脂氧合酶最适底物添加量的测定
将试管放置于30 ℃条件下,依次向其加入pH 7.0的磷酸氢二钠-磷酸二氢钠缓冲液、亚油酸底物(150、175、200、225、250 μL),粗酶提取液,反应5 min后测定吸光值,试验设置3次重复,取平均值,LOX活力最大时所对应的底物添加量即为脂氧合酶(LOX)的最适反应底物添加量。
1.2.6 粗酶提取时间对LOX活力影响的测定
按照1.2.2中粗酶液提取方法,将小米粉与磷酸缓冲液按料液比1∶10 (W/V)充分混匀后,在冰水浴中浸提时间设30 min、1、2、3、4、5 h六个梯度,4 ℃、12 000 r·min-1下离心10 min后获粗酶提取液,测定LOX活力,每个梯度设3次重复取平均值,LOX活力最大时所对应时间即为LOX粗酶液最佳提取时间。
1.2.7 粗酶液加入量/底物加入量对LOX活力影响的测定
在pH为7、反应温度为30 ℃、底物添加量为200 μL、提取时间为2 h等条件下,反应体系粗酶液加入量固定为50 μL,加酶量底物量比例分别为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7、1∶8,测定LOX活力。
1.3 数据处理
使用Excel对试验所测量数据进行统计、简单数据处理与绘图分析,使用IBM SPSS Statistics 20软件对数据进行差异显著性分析。
2 结果与分析
2.1 pH对谷子中脂氧合酶(LOX)活力的影响
配制0.1 mol·L-1pH值4.0~9.0的缓冲液,探究pH值对LOX活力测定的影响,其中pH值4.0~6.0采用柠檬酸-磷酸缓冲液配制;pH值6.1~7.0采用磷酸氢二钠-磷酸二氢钠缓冲液配制;pH值7.9~9.0采用硼酸-硼砂缓冲液配制。
由图1中可以看出,当pH为7.0时,谷子中的脂氧合酶(LOX)活性最高,与其他pH条件下差异显著(P<0.05)。对于植物中的脂氧合酶(LOX)的最适pH值的相关研究也有报道,例如黄瓜的最适pH值为7.0左右,番茄的为6.0,青苹果的为6.5,甜瓜的为7.0[10],而谷子的最适pH值为7.0,与其相差不大。

图1 不同pH值条件下LOX活力Fig.1 The LOX activity at different pH conditions
2.2 温度对谷子中脂氧合酶(LOX)活力的影响
采用pH7.0缓冲液,分别在不同温度下进行LOX活力测定,探究温度对谷子中LOX活力的影响。由图2可知在25~30 ℃时,LOX活性呈现出了一个上升的趋势,在30 ℃时活性达到最大,30~35 ℃时,LOX活性则呈现出一个下降的趋势,35 ℃以后活性则趋于平稳,几乎没有变化。即在30 ℃时,谷子中的脂氧合酶(LOX)活性最高,且与其他温度条件差异显著(P<0.05)。

图2 不同温度条件下LOX活力Fig.2 The LOX activity at different temperatures
2.3 底物添加量对谷子中脂氧合酶(LOX)活力的影响
在30 ℃条件下采用pH 7.0磷酸氢二钠-磷酸二氢钠缓冲液,分别向反应体系加入亚油酸底物(150、175、200、225、250 μL),探究底物添加量对LOX活力的影响。
由图3可知,在底物添加量为150~175 μL时的LOX活性保持不变;175~200 μL时,LOX活性增加;200时,LOX活性最大;200~250 μL时,LOX活性减小,即亚油酸底物加入200 μL时,谷子中的LOX活性最高,与其他处理条件差异显著(P<0.05)。
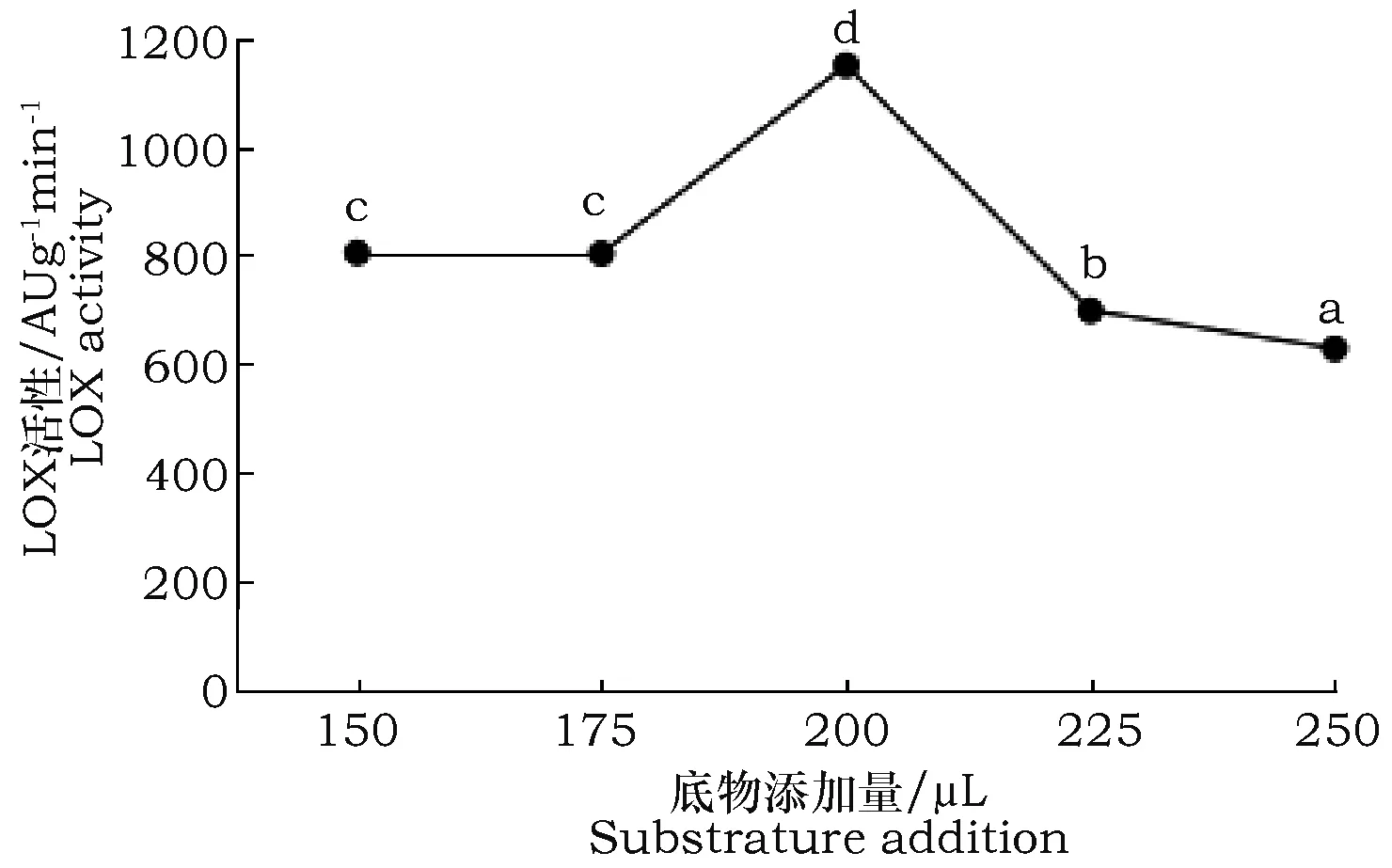
图3 不同底物添加量条件下LOX活力Fig.3 The LOX activity at different substrate addition concentrations
2.4 粗酶提取时间对谷子中LOX活力的影响
据图4可知,随着提取时间增加,LOX活性趋于先增加后降低的趋势,当提取时间为2 h时,酶活力达到最大,并与其他处理差异显著(P<0.05),提取时间30 min、3 h和4 h之间差异不显著。提取时间低于或者高于2 h,酶活力均降低,即提取时间为2 h时,谷子中的LOX活性最高。

图4 提取时间对谷子LOX活力的影响Fig.4 The effect of extraction time on LOX activity in foxtail millet
2.5 粗酶液加入量 / 底物加入量对谷子中LOX活力的影响
由图5可知,随着粗酶加入量/底物加入量比例的增大,LOX活性呈梯状逐渐上升,当比例为1∶6时,所测 LOX活力最大即LOX活力峰值,比例为1∶1时,所测LOX活性最小,且各处理条件下LOX活力差异显著(P<0.05),反应体系各组分添加量见表1。

图5 不同粗酶加入量/底物加入量条件下 LOX活力Fig.5 The LOX activity at different condition of crude enzyme additions/substrate additions
Table1 The addition of component in reaction system

粗酶加入量/底物加入量Extraction addition/substrate addition ratio缓冲液/mLReaction system buffer亚油酸底物/μLLinoleic acid substrate粗酶液/μLCrude extraction1∶12.9050501∶22.85100501∶32.80150501∶42.75200501∶52.70250501∶62.65300501∶72.60350501∶82.5540050
2.6 不同谷子品种LOX活力的比较
选用12个优质谷子品种为研究对象,依照1.2.2方法对LOX活力进行测定。由图6可知,在这12个谷子品种中,晋谷21号与济谷11号LOX活性显著高于其他品种,两者间差异不显著,与豫谷11号差异较显著,与其他品种差异显著(P<0.05);9806-1和九谷14号LOX活力低于其他品种,两者差异不显著,与鸭子嘴、沁黄两品种差异较显著;毛粟、露米青谷和红粘谷三者间LOX活力差异不显著,与糟皮一刀把齐差异较显著,与其余各品种间 LOX活力差异显著(P<0.05)。

图6 不同品种谷子LOX活性Fig.6 The LOX activity of different varieties of foxtail millet
3 讨论与结论
3.1 谷子中LOX活性影响因素的最适条件
LOX的活性受pH、温度、底物浓度等因素的影响,pH过高或过低会使酶蛋白变性而失活,植物脂氧合酶所能耐受的pH值一般在3~10之间,最适的pH一般位于中性或酸性范围内[11],例如某些植物的LOX的最佳pH测定为:水稻的pH为7.6[12],甘蓝的pH为7.0[13],烟草的pH为6.5[14]等,而我们所测得谷子LOX的最佳pH为7.0,符合LOX所能耐受的pH值的范围,因此结论可靠。
一般而言,温度越高,酶活性越大,但酶是蛋白质,若温度过高会发生变性而失活,因而通常情况下随着温度升高酶活性增大,直至某一温度活性达到最大值,超过这一最适温度,酶活力降低甚至变性失活。多数植物的最适温度位于30~60 ℃之间,温度增长或者是热处理的时间过长都会有效地纯化脂氧合酶(LOX)的活性,据有关报道可知花生种子的LOX的最适温度为35 ℃[15],黄瓜的为40 ℃,毛尖茶叶的为50 ℃[16],而本研究谷子的脂氧合酶(LOX)的最适温度为30 ℃,处于多数植物的最适温度范围以内。
在一定的底物添加范围内,脂氧合酶(LOX)活性会随添加量的增加而增大,当添加量达到一定值以后,脂氧合酶的活性不增反减。在底物添加量为150~200 μL时,LOX的活性增大,200~250 μL时,LOX的活性减小,200 μL时,LOX的活性最大。因此得出了谷子脂氧合酶(LOX)的最适pH值为7.0,最适温度为30 ℃,最适底物添加量为200 μL。
3.2 粗酶提取时间对谷子中 LOX活力的影响
本研究发现,粗酶提取2 h时所得 LOX 活力最高,这与一些研究者研究提取时间对各作物LOX活性影响结果一致。LOX活性在一段时间内随粗酶提取时间增加当达到一定数值会呈现出降低的趋势,原因是酶的溶出量在一定时间内会因时间的增加随之增加,但当其达到最大值后,若时间继续增加,这可能会引起酶的分解甚至失活,从而导致酶在此时间内的溶出量小于其分解或失活的量,最终将使酶活性降低[17]。
3.3 粗酶液加入量/底物加入量对谷子中LOX活力的影响
已有研究表明,底物浓度会对 LOX活力的影响呈现先增加后降低的趋势[18]。本试验发现,粗酶液加入量/底物加入量比率对LOX活性产生一定程度影响,在一定范围内,LOX活性随着两者比值减小而呈现梯状上升,当1∶6时LOX活性最高,继续增加时则活性降低,这与前人研究结果一致,说明LOX活性受到其底物的抑制作用,可能是因为底物浓度高时导致水的有效浓度降低,同时引起分子扩散性降低,从而使得酶促反应速度降低或导致过量的底物在酶分子上聚集,生成没有活性的中间产物,从而最终导致反应速度的降低[19]。
3.4 LOX活性测定方法的评价
测定脂氧合酶(LOX)活性时,采用紫外线分光光度法比较快捷方便,原理:不饱和脂肪酸被LOX的催化后,可以生成具有共轭双键的氢过氧化物(HPOD),该化合物在234 nm处有吸收峰,其高度与酶活力呈现出正相关。本试验所采用测定方法与前人相比有一定的改进,细化了亚油酸底物制备、粗酶液提取等过程,酶活性测定过程也有一定优化[20,21],使操作更方便。但该法也存在一定的局限性,例如:(1)所需时间较长,不能对材料进行精密筛选;(2)LOX活性的测定需在室温下进行,温度过高或过低均会影响测定结果[22];(3)因为亚油酸容易发生自氧化作用,若存留时间过久,测定结果会因此受影响,因此亚油酸底物需现用现配。由此看来,此方法仍需进一步改进与优化。
此外,为了验证本试验采用LOX测定方法的可行性,运用此法对 12个品种谷子中 LOX活性进行了测定。在相同地域、生产时间、存储条件等因素下,各品种间LOX活力有所差异可能是由自身遗传基因型存在的差异所决定的。
本试验确立了一个适合谷子脂氧合酶(LOX)的反应体系条件,并测定出粗酶提取时间以及粗酶液加入量 / 底物加入量对谷子中 LOX活力的影响,这将有利于今后对谷子中脂氧合酶(LOX)进行进一步的相关研究,也为LOX介导的谷子陈化研究提供了一定的技术指导。
