拟南芥AAP6基因的克隆与转化马铃薯的研究
2018-08-02张松皓王昱蓉
李 倩,王 罡,张松皓,杨 丹,王昱蓉,
季 静1,安 婷1,李 辰1,马志刚3,史怀宇1,关春峰1,刘 玉4
(1. 天津大学环境科学与工程学院,天津 300072;2. 天津市天大天福生物技术有限公司,天津 300072;3. 天津大学化工学院,天津 300072;4. 电子科技大学生命科学与技术学院,成都 610054 )
氨基酸是植物新陈代谢的重要组成部分,不仅仅是蛋白质的成分,也是植物重要的次生代谢产物的前体和有机氮的载体.氨基酸作为酶和蛋白质的组成成分,对植物的新陈代谢具有不可替代的作用.植物体内种子贮藏蛋白的积累在很大程度上也取决于氨基酸的供应.氨基酸透性酶(amino acid permease,AAP)对植物体吸收氨基酸的过程,氨基酸在植物中细胞内、细胞间以及源器官到库器官之间的分配过程均发挥至关重要的作用[1].氨基酸透性酶是研究比较多的一类氨基酸转运蛋白[2].在植物中发现的第一个氨基酸转运蛋白是拟南芥氨基酸通透酶1(AtAAP1)[3-4].近年来,在拟南芥等植物中发现了一系列新的氨基酸转运蛋白,并进行了相关研究.研究报道,AtAAP1和 AtAAP5 在根系吸收氨基酸过程中具有重要作用[5-8];AtAAP2和 AtAAP6主要参与氨基酸在木质部与韧皮部的转运,而 AtAAP2、AtAAP3、AtAAP5有助于氨基酸在韧皮部的装载,并且在微管组织中表达;AtAAP1和AtAAP8参与了氨基酸在种子中的卸载过程[1,9-10].已有研究报道 AtAAP8 仅仅在种子及与其相关联的填充物中表达[11].最近的一项研究采用原位杂交技术发现,AtAAP8 也在“源”叶的韧皮部表达,揭示了该蛋白的新作用,进一步的生理分析指出,对种子发育的影响更可能是由于“源”叶韧皮部的氨基酸装载减少,而不是种子“库”中氨基酸的输入减少,从而导致了种子“库”的发育减弱[12].
近年来,基于氨基酸转运蛋白在长距离氨基酸转运中的作用,如叶到根或种子,这些基因可能是农作物改良的良好靶标.早期已有学者尝试利用氨基酸转运蛋白进行作物改良,了解马铃薯块茎中的氨基酸转运情况.将马铃薯叶中的氢离子氨基酸共转运蛋白基因 StAAP1反义表达抑制后,与对照相比,转基因马铃薯的块茎中除天冬氨酸外的所有氨基酸含量均有所下降,导致马铃薯块茎中氨基酸含量下降约50%,,从而致使总氮含量减少了 10%~15%,,但是由于 C/N比例的升高,淀粉含量并没有受到影响,更有趣的是对植物的光合作用和产量没有大的影响,这些均表明 StAAP1在氨基酸的长距离运输中起到了非常重要的作用[13].
马铃薯微型薯具有体积小、诱导周期短、生产不受季节限制、易储藏、可用于优良种质的保存等明显优势.生物信息学分析表明,马铃薯氨基酸转运蛋白StAAP1 与拟南芥氨基酸转运蛋白 AtAAP6同源性最高[13].但AtAAP6基因在马铃薯中的遗传转化未见报道.而且马铃薯(Solanum tuberosum)是世界第3大粮食作物和最重要的非禾本科作物.其块茎营养丰富全面,含有人体必需的全部 7大类营养物质,随着加工业的迅速发展和人们对食物营养的重视,迫切需要选育出更抗病、更耐逆、更高产、更优质和专用的马铃薯新品种[14].基于以上研究基础,笔者从拟南芥中克隆了 AtAAP6基因,构建了能过表达 AtAAP6基因的植物表达载体 pCAMBIA2300-AtAAP6,利用农杆菌介导的遗传转化方法转化马铃薯[15],得到转基因马铃薯植株,接着利用马铃薯微型薯诱导方法[16],成功获得了转基因马铃薯微型薯.这些工作均为进一步阐明拟南芥氨基酸透性酶基因(AtAAP6)的功能,提高马铃薯块茎中的氨基酸以及贮藏蛋白的含量等提供了研究基础.
1 材料与方法
1.1 实验材料
实验材料:拟南芥为哥伦比亚生态型(Arabidopsis thaliana L.,col-0),马铃薯为“早大白”品种.大肠杆菌菌株 DH5α用于载体构建和分子克隆操作,根癌农杆菌(Agrobacterium tumefaciens)菌株 EHA105为本实验室保存,克隆载体pMD19-T购自 TaKaRa生物工程公司(中国,大连).pCAMBIA2300质粒由本实验室保存.Taq DNA聚合酶、质粒提取试剂盒、DNA回收试剂盒为TIANGEN 公司(中国,北京)产品.各种限制性内切酶、RNAase、T4 连接酶均为New England Biolabs公司产品.不同种类抗生素均购自天津市天大天福生物技术有限公司.
1.2 实验方法
1.2.1 总RNA的提取
取拟南芥幼苗约 100,mg,放入液氮速冻后,快速、充分研磨成细粉末状,用 TRIZOL法提取拟南芥总 RNA[17],-80,℃保存备用.
1.2.2 第一链cDNA的合成
用 cDNA一链合成试剂盒(Promega)合成各个样品 RNA的第一链 cDNA,操作均按试剂盒说明书进行.之后置于-20,℃ 冰箱保存反转录得到的cDNA.
1.2.3 AtAAP6基因的克隆
根据 Primer5.0 设计引物(AtAAP6-F/R)进行RT-PCR,上游引物带有 XhoI酶切位点,下游引物带有XbaI酶切位点.
AtAAP6-F:
GCCTCGAGATGGAGAAGAAGAAGAGCATGT
AtAAP6-R:
GCTCTAGACTAAGGAGCCTGGAAAGGCTTG
取 1,μL一链产物为模板进行 PCR 扩增,25,μL体系中包括:10×PCR 缓冲液,0.2,mmol/L dNTPs,1.5,mmol/L MgCl2,上、下游引物各 0.2,μmol/L,1,U Taq DNA聚合酶(Promega).PCR反应的条件为94,℃预变性 5,min;94,℃ 30,s,58,℃ 30,s,72,℃1.5,min,32个循环;72,℃延伸 10,min.利用 1%, 的琼脂糖凝胶对 PCR产物进行电泳检测,将目的片段进行回收,并连接到pMD19-T载体,经XhoI/XbaI进行双酶切鉴定后,挑取阳性克隆进行测序.
1.2.4 pCAMBIA2300-AtAAP6植物表达载体的构建
选择测序正确的阳性克隆,扩大培养,利用TIANGEN质粒提取试剂从大肠杆菌中进行质粒提取.用 XhoI/XbaI对 pMD19-T-AtAAP6质粒和植物表达载体 pCAMBIA2300质粒分别进行双酶切.酶切 体 系 为 20,μL ,质 粒 10,μL ,XhoⅠ1,μL ,XbaⅠ1,μL,10×Buffer 2,μL,ddH2O 6,μL,置于 37,℃条件下酶切反应 1,h,1%,琼脂糖凝胶进行电泳检测,回收目的基因片段和载体片段.将 AtAAP6 基因片段与载体片段在 T4 连接酶作用下,16,℃ 过夜连接(连接体系为 10,μL,包括 10×T4,DNA Buffer 1,μL,T4,DNA 连接酶 1,μL,pCAMBIA2300 载体片段5,μL,AtAAP6 基因片段 3,μL).热激转化大肠杆菌DH5α,筛选阳性重组质粒,并进行酶切验证,植物表达载体示意见图1.
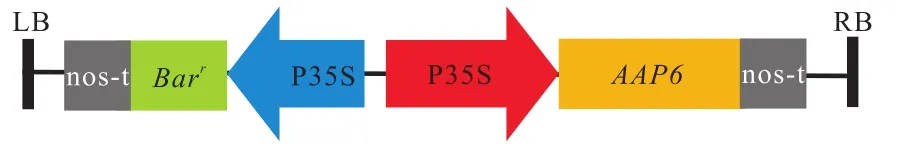
图1 T-DNA区的载体图谱示意Fig.1 Schematic representations of the T-DNA regions of transformation vector
1.2.5 马铃薯遗传转化
(1) 农杆菌菌体活化
将含目的基因的农杆菌加入到 LB液体培养基中,28,℃ 活化培养48,h.转化当天按1∶100的比例接入三角瓶中 LB液体培养基,扩大培养至 OD600=0.6.
选生长发育良好的无菌马铃薯苗,切取大小约为0.5,mm×0.5,mm 的叶盘作为转化外植体.将扩大培养的农杆菌转入 50,mL灭菌离心管中,常温下6,000,r/min离心沉淀菌体.用等体积侵染培养基悬浮沉淀的菌体.将切好的叶盘加入到重悬的菌液中,轻轻振荡侵染 15,min.倒掉菌液,用灭过菌的双蒸水冲洗叶盘(2~3次),再用灭过菌的滤纸将叶盘表面多余的菌液尽量吸干,接着在共培养基(MS+蔗糖3%+6-BA 2.0,mg/L+NAA 0.2,mg/L+琼脂0.7%,)上表面铺一层灭过菌的滤纸,然后将叶盘接到该培养基上,置于 28,℃的条件下,进行暗培养,培养时间为2,d.暗培养结束后,将叶盘接种到愈伤诱导筛选培养基(MS+蔗糖3%+6-BA 2.0,mg/L+NAA 0.2,mg/L+头孢霉素 500,mg/L+Basta 0.7,mg/L+琼脂 0.7%,)中,在25,℃、16,h光照/8,h黑暗的光周期培养条件下进行筛选培养.每两到三周更换一次培养基.将筛选得到的愈伤组织转接至芽诱导筛选培养基(MS+蔗糖 3%+6-BA 2.0,mg/L+ZT 2.0,mg/L+头孢霉素500,mg/L+Basta 0.7,mg/L+琼脂 0.7%,)中进行筛选培养.将生长至 2,cm左右的幼芽接种到生根培养基(MS+蔗糖 3%,+矮壮素 500,mg/L+头孢霉素500,mg/L+Basta 0.7,mg/L+琼脂 0.7%,)中,在 25,℃、16,h光照/8,h黑暗的光周期培养条件下进行生根筛选培养.
1.2.6 马铃薯转基因阳性植株的分子检测
经过遗传转化过程得到的含有抗生素抗性马铃薯植株,采用改进的 CTAB法提取有抗性的马铃薯苗的 DNA[17-18].利用 PCR方法检测基因组中AtAAP6基因.利用目的基因特异引物(AtAAP6-F/R)进行 PCR扩增检测.基因扩增程序为:94,℃ 5,min;94,℃ 30,s;58,℃ 30,s;72,℃ 1.5,min;32 个循环;72,℃ 延伸 10,min.
然后进行RT-PCR检测,确定目的基因在马铃薯中是否表达.取1,μL cDNA为模板进行PCR扩增,25,μL体系中包括:10×PCR 缓冲液,0.2,mmol/L dNTPs,1.5,mmol/L MgCl2,上、下游引物各 0.2,μmol/L,1,U Taq DNA聚合酶(Promega).PCR反应的条件为 94,℃ 预变性 5,min;94,℃ 30,s,58,℃ 30,s,72,℃1.5,min,32个循环;72,℃延伸 10,min.PCR 产物用1%,的琼脂糖凝胶进行电泳检测.
1.2.7 转基因马铃薯的微型薯诱导
将马铃薯无菌苗在含有 0.4,mg/L B9 的 MS培养基中进行复壮培养,20,d后,选取生长健壮的无菌马铃薯苗,切成含 2~3 个腋芽的茎段.置于微型薯诱导培养基中,培养基配方为:MS+蔗糖 8%,+香豆素 9,mg/L+IBA 0.1,mg/L+NAA 0.1,mg/L+活性炭0.15%,+琼脂粉 0.7%,.暗培养条件下,4,d左右后试管苗腋芽处膨大,13,d左右开始有试管薯形成.
2 结果与分析
2.1 拟南芥总RNA的提取
利用 TRIZOL法提取得到拟南芥幼苗的总RNA,用 1%,的琼脂糖凝胶进行电泳检测,3条条带清晰,如图2所示,从上到下依次为 28,SRNA、18,SRNA、5,SRNA,电泳结果表明总 RNA 完整性较好,纯度较高,可用于后续反转录实验.
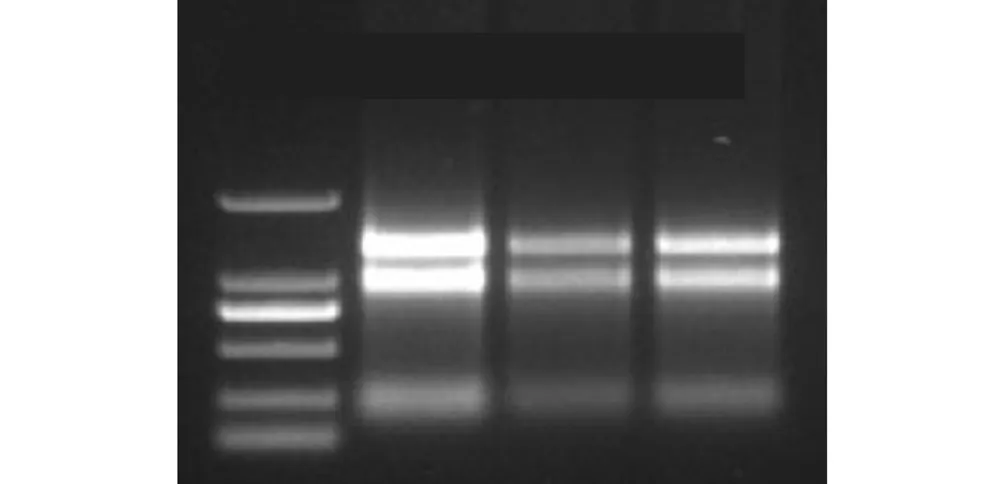
图2 野生型拟南芥总RNA的提取Fig.2 Total RNA extraction for wild-type Arabidopsis thaliana
2.2 拟南芥AAP6基因的克隆及序列分析
将提取的拟南芥总 RNA进行反转录得到cDNA,以 cDNA 作为模板,用 AtAAP6 基因特异性引物(AtAAP6-F/R)进行 RT-PCR检测,电泳检测得到一条约为 1.5,kb的目的DNA条带,如图3所示,1~3 是以cDNA为模板扩增目的基因,其中4是以水为模板进行扩增作为阴性对照,1、3均扩增出目的条带,2扩增得到目的大小条带与GenBank公布的目的片段大小一致.
拔出套管后,下钢管至基岩面上0.5 m处注入水泥黏土浆液,水泥比重占20%,第一次将钢管下至基岩面,注入黏土水泥浆,将孔内清水顶出,直到孔口回浆为止,停20 min,孔内浆面下降,第二次注浆,孔口溢出稠浆直至浆面不下降、孔口填满为止。

图3 以cDNA为模板扩增AtAAP6基因Fig.3 PCR amplification for AtAAP6 gene using cDNA as template
将 PCR产物进行凝胶回收,回收后的产物连接到 pMD19-T载体,热激转化大肠杆菌,进行质粒的提取,得到质粒 pMD19-T-AtAAP6.由图4 可见,经过质粒双酶切验证,分别获得了2.7,kb的载体片段和大约 1.5,kb的目的基因片段.双酶切检测结果显示,已经成功克隆得到AtAAP6 基因.
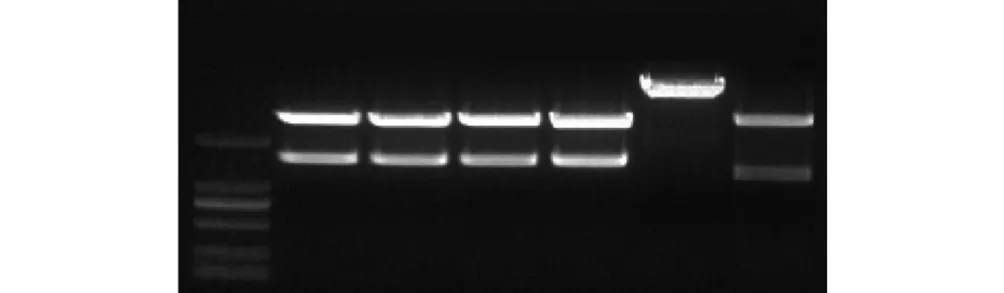
图4 重组质粒pMD19-T-AtAAP6的双酶切验证Fig.4 Double enzyme digestion identification of recombinant plasmid pMD19-T-AtAAP6
将克隆后的基因片段送至公司进行测序验证,测序结果显示,将克隆得到的基因序列与 GenBank中公布的已知序列进行比对,如图5 所示.比对结果表明,笔者从拟南芥中克隆的 AAP6 基因与 GenBank中发表的 AtAAP6基因(GenBank登录号:NM_124341.4)核苷酸序列同源性达到 99.93%,,氨基酸序列同源性为 100%,,这表明拟南芥 AtAAP6 基因全长克隆成功,由图5可见,该基因共编码 481 个氨基酸,蛋白大小约为 5.3×104,g/mol.

图5 AtAAP6基因测序的DNA序列Fig.5 DNA sequencing of AtAAP6 gene
2.3 拟南芥AtAAP6基因的植物表达载体构建
用XhoI/XbaI对pMD19-T-AtAAP6 质粒和植物表达载体 pCAMBIA2300质粒分别进行双酶切.将目的基因片段和 pCAMBIA2300载体大片段进行回收,然后连接,获得新的植物表达载体,将改造后的载体命名 pCAMBIA2300-AtAAP6.然后转化大肠杆菌后进行质粒提取,并将质粒进行酶切验证,如图 6所示,图 6中 1~5为重组质粒酶切验证.经过双酶切验证,获得了约为 1.5,kb大小的目的基因片段.通过测序分析验证,结果与 AtAAP6测序结果完全相同.证明pCAMBIA2300-AtAAP6植物表达载体已构建成功.
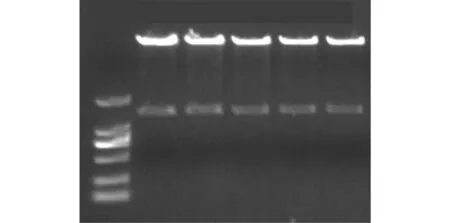
图6 重组质粒pCAMBIA2300-AtAAP6 的双酶切验证Fig.6 Double enzyme digestion identification of recombinant plasmid pCAMBIA2300-AtAAP6
2.4 植物表达载体pCAMBIA2300-AAP6转化农杆菌
将构建成功的 pCAMBIA2300-AtAAP6重组质粒转化农杆菌,用于后续的马铃薯遗传转化.重组质粒转化农杆菌后,挑取单克隆进行目的基因 PCR检测.如图 7所示,1~12是以挑取的单克隆为模板进行的PCR检测,得到了1,446,bP大小的条带,P作为阳性对照,是以 pCAMBIA2300-AtAAP6 质粒为模板进行的 PCR,H2O是以水作为模板进行的PCR检测,作为阴性对照.电泳结果显示,以挑取的单克隆为模板进行 PCR,得到的条带大小与阳性对照一致,说明新构建的植物表达载体已经成功转化到农杆菌中,选取阳性克隆进行扩大培养,保存菌种,用于后续的马铃薯遗传转化.
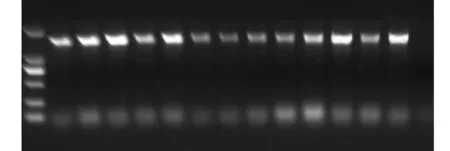
图7 农杆菌菌落PCR检测Fig.7 PCR detection for Agrobacterium colony
2.5 转基因马铃薯植株的获得及分子检测
选生长发育良好的无菌马铃薯苗,取大小约0.5,mm×0.5,mm 的叶盘进行农杆菌侵染,吸干其表面的菌液,并置于共培养基上暗培养 2,d.暗培养结束后,将叶盘接种到愈伤诱导筛选培养基中,在 25,℃、16,h光照/8,h黑暗的光周期培养条件下进行筛选培养.每两到三周更换一次培养基.将筛选得到的愈伤组织转接至芽诱导筛选培养基中进行筛选培养,得到了抗性芽,如图 8(a)所示.将生长大小为 2,cm 左右的幼芽接种到生根培养基中,在 25,℃、16,h光照/8,h黑暗的光周期培养条件下进行生根筛选培养.成功得到了含有抗生素抗性马铃薯植株,如图 8(b)所示.

图8 转AtAAP6基因的马铃薯除草剂抗性苗的再生Fig.8 Solanum tuberosum herbicide resistant plants containing AtAAP6
采用 CTAB法提取有抗生素抗性的马铃薯苗的DNA.根据目的基因引物(AtAAP6-F/R)进行PCR检测.如图 9所示,1~21是提取不同马铃薯抗性植株的 DNA为模板进行的检测,WT是非转基因马铃薯阴性对照,P是以质粒为模板的阳性对照,H2O是以水为模板的阴性对照,由电泳图可以看出,在检测的21个不同马铃薯株系中,有14个株系中检测到了目的条带,说明目的基因 AtAAP6已成功插入到马铃薯基因组中,成功获得了转基因阳性马铃薯植株.
为验证 PCR检测为阳性的转基因马铃薯中AtAAP6 基因的转录水平,挑选10个株系,重新编号(1~10),利用 AtAAP6 基因的特异引物 AtAAP6-F/R,以马铃薯的看家基因Stactin作为内参基因,进行RT-PCR检测,分析目的基因AtAAP6 在转基因马铃薯中的表达情况.如图10所示,AtAAP6 基因在转基因马铃薯植株中都有一定量的转录表达,并且各个株系的表达量也不同.其中 2、3、4、5、6、9 表达量较高,1和10表达量较低,7 和8 表达量中等.上述结果表明,AtAAP6 基因在转基因马铃薯中进行了正常的转录表达.
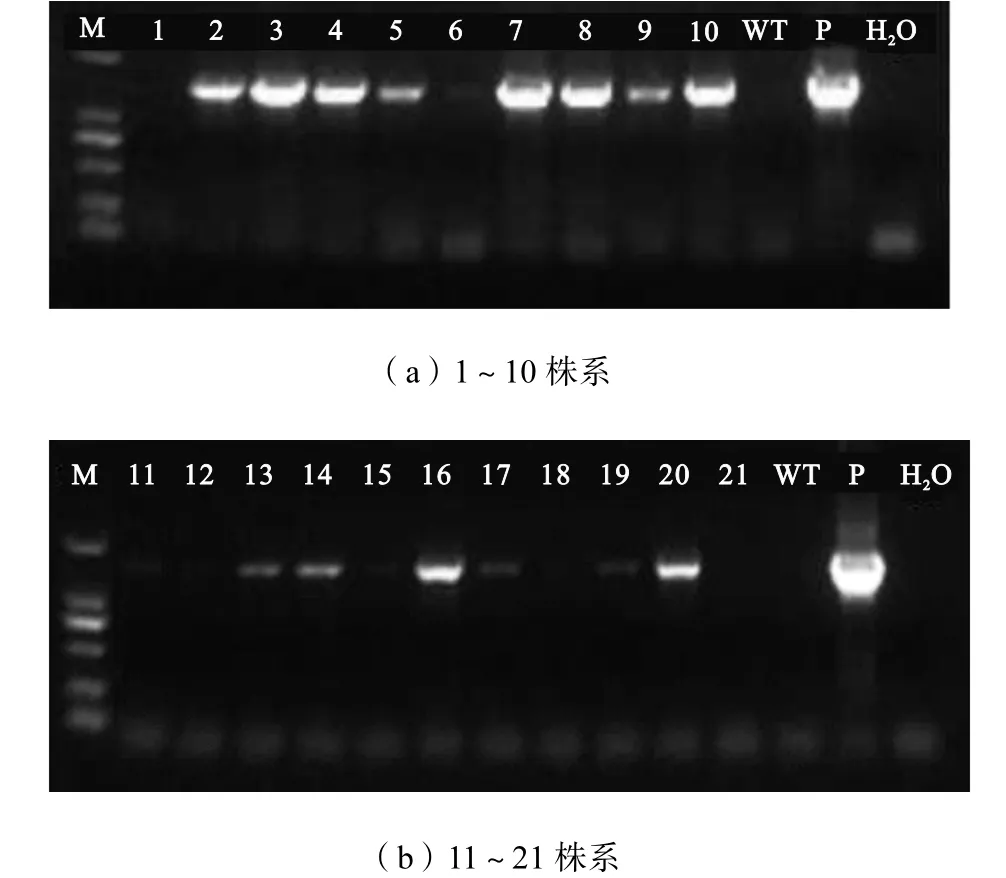
图9 AtAAP6基因转化马铃薯抗性苗的PCR检测Fig.9 PCR screening for AtAAP6 resistant transgenic Solanum plants
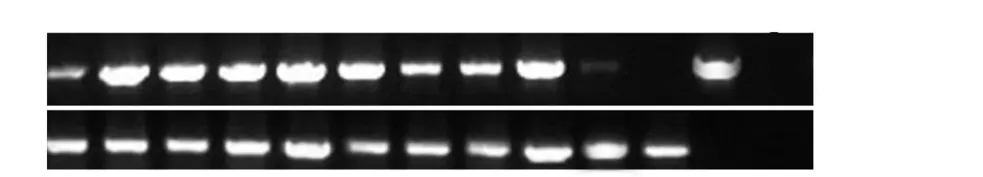
图10 转基因马铃薯植株的RT-PCR分析Fig.10 RT-PCR analysis of AtAAP6 transgenic Solanum plants
2.6 转基因马铃薯的微型薯获得
选取生长健壮的马铃薯无菌苗,切成带有 2~3个腋芽的茎段,置于微型薯诱导培养基中进行微型薯的诱导.20,℃ 暗培养条件进行培养,4,d后观察发现,无菌苗腋芽处开始出现膨大现象,13,d后开始形成微型薯,培养30,d后,得到生长较好的马铃薯微型薯(见图11).
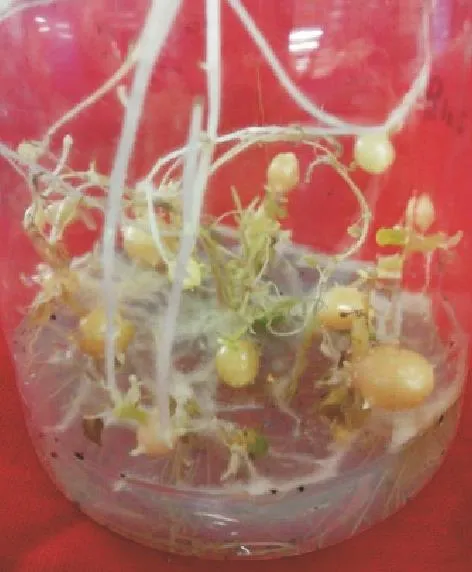
图11 马铃薯微型薯Fig.11 Micro potato
3 讨 论
植物体内存在各种各样的氨基酸,氨基酸作为植物体内重要的有机氮化合物,在植物的生长代谢过程中起着不可替代的作用,氨基酸转运蛋白在植物体内或细胞间氨基酸的转运过程中扮演极其重要的角色,对于植物体内氮素的代谢有着非常重要的作用[19].
崔喜艳等[20]从拟南芥中克隆得到拟南芥氨基酸透性酶 1基因(AtAAP1),并成功构建了植物表达载体与 pCAMBIA3300-AAP1,为在植物体内过表达AtAAP1 基因,为增加作物体内氨基酸的含量,从而提高作物中氮素的利用效率提供研究基础.
近年来,氨基酸转运蛋白逐渐成为农作物改良的目标载体.研究发现,在豌豆和蚕豆植株子叶薄壁细胞中利用过表达 AAP型转运蛋白(VfAAP1)的方法来增加胚中氨基酸的供应,从而增加了蛋白含量[21].水稻中的 OsAAP6 主要是在根、叶和发育中的种子表达,对OsAAP6 过表达或抑制表达都证明,该基因对籽粒蛋白含量存在正调节作用[22].
另外,有研究报道,在马铃薯中,StAAP1 在氨基酸从“源”器官到“库”器官的转运过程中受到诱导表达,而且在转基因植株体内,随着 StAAP1 表达量的下降,氨基酸的含量下降至少 50%,.同时,生物信息学分析表明,马铃薯氨基酸转运蛋白 StAAP1与拟南芥氨基酸转运蛋白 AtAAP6同源性最高[13].基于以上研究,笔者选用 AtAAP6为目标基因,利用农杆菌介导的遗传转化方法将 AtAAP6基因成功导入马铃薯植株中进行过表达,成功获得了转 AtAAP6基因的马铃薯阳性转基因植株.利用RT-PCR进行转录水平的检测,发现AtAAP6 基因在各个株系都有表达,说明AtAAP6 基因在转基因马铃薯中进行了正常的转录表达,但是不同株系表达量不同,这也为AtAAP6 基因表达水平对植株中氨基酸转运的影响提供了研究基础.
马铃薯微型薯具有体积小、重量轻、生产不受季节限制、易储藏、诱导周期短、繁殖速度高于常规田间生产、栽培成活率高等突出优点,常用于优良种质的保存,微型薯还在当今马铃薯基因工程研究中作为基因转移的受体,另外,它也被用来进行快速繁殖,作为种薯生产的一部分[23].所以笔者利用植物生长调节物质诱导得到转AtAAP6 基因的马铃薯微型薯,为马铃薯的遗传转化,提高马铃薯块茎中的氨基酸以及贮藏蛋白含量,进一步研究AtAAP6转运蛋白在植物氨基酸代谢调控中的功能提供了研究基础,同时也为更快更好地选育出优质马铃薯新品种,进行高蛋白作物新种质的创制提供了遗传资源.
氨基酸转运蛋白还有其他一些重要的功能.比如,有一些氨基酸转运蛋白被认为在病原体(特别是线虫)取食活的植物组织时扮演着重要的角色.研究表明,AtAAP3 基因和 AtAAP6 基因突变体植株能维持根结线虫生长率低于野生型[24].这表明 AtAAP6基因在植物抵御病原体侵害方面也扮演着重要的角色.线虫等病原体对马铃薯根茎危害极大,并可以脱离寄主在土壤中长期存留,致使防治难度大大增加,通过在马铃薯中过表达AtAAP6 基因,不仅可以更深入地研究 AtAAP6 基因在植物抵御外界病原体过程中的分子机制,而且为选育抗病马铃薯新品种提供了研究基础.随着分子生物学技术的快速发展,在植物中将会分离、克隆得到更多的氨基酸转运蛋白基因,并逐渐研究解析它们在植物体内的生物学功能,以应用于粮食作物的遗传改良工作中.
4 结 语
本研究从拟南芥中成功克隆了 AtAAP6基因,并构建 AtAAP6基因的植物表达载体,命名为pCAMBIA2300-AtAAP6,通过农杆菌介导的遗传转化方法将 AtAAP6基因导入马铃薯植株中,成功得到了过表达 AtAAP6基因的马铃薯植株及马铃薯微型薯,为深入阐明拟南芥氨基酸透性酶基因(AtAAP6)的功能提供了理论依据,同时也为进一步提高马铃薯块茎中的氨基酸以及贮藏蛋白的含量等提供了研究基础.
