DEHP和MEHP对H295R细胞类固醇激素合成基因表达的影响
2018-08-01叶婷董四君王佳杨丹杨文佳李灿
叶婷,董四君,王佳,杨丹,杨文佳,李灿,*
1. 贵阳学院生物与环境工程学院 贵州省山地珍稀动物与经济昆虫重点实验室,贵阳 550005 2. 中国科学院城市环境研究所 中国科学院城市环境与健康重点实验室,厦门 361021 3. 泰山医学院公共卫生学院,泰安 271016
邻苯二甲酸二(2-乙基己基)酯(di-(2-ethylhexyl)-phthalate, DEHP)作为增塑剂普遍用于聚氯乙烯(poly vinyl chloride, PVC)材料中,如地板、电缆和房屋装饰材料等建筑材料,还普遍用于血袋、血管和透析仪等医疗器械[1]。DEHP与聚氯乙烯材料不是以化学键结合,而是以普通的分子间作用力结合,所以容易从塑料材料中释放进入环境中[2],然后通过食物链在生物体内富集,引起神经、免疫、肝脏、生殖等毒性作用[3-4]。人体通过食品摄入、呼吸空气、饮用水、皮肤吸收及静脉注射等多种途径暴露于DEHP[5-7],其中摄入被DEHP污染的食品是暴露DEHP的主要途径,人体内超过90%的DEHP来自食品摄入[8]。DEHP进入机体后,一部分以原型直接被吸收,另一部分受胰腺酶和肠道内一些酶的作用,迅速由双酯转化为单酯,主要代谢产物是邻苯二甲酸单(2-乙基己基)酯(mono-(2-ethylhexyl)phthalate, MEHP)[9]。很多哺乳动物研究显示DEHP的代谢产物MEHP的毒性效应强于DEHP,并且DEHP产生的毒性效应主要是由其代谢产物引起的[10]。许多动物研究表明DEHP和MEHP影响了类固醇合成活性[3-4],但对其机制缺乏系统的认识。目前大多数关于DHEP和MEHP的研究局限于体内研究,而且关于DEHP和MEHP对类固醇激素合成的影响,还没有相关体外研究进行全面的评价。Harvey等[11]提出了H295R细胞系类固醇合成干扰实验可作为评价化学物对类固醇激素生成过程干扰的策略,并指出H295R细胞系是一种有效的体外筛选环境类固醇激素干扰物的细胞模型。美国国家环境保护署也正在建立利用H295R细胞系检测环境污染物对类固醇激素生成干扰效应的方法来研究环境中污染物的内分泌干扰效应[12]。相对基于组织评价类固醇激素干扰的方法,H295R细胞评价的优势还在于它能评价环境中的污染物对细胞活力和细胞毒性的影响,这是一个重要的特征,以区别化学物是通过直接的细胞毒性作用还是间接的生成类固醇通路的影响产生效应,这点是体外培养的多细胞组织方法不能做到的。并且H295R细胞容易获得、培养简单并可稳定传代,可有效代替动物和组织实验方法,简单且经济。因此H295R细胞系成为体外筛选环境类固醇激素干扰物及研究其机制的最具潜力的工具,能同时从基因表达、酶活力和激素水平几个层面进行检测[13]。
本研究采用H295R细胞模型类固醇激素合成干扰试验,从细胞活力、类固醇激素合成关键基因表达、关键调控因子和关键受体的基因表达等方面,对DEHP及其主要代谢产物MEHP的类固醇激素合成干扰效应进行分子机制层面的研究。
1 材料与方法(Materials and methods)
1.1 实验材料
人肾上腺皮质腺癌细胞H295R细胞系购自国家实验细胞资源共享平台。细胞培养:H295R细胞系常规培养于37 ℃、5%CO2恒温培养箱中。细胞培养采用DMEM/F12(1∶1)培养基,培养基中需添加成分包括2.5% Nu-Serum I,15 mmol·L-1HEPES,0.00625 mg·mL-1insulin+0.00625 mg·mL-1transferrin+6.25 ng·mL-1selenium+1.25 mg·mL-1bovine serum albumin+0.00535 mg·mL-1linoleic acid。2~3 d更换一次培养液,待细胞单层生长至80%~95%后,用PBS溶液轻洗2次,加入适量0.05%胰酶-EDTA溶液消化2 min,800~1 000 r·min-1离心5 min后弃上清液,加入培养基重悬细胞,按照1∶3比例传代。
1.2 仪器与试剂
仪器:CO2细胞恒温培养箱(日本SANYO公司);Spectra Max M5多功能酶标仪(美国Molecular Devices公司);HR40-IIA2超净工作台(中国Haier公司);UNIVERSAL 320R台式(常温/低温)离心机(德国Hettich Zentrifugen公司);ND1000超微量紫外可见分光光度计(美国Gene Companey Limited公司);Mastercycler®personal PCR仪(德国EPPENDORF公司),Lightcycler 480实时荧光定量PCR仪(瑞士Roche公司);生物显微镜(上海长方光学仪器有限公司,中国);Cascada I超纯净水系统(美国Cascada公司);HS-840-U无菌工作台(中国苏州安泰空气技术有限公司);细胞培养瓶、培养板(丹麦NUNC公司)。
试剂:DEHP,优级纯,购于美国Supelco公司,溶于二甲基亚砜(DMSO,优级纯,美国Sigma-Aldrich公司),浓度为1 g·mL-1,将母液用DMSO稀释至0.001 g·mL-1备用;MEHP,优级纯,购于美国AccuStandard公司。将MEHP用DMSO配成0.001 g·mL-1母液备用;DMEM/F12(1∶1)(美国,HyClone公司);胎牛血清(美国,Life Technologies公司);0.05%胰酶EDTA溶液(美国,Life Technologies公司);Hepes(美国,Sigma公司);Nu Serum I(美国,BD Biosciences公司);MTT(美国,Sigma公司);ITS+Premix A(美国,Life Technologies公司);RNA提取试剂盒(美国,Omega生物技术公司);反转录试剂盒(PrimeScriptTM RT-PCR Kit,宝生物工程(大连)有限公司);SYBR Premix Ex TaqTM试剂盒(宝生物工程(大连)有限公司)。
1.3 MTT实验
MTT法检测细胞活力的实验原理是活细胞线粒体中存在的琥珀酸脱氢酶可以使黄色的MTT还原为不溶性的蓝紫色结晶化合物甲瓒(formazan)沉积于细胞内,而死细胞中此酶消失,MTT不能被还原。在一定细胞数范围内,甲瓒形成的量与活细胞数目成正比。二甲基亚砜(DMSO)溶解细胞中的甲瓒后,用酶标仪检测490 nm波长处的吸收值,从而间接反映活细胞数量。MTT法检测细胞活力具体的实验步骤为:用胰酶-EDTA溶液消化对数期H295R细胞并收集计数,然后调整细胞悬液浓度,每孔加入100 μL细胞悬液,细胞接种密度根据细胞生长速度调整约为1×103~1×105个细胞/孔,边缘孔用无菌PBS填充,5% CO2、37 ℃培养24 h。随后,弃去培养基,DEHP和MEHP母液用DMSO和培养基稀释,调节各孔DMSO含量为0.1%,加入用新培养基稀释的不同浓度的DEHP和MEHP(0、1、10、100、1 000 μmol·L-1)在5%CO2、37 ℃继续培养24 h,接着,每孔加入10 μL MTT溶液(5 mg·mL-1,即0.5% MTT),继续培养4 h。小心吸去孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。在酶标仪OD 490 nm或者550 nm处测量各孔的吸光值。同时设置调零孔(含有培养基、MTT和DMSO),对照孔(含有细胞、培养液、MTT、DMSO)。细胞存活率%=[(染毒孔OD-调零孔OD)/(对照孔OD-调零孔OD)]×100%。
1.4 RT-PCR分析H295R细胞基因表达变化
将H295R细胞接种到6孔板中,每孔2 mL,在37 ℃、5%CO2培养箱内培养24 h后,除去旧培养基,用新鲜的培养基将DEHP和MEHP配制成以下浓度:0、1、10、100 μmol·L-1染毒,继续培养24 h。接着,除去培养液,用PBS洗2次,细胞染毒后总RNA的提取采用Omega RNA提取试剂盒,流程按照说明书进行,稍加改动,改动如下:染毒后的细胞,增加了消化步骤以获得更多的细胞,然后每孔加入1 mL RNA-Solv Reagent,用枪头反复吹打,使细胞充分裂解;为了使得细胞充分裂解,低温冰上孵育较长时间(10 min左右)。提取后采用分光光度法鉴定RNA质量,测定RNA浓度,采用反转录试剂盒进行反转录,获得cDNA。用SYBR Premix Ex TaqTM试剂盒在罗氏480仪器上进行荧光定量PCR反应。用于荧光定量PCR的引物序列见表1。以GAPDH为内参基因,采用2-ΔΔCT方法分析各染毒组mRNA水平相对于对照组的变化倍数[14]。

图1 邻苯二甲酸二(2-乙基己基)酯(DEHP)和邻苯二甲酸单(2-乙基己基)酯(MEHP)对H295R细胞活性的影响注:数值以Mean±SEM (n=6)表示;与对照相比,* P<0.05,** P<0.01。Fig. 1 Effects of di-(2-ethylhexyl)-phthalate (DEHP) and mono (2-ethylhexyl) phthalate (MEHP) on cell viability of H295R cellsNote: the representative data are expressed as the mean±SEM, n=6 for each replicate. *P < 0.05, **P < 0.01 vs. control.
1.5 数据统计分析
所有实验数据采用平均值±标准误差表示。并进行方差齐性检验和正态性检验,如有必要需进行对数转换。采用SPSS16.0软件进行单因素方差分析(One-Way AVONA)和Turkey’s检验。置信水平P<0.05时差异显著。
2 结果(Results)
2.1 DEHP和MEHP对H295R细胞活力的影响
为了检测DEHP和MEHP对H295R细胞的毒性,同时为了确定类固醇合成实验的处理剂量,本研究采用MTT法对细胞的活性进行分析。如图1所示,用DEHP处理H295R细胞24 h后,同对照相比,10和100 μmol·L-1DEHP使细胞活性略有下降,但差异未达到统计学意义;1 000 μmol·L-1DEHP使细胞活力显著降低(P<0.05)(图1)。MEHP处理H295R细胞24 h后,同对照相比,10和100 μmol·L-1MEHP使细胞活性略有下降,但差异未达到统计学意义;1 000 μmol·L-1MEHP使细胞活力显著降低(P<0.01)(图1)。为了检测类固醇合成相关基因表达的改变,DEHP和MEHP的处理剂量应保持低于对细胞致死效应较强的剂量。因此在H295R类固醇合成实验中选择了0、1、10、100 μmol·L-1DEHP和MEHP。
2.2 DEHP对H295R细胞类固醇激素合成通路的影响
在细胞活力测试中,1 000 μmol·L-1DEHP和MEHP对H295R细胞染毒24 h显著降低H295R细胞活力,对细胞活力影响较强,所以本研究采用了较低的染毒浓度(0、1、10和100 μmol·L-1)对H295R细胞染毒24 h来评估DEHP和MEHP对H295R细胞类固醇合成通路的影响。H295R细胞暴露于DEHP和MEHP(0、1、10、100 μmol·L-1)24 h后,检测细胞类固醇激素合成过程中关键酶基因(CYP11A、CYP11B1、CYP11B2、CYP17、CYP19a、CYP21、17β-HSD1、17β-HSD4、3β-HSD1、3β-HSD2、STAR)和关键调控因子NR5A1基因表达水平的变化。
如图2所示,与对照相比,1、10和100 μmol·L-1DEHP对H295R细胞系染毒24 h后,对编码类固醇合成通路涉及的多种酶CYP11A、CYP21、CYP11B1、CYP17、3β-HSD1、17β-HSD1、17β-HSD4、CYP19a和STAR的基因表达水平无显著影响。Nuclear receptor subfamily 5、group A、member 1 (NR5A1/SF-1)类固醇合成因子是在类固醇合成组织中起到关键作用的核受体,在肾上腺和性腺的功能和发育过程中起到关键的调节作用。DEHP对关键类固醇合成因子NR5A1基因表达水平也无显著影响。然而,1、10和100 μmol·L-1DEHP显著增加醛固酮合成酶CYP11B2的基因表达水平(P<0.01)。10 μmol·L-1DEHP显著上调了3-β羟基类固醇脱氢酶(3β-HSD2)的基因表达水平(P<0.01)。
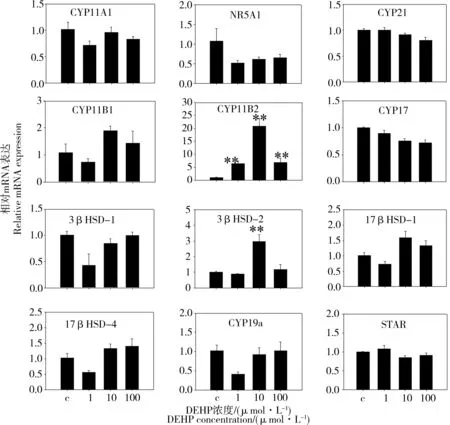
图2 DEHP暴露对H295R细胞类固醇合成通路相关基因表达的影响注:数值以Mean±SEM表示(n=3);与对照组相比,* P<0.05,** P<0.01。Fig. 2 Effects of DEHP on the expression of steroidogenic genes in the H295R cellsNote: the representative data are expressed as the mean±SEM, n=3 for each replicate. *P < 0.05, **P < 0.01 vs. control.
2.3 MEHP对H295R细胞类固醇激素合成通路的影响
如图3所示,与对照相比,1、10和100 μmol·L-1MEHP对H295R细胞系染毒24 h后,对编码类固醇合成通路涉及的多种酶如侧链裂解酶CYP11A、CYP11B1和关键类固醇合成因子NR5A1基因表达水平也无显著影响。然而,与对照相比,1、10和100 μmol·L-1MEHP显著下调了3-β羟基类固醇脱氢酶(3β-HSD1和3β-HSD2)、17β羟基类固醇脱氢酶17β-HSD4、17α羟化酶/17,20裂解酶CYP17和芳香酶CYP19a的基因表达水平。10和100 μmol·L-1MEHP染毒H295R 24 h显著下调了CYP21和STAR的基因表达水平,然而,10和100 μmol·L-1MEHP显著上调了CYP11B2的基因表达水平。100 μmol·L-1MEHP显著下调了17β-HSD1的基因表达水平。基因表达结果显示,DEHP、MEHP都可影响H295R细胞类固醇激素合成过程中关键基因的表达。
3 讨论(Discussion)
本试验研究了DEHP及其主要代谢产物MEHP对H295R细胞类固醇合成过程的影响,主要包括对类固醇激素合成过程中关键酶、关键调控因子和关键受体基因表达的影响,用以评价DEHP和MEHP的类固醇激素合成干扰效应。研究发现,DEHP、MEHP可不同程度地改变类固醇合成过程中关键酶、关键调控因子和受体基因的表达。类固醇激素合成是一个复杂的过程,涉及了许多酶、因子和受体的调控,任一调控点的干扰如编码类固醇合成相关酶的基因表达水平的干扰会引起酶活力的改变,直至激素水平的变化。类固醇合成过程中关键酶、因子和受体基因转录表达的改变可能造成类固醇激素分泌的紊乱,由于基因表达水平的改变相对于其他毒理效应检测指标较灵敏[15],为了揭示DEHP和MEHP对H295R细胞产生类固醇激素合成干扰效应的分子机制,我们选择基因表达水平的改变来评估DEHP和MEHP对H295R细胞类固醇激素合成干扰的影响。H295R细胞在许多研究中已被用于评估一些内分泌干扰化合物改变类固醇合成通路相关基因表达的能力[16]。

图3 MEHP暴露对H295R细胞类固醇合成通路相关基因表达的影响注:数值以Mean±SEM表示(n=3);与对照组相比,* P<0.05,** P<0.01。Fig. 3 Effects of MEHP on the expression of steroidogenic senes in the H295R cellsNote: the representative data are expressed as the mean±SEM, n=3 for each replicate. *P < 0.05, **P < 0.01 vs. control.
3.1 DEHP和MEHP对H295R细胞中类固醇生物合成关键基因表达水平的影响
荧光定量qRT-PCR用于检测DEHP和MEHP调节H295R细胞中类固醇生物合成关键基因表达水平。DEHP显著增加醛固酮合成酶CYP11B2的基因表达水平,对CYP11B1基因表达水平无显著影响。类似地10和100 μmol·L-1MEHP显著上调了CYP11B2的基因表达水平,而MEHP染毒对CYP11B1基因表达水平无显著影响。DEHP和MEHP对CYP11B1和CYP11B2基因在转录水平上产生了不同程度的影响,这可能和CYP11B1和CYP11B2的结构差异和调节通路不同有关系。CYP11B1是一种催化皮质醇生物合成过程的最后步骤线粒体细胞色素酶,CYP11B1和CYP11B2的内含子共享了90%的核酸序列,外显子区域共享了95%的核酸序列,并且CYP11B1在染色体8q上靠近CYP11B2,然而这2个基因的表达定位于肾上腺皮质不同的带状区域[16]。CYP11B1和CYP11B2调节模式的不同还可能是由于CYP11B1和CYP11B2是通过不同通路调节的,CYP11B2是ACTH/cAMP、血管紧张素angiotensin II、类固醇合成因子1(SF-1)结合位点和cAMP响应元素(CRE) 2种元素来调节的[17],然而,CYP11B1的表达是ACTH通过cAMP和蛋白激酶A依赖于cAMP响应结合蛋白家族成员(ATF-2)而非SF-1来激活的[18]。DEHP对3-β羟基类固醇脱氢酶(3β-HSD1)的基因表达水平无显著影响,而10 μmol·L-1DEHP显著上调了3-β羟基类固醇脱氢酶(3β-HSD2)的基因表达水平,3β羟化类固醇脱氢酶(3β-HSD)对包括醛固酮、皮质醇和睾酮在内的所有类固醇激素的生物合成都很重要。3β-HSD1和3β-HSD2是定位于染色体1p13.1的2个基因,编码不同的3β-HSD同功酶[19]。3β-HSD1和3β-HSD2的DNA序列和编码序列之间的内含子部分高度同源[20]。这说明尽管H295R细胞3β-HSD1和3β-HSD2在基因序列和酶的功能具有很大的相似性,但它们的表达调节模式可能不同。然而各MEHP处理组显著下调了H295R细胞3β-HSD1和3β-HSD2基因表达水平。DEHP对H295R细胞芳香化酶CYP19a的基因表达水平无显著影响,而各MEHP处理组显著下调了H295R细胞CYP19a基因表达水平。CYP19a是负责将雄激素转化为雌激素的最后步骤限速酶,最近很多研究提出具有改变CYP19活性能力的化合物具有内分泌干扰效应[21],所以MEHP具有内分泌干扰效应。
DEHP对H295R细胞类固醇激素合成过程中其他的关键酶和调节因子的基因表达水平无显著改变。然而10和100 μmol·L-1MEHP染毒H295R 24 h显著下调了CYP21基因表达水平,CYP21基因产物是在醛固酮和皮质类固醇合成过程中需要的酶,这种酶的缺失可导致不产生皮质醇和醛固酮[22]。并且,各MEHP处理组显著下调了CYP17的基因表达水平,CYP17催化了醛固酮向皮质类固醇底物的转化并最终向性固醇激素底物的转化,MEHP通过抑制CYP17的基因表达可能抑制了性固醇激素底物的合成,一些化合物如酮康唑(ketoconazole)也同时抑制CYP21和CYP17的基因表达水平[23]。17β-HSD是类固醇合成酶的一个相对较大的家族,17β-HSD1催化还原反应,17β-HSD1将雌酮转化为生物学活性更强的17β雌二醇,相反,17β-HSD4是将生物学活性较强的类固醇如雌二醇转换为生物学活性较弱的类固醇如雌酮的氧化酶[24]。100 μmol·L-1MEHP显著抑制17β-HSD1的基因表达水平,可能导致雌酮向雌二醇的转化受到抑制。而各MEHP处理组显著抑制17β-HSD4的基因表达水平,可能抑制雌二醇转换为雌酮。许多化合物如异黄酮等也抑制17β-HSD的表达水平[24]。10和100 μmol·L-1MEHP染毒H295R 24 h显著抑制STAR的基因表达水平,从而可能抑制胆固醇从线粒体外膜向线粒体内膜的转运,从而影响类固醇激素的合成。
3.2 DEHP及MEHP干扰H295R细胞类固醇合成机制的异同点
DEHP和MEHP对类固醇激素合成相关基因表达的影响既有相同之处又有不同之处。在本研究中DEHP和MEHP都显著上调了CYP11B2的基因表达水平,而对CYP11B1基因表达水平无显著影响。DEHP对3-β羟基类固醇脱氢酶(3β-HSD1)的基因表达水平无显著影响,而10 μmol·L-1DEHP显著上调了3-β羟基类固醇脱氢酶(3β-HSD2)的基因表达水平,然而各MEHP处理组显著下调了H295R细胞3β-HSD1和3β-HSD2基因表达水平。DEHP对H295R细胞芳香化酶CYP19a的基因表达水平无显著影响,而各MEHP处理组显著下调了H295R细胞CYP19a基因表达水平。DEHP对H295R细胞类固醇激素合成过程中其他的关键酶和调节因子的基因表达水平无显著改变。而MEHP抑制了STAR、CYP17、CYP19a、3β-HSD1、3β-HSD2、17β-HSD1、17β-HSD4、CYP21基因的表达,所以MEHP可以通过抑制STAR基因的表达,从而将影响类固醇激素合成前体胆固醇在细胞内的转运;并能显著性抑制类固醇激素合成过程中CYP17、CYP19a、3β-HSD1、3β-HSD2、17β-HSD1、17β-HSD4、CYP21基因的表达,最终将抑制H295R细胞中类固醇激素的合成。并且与DEHP相比,MEHP对H295R细胞类固醇激素合成关键基因表达的影响较明显。所以在评价DEHP对H295R细胞类固醇激素合成通路影响时,可选择CYP11B2和3β-HSD2作为分子靶标,而对于评价MEHP对H295R细胞类固醇激素合成通路影响时,可选择STAR、CYP17、CYP19a、3β-HSD1、3β-HSD2、17β-HSD1、17β-HSD4、CYP21基因作为分子靶标。类似地,文献研究显示MEHP暴露囊状卵泡导致类固醇激素合成过程涉及的关键酶CYP19A1、3β-HSD1、STAR、CYP11A1、CYP17A1、17β-HSD1 mRNA水平,最终导致睾酮、雌酮和雌二醇水平下降[25],该研究结果也显示DEHP和MEHP对类固醇激素合成过程的干预模式是不同的。一些文献研究也报道DEHP的毒性效应是由MEHP介导的,体外MEHP暴露抑制了类固醇激素合成[26-27]。体内实验研究显示围产期暴露于DEHP下调了睾丸间质细胞类固醇激素合成相关基因如StAR、Cyp11a1、3β-HSD、17β-HSD和Cyp-19等的表达,从而显著降低血清睾酮和雌二醇水平并导致内分泌干扰生殖毒性效应[28]。然而,也有报道显示体外研究中低剂量DEHP和MEHP(0.001 μmol·L-1和0.1 μmol·L-1)暴露MLTC-1细胞增加了类固醇激素合成相关基因CYP11A1、CYP17和3β-HSD从而刺激了睾酮的分泌[29],这种研究结果的差异可能是由于种属差异导致的。DEHP和MEHP对H295R细胞类固醇激素合成相关基因表达水平影响的差异可能是由于DEHP在H295R细胞内并非完全发生代谢转化为MEHP,H295R细胞体内负责将DEHP转化为MEHP,次级代谢产物的代谢酶如乙醛脱氢酶、酒精脱氢酶和脂蛋白酯酶的水平和活性受到DEHP暴露的影响,DEHP代谢转化为MEHP的转化率以及MEHP进一步代谢转化为其他次级代谢产物的转化率需要进一步的研究,以便解释DEHP和MEHP对类固醇生成相关基因表达影响的差异机制。
对比DEHP和MEHP对H295R细胞类固醇激素合成通路的影响,可知DEHP和MEHP对H295R细胞类固醇激素合成通路相关酶、因子和受体基因表达水平的影响不同,并且与DEHP相比,MEHP对H295R细胞类固醇激素合成关键基因表达的影响较明显。
