单步硝化作用与全程氨氧化微生物研究进展
2018-07-30石秀丽郭萌萌张莹秦华万琪慧谢德体蒋先军
石秀丽,郭萌萌,张莹,秦华,万琪慧,谢德体,蒋先军*
(1.西南大学园艺园林学院,重庆 400715;2.西南大学土壤生物研究中心,重庆 400715;3.西南大学农业研究院,重庆 400715;4.西南大学资源环境学院,重庆 400715)
硝化作用是自然界中连接氧化态无机氮和还原态无机氮的唯一过程,将自然界氮素的最低价态(NH3)转化为最高价态(NO3-),完成了氮素的整个氧化还原循环过程,在维持全球氮素平衡中起着关键作用。硝化作用的最终产物—硝态氮,是植物生长的重要氮源[1]。数十年来人们一直认为硝化作用过程由两个步骤完成:首先由氨氧化细菌(ammonia-oxidizing bacteria, AOB)[2]和/或氨氧化古菌(ammonia-oxidizing archeae, AOA)[3]先将氨氧化成亚硝酸盐,然后再由亚硝酸盐氧化细菌(nitrite-oxidizing bacteria, NOB)[2]将亚硝酸盐氧化成硝酸盐。最近的研究发现属于亚硝酸盐氧化细菌的亚硝化螺菌属(Nitrospira)中的部分种群可以单独完成将氨氧化为硝酸盐,该过程被称为“单步硝化作用”(one-step nitrification)[4-5],而这些微生物则被定义为全程氨氧化微生物(complete ammonia oxidizers, comammox)。只能够将氨氧化为亚硝酸盐的AOA、AOB以及只能氧化亚硝酸盐的NOB则可被称为“半程氨氧化微生物”(incomplete ammonia oxidizers)[4-5]。
单步硝化作用与全程氨氧化微生物的发现引出了大量与硝化作用研究相关的亟待解决的科学问题。首先,由于氨被完全氧化成硝酸盐可以释放出更高的能量,那么在什么情况下comammox对硝化作用的贡献会超过别的硝化微生物?以前对comammox的忽视是否过高估计了“标准”硝化微生物的活动?此外,尤为重要的是要了解全程氨氧化微生物(comammox)与“半程氨氧化微生物”AOA和AOB以及NOB的生态位划分,这对了解环境中的硝化作用具有重大意义。基于此,本研究对全程氨氧化细菌发现以来的研究进展做了回顾,并对该领域今后的研究方向进行展望。
1 概述
目前已确定的全程氨氧化微生物,包括可培养的和不可培养的,均属于硝化螺菌属(Nitrospiraspp.)。硝化螺菌(Nitrospiraspp.)被认为是严格的亚硝酸盐氧化细菌,广泛分布于农业土壤、森林土壤、稻田水域、淡水环境,如湿地、河床、含水层和湖泊沉积物,以及工程系统(活性污泥和饮用水处理厂)中[5-7]。硝化螺菌具有丰富的多样性,至少包含6个经常共存的属,到目前为止已发现的comammoxNitrospira基因组属于硝化螺菌谱系Ⅱ(Nitrospiraspp. Linage Ⅱ)。根据全程氨氧化微生物的氨单加氧酶(ammonium monooxygenase, AMO)的系统发育,comammoxNitrospira谱系Ⅱ,包括两个分支A和B(Clade A和Clade B)。已经分离培养的有3个种,包括Ca.Nitrospira nitrificans,Ca.Nitrospira nitrosa,Ca.Nirospira inopinata (1,2);从全球基因库获得amoA序列分析,如图1所示:全程氨氧化微生物分支A有31个操作分类单元(operational taxonomic unit,OTU),分支B有19个OTU[8]。comammoxNitrospira的两个分支以及其他常规的Nitrospira都可以在环境中与AOB、AOA以及NOB共存。

图1 基于氨单加氧酶基因amoA的全程氨氧化微生物的系统发育树[8]Fig.1 Phylogenetic affiliation tree of comammox amoA genes[8] DWTP Friedrichshof, Germany 德国,弗里德里希豪夫,饮用水处理厂;Rice paddy soil, Vercelli, Italy 意大利,维切利,水稻土;Recirculating aquaculture system biofilter, Radboud University, Netherlands荷兰,拉德堡德大学,再循环水产养殖系统生物过滤器;Beech forest top soil, Klausen-Leopoldsdorf, Austria 奥地利,克劳森-利奥波茨多夫,山毛榉森林表土层;GWW Wolfenbüttel Germany 德国,沃尔芬比特尔,地下水井;DWTP Breehei, Limburg, Netherlands 荷兰,林堡,布里黑,饮用水处理厂;Vialone Nano rice rhizosphere, Vercelli, Italy 意大利,维切利,意大利维阿龙圆米根际;WWTP Lieshout, Lieshout, Netherlands 荷兰,利斯豪特,大型污水处理厂;Lake Herrensee, Seewinkel, Austria 奥地利,塞温克尔,郝伦湖;WWTP Vetmed, Vienna, Austria 奥德利,维也纳,维特梅,大型污水处理厂;WWTP Ingolstadt, Ingolstadt, Germany 德国,英格尔斯塔特,大型污水处理厂;Enrichment culture clone from Schwarzer River, Austria 奥地利,施瓦泽河,富集培养克隆。
2 全程氨氧化微生物对氨具有更高的亲和力
自然环境中,硝化反应的底物-氨分子主要来源于有机氮的分解过程。而在大多数环境里,氨分子浓度极低,因此对氨的竞争是氨氧化微生物(包括comammox, AOA和AOB)复杂的群落演化的一个主要因素[9]。以前的研究结果均认为氨氧化古菌(AOA)对氨的亲和力远远超过氨氧化细菌(AOB),从而在氨浓度很低(亚微摩尔浓度)的环境中对氨的竞争胜过氨氧化细菌(AOB)。例如,生活在海洋中的AOA通过调整细胞机制(包括关键的氨氧化酶-氨单加氧酶)依赖极低的底物浓度(小于10 nmol·L-1)进行生长[10]。据此人们认为陆地生态系统中的AOA,就像它们的海洋亲系一样,对氨具有很高的亲和力,所以可能在低氨浓度下比对氨氧化细菌更具有竞争力。但是由于可培养的AOA并不多,对AOA氨亲和力的测定数据非常少(表1),该结论的普遍性尚需进一步证明。最近Kits等[11]的研究发现,全程氨氧化细菌Nitrospirainopinata比大多数可培养的AOA物种对氨具有更高的亲和力,能够更好地适应极低氨浓度的环境(表1)。
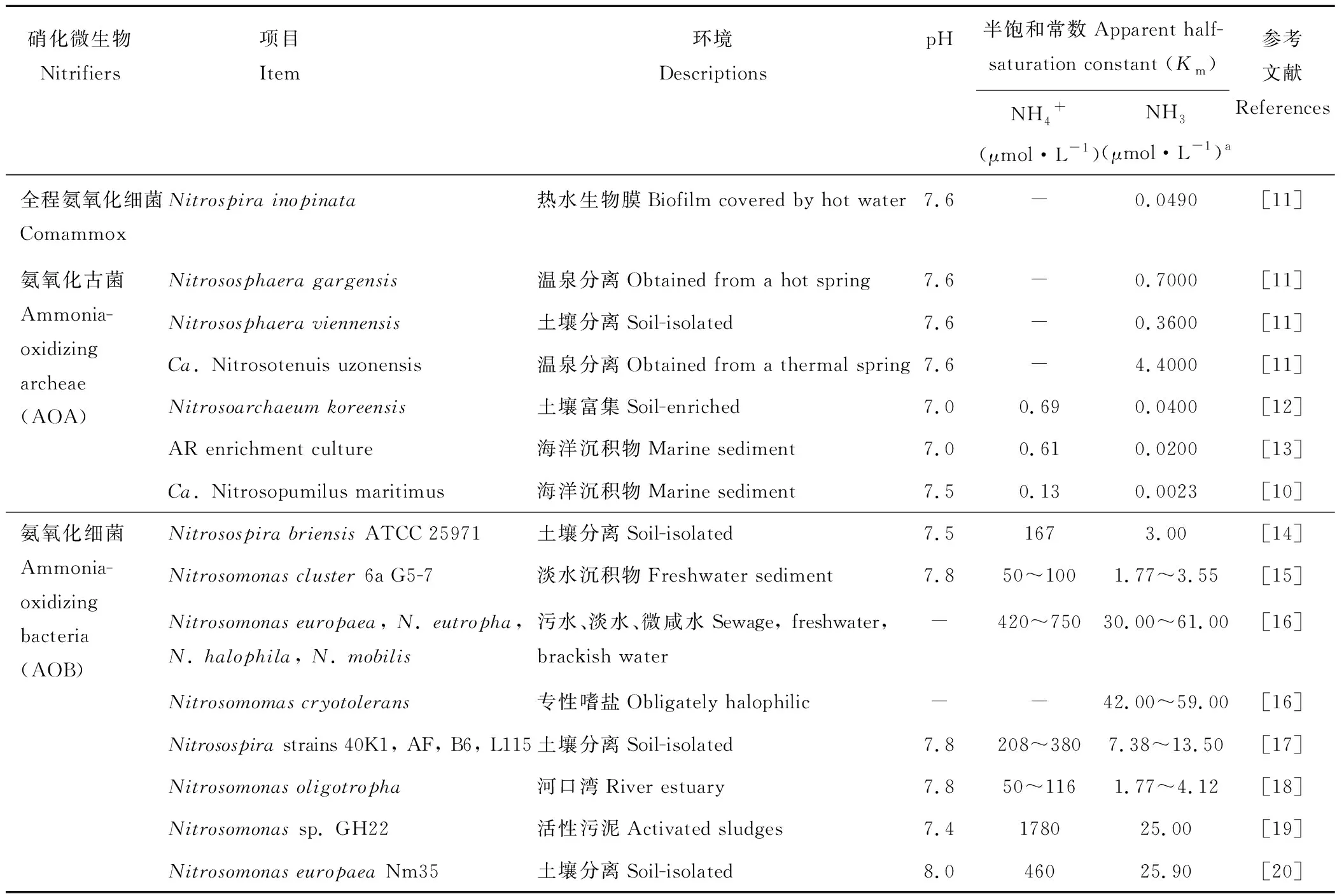
表1 全程氨氧化细菌, AOA和AOB对NH3的亲和力Table 1 The affinity of comammox, AOA and AOB to NH3
a: 此表中NH3浓度理论上是基于这个平衡(NH3+H+↔NH4+, pKa=9.25)在25 ℃。NH3concentrations in this table are theoretically predicted based on the equilibrium (NH3+H+↔NH4+, pKa=9.25) at 25 ℃.
全程氨氧化细菌Nitrospirainopinata比大多数可培养的AOA物种对氨具有更高的亲和力的研究结果改变了我们对全程氨氧化微生物的认识。事实证明,它们不是栖息在边缘地带的稀有微生物,而是广泛分布在氨贫瘠的环境中,即地球生物圈的大多数环境中。全程氨氧化细菌具有更高的氨亲和力和生产量可以解释为什么它们能够单独完成硝化作用的两个步骤:氨氧化与亚硝酸盐氧化。comammoxNitrospira物种更多地分布在氨缺乏的地下水、饮用水处理系统和一些土壤中。然而,在其他氨贫乏的环境中,如森林、土壤和海洋,却是由AOA和AOB主导氨氧化作用[10,21]。如果全程氨氧化细菌比AOA和AOB对氨的亲和力更高,为什么会出现这种情况呢?可能的原因是这些环境中氨氧化微生物绝大多数是目前不可培养的,而它们对氨的亲和力和生长率实际上高于它们的可培养的亲缘物种(表1)。另一种可能是除氨亲和力和生产量以外的更重要的因素决定了氨氧化群落的形成和组成。
虽然comammoxNitrospirainopinata与只能氧化亚硝酸盐的Nitrospira物种(传统意义上的NOB)密切相关,但是研究人员发现它对亚硝酸盐的亲和力很差(约500 μmol·L-1)[11]。这种差的亲和力可能阻止其在大多数亚硝酸盐浓度较低的环境中作为纯亚硝酸盐氧化细菌生长。当comammoxNitrospirainopinata生长在适合其作为氨氧化微生物的环境中时,亚硝酸盐可以在细胞内累积。因为不需要从外界环境中同化亚硝酸盐,从而克服了对亚硝酸盐的亲和力差这种明显的缺陷。
3 全程氨氧化微生物具有不同的氮代谢途径
迄今为止所有已发现的全程氨氧化微生物都属于硝化螺菌谱系Ⅱ(Nitrospiraspp. Linage Ⅱ),基因组都同时编码了氨单加氧酶(ammonium monooxygenase, AMO)、羟胺氧化还原酶(hydroxylamine dehydrogenase, HAO)和亚硝酸氧化还原酶(nitrite oxidoreductase, NXR)的基因[5-6]。β-AOB具有2~3份AMO和HAO基因簇的拷贝,而全程氨氧化细菌comammoxNitrospira通常只有AMO和HAO基因的一份单拷贝,与γ-AOB, AOA相同[22]。同时,大多数全程氨氧化细菌还具有NXR的单份拷贝,而有的全程氨氧化细菌(Nitrospiramoscounksis)可以拥有5份NXR的拷贝。
在氮素吸收方面,全程氨氧化细菌分支A(comammoxNitrospiraclade A)具有与β-AOB同源相似性的低亲和力RH型氨转运蛋白序列;而另外一个分支B(comammoxNitrospiraclade B)则与典型的硝化螺菌相似,具有高亲和性Amtb型氨转运蛋白序列[22]。因此,全程氨氧化细菌不同分支(clade A, clade B)之间对氨吸收亲和力的区别可能是一个重要的生态位分化因子。此外,大多数全程氨氧化细菌基因组中含有脲酶基因,因此可以通过尿素降解获得氨,这与部分AOA和AOB相似。全程氨氧化细菌还具有多个不同的尿素转运体,除了高亲和力的尿素ABC转运体[1],还有两个额外的尿素转运体:一个外膜孔蛋白(fmdC),参与极低浓度[23]对短链酰胺和尿素的吸收,另一个是尿素羧化转运体(uctT)。此外,comammox基因组独特地含有一个额外的胍丁胺酶基因,可以水解胍丁胺,产生腐胺和尿素,是全程氨氧化细菌与典型的硝化螺菌(Nitrospiraspp.)系统区分的一个代表性特征[22]。
尤为重要的是,全程氨氧化细菌基因组缺乏一种同化亚硝酸还原酶(nirA)或octaheme细胞色素C(octaheme cytochrome C, OCC)的基因[1]。所以在亚硝酸盐作为唯一N源存在时,全程氨氧化细菌将无法生长。
4 全程氨氧化微生物与氨氧化微生物及传统硝化细菌的生态位分化
对于两个comammoxNitrospira分支功能的差别以及comammoxNitrospira和AOA、AOB之间的生态位分化还知之甚少,目前只有一个假说,也就是在表面被附着、底物受限的环境中,comammoxNitrospira比典型的AOB对氨具有更强的竞争力[4]。
Palomo等[22]发现β-AOB具有2~3份amo和hao基因簇的拷贝,以及NOX排毒途径的基因。这些特性为β-AOB在氨充足的环境中主导氨氧化过程提供了基础。相比之下,comammoxNitrospira通常只有amo和hao基因的一份单拷贝,与γ-AOB, AOA相同;此外,与AOA相同,comammoxNitrospira缺乏膜结合细胞色素c-氧化氮还原酶(cNOR),血红素-铜一氧化氮还原酶(sNOR)、亚硝酸钠和细胞色素P460(cytL基因);而在β-AOB中,所有这些基因都存在[22]。综合来看,comammoxNitrospira更能够适应低氨浓度环境,因此可以更直接地与其他氨氧化微生物竞争氨,尤其在氨浓度很低的环境里。
一些硝化螺菌可以利用亚硝酸盐以外的底物作为电子供体,例如甲酸和氢[1,24-25]。编码甲酸脱氢酶(formate dehydrogenase, FDH)的基因只出现在典型的硝化螺菌和全程氨氧化细菌分支B(comammoxNitrospiraclade B)中,而在全程氨氧化细菌分支A中则没有发现。另外一个方面,编码甲酸氢化酶[FHL(formate hydrogenlyase), 产生氢气的酶]的基因,只在典型的硝化螺菌基因组和3个全程氨氧化细菌分支A(A2_bin,AAU_MBR_1和Ca.N.nitrosa)的基因组中发现[22,24]。由于甲酸普遍出现在有氧-缺氧过渡区,因此,这为 comammox分支A、B与典型的硝化螺菌的生态位分化提供了一个基础。
不同的氨氧化微生物群体在碳固定途径上也具有明显的不同。AOB和AOA分别利用耐氧的卡尔文循环(Calvin-Benson-Bassham)和羟基丙酸-羟基丁酸循环,而全程氨氧化细菌则利用微量需氧的还原性三羧酸循环 (rTCA)。此外,典型的氨氧化细菌基因组编码低亲和性的aa3型血红素-铜氧化酶;与之相比,全程氨氧化细菌则具有很高的亲和力的细胞色素-类bd氧化酶类[22]。与β-AOB不同的是,comammoxNitrospira基因组有两种主要的氨氧化路径的单拷贝基因,缺失涉及NO还原的基因,能编码允许在低浓度氧气下高效生长的基因,因此,comammoxNitrospira比β-AOB更习惯于贫营养的低氧环境条件[22]。此外,全程氨氧化细菌还具有与氧化应激抵抗和氧清除相关的2/2血红蛋白II(TrHb2)基因序列[26-27],而AOB和AOA的基因组中则没有。这些特征表明,comammoxNitrospira更能够适应微量氧浓度的环境,在氧浓度不足的环境中对AOB和AOA具有竞争优势。
全程氨氧化细菌的另一个特性是,基因组含有碱性磷酸酶(alkaline phosphatase, phoD),在磷不足和饥饿下可以高度表达[28-29];而在AOA基因组中没有检测到碱性磷酸酶,在AOB中也不是普遍存在的(有同源基因位于Nitrosomonassp. Is79A3、亚硝化球菌和亚硝化螺菌属中)[22]。意味着全程氨氧化细菌在磷和铜贫瘠的条件下相比其他氨氧化微生物更具有竞争优势。
综上所述,全程氨氧化细菌具有这样的特性,是一种适应贫营养条件的生长缓慢的微生物。到目前为止,全程氨氧化细菌(comammoxNitrospira)主要分布在底物有限的环境中,以及在低氧环境和/或微量氧气小生境中[5-6,8,30-32](图2)。
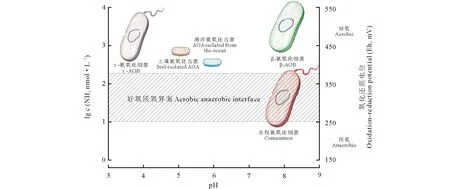
图2 全程氨氧化微生物与半程氨氧化微生物在环境中的生态位分化示意图 Fig.2 The niche specialization and differentiation of comammox organisms with incomplete ammonia-oxidizing microorganisms 氨分子浓度单位为nmol·L-1。The unit for ammonia concentration is nmol·L-1.
5 全程氨氧化微生物带来的科学问题及今后的研究方向
到目前为止,只有少数生态系统已经筛查出全程氨氧化细菌(comammoxNitrospira)的丰度,表明这些微生物在低氨环境中可能较为普遍。现在需要确定的是它们在不同生态系统中对硝化作用的贡献。全程氨氧化细菌在一些氨匮乏环境中的分布不仅可能是因为它们对氨的高亲和力,还可能由其他因素,诸如它们在氨以外的基质上生长的能力和它们的低能量需求等。这些因素可能在氨氧化微生物群落结构的形成与进化中具有综合作用,需要更深入地了解AOA、AOB和comammox的生理机能,并对生态和这些微生物进化作更深刻的认识。包括:1)是否还有更多尚未被发现的comammox? 2)全程氨氧化细菌比AOA和AOB对氨的亲和力更高,具有更高效的能量利用方式,是否能够或者在什么环境中在硝化过程中起主导作用?3)在不施肥的自然生态系统中,氨浓度极低,但为什么氨氧化微生物丰度却非常高?还有其他的科学问题,如全程氨氧化过程是否产生温室气体N2O等等。
因此,未来的研究首先是要全面了解comammox在不同生态系统中的分布。需要在区域以及全球尺度了解comammox, AOA, AOB及标准硝酸盐氧化细菌(NOB)在森林生态系统、湿地-沼泽生态系统以及农田生态系统中的分布数据,并结合生物信息数据,如宏基因组、宏转录组、宏代谢组等数据,分析comammox, AOA, AOB及标准硝酸盐氧化细菌(NOB)的生态位分化规律。研究其他生物与非生物因子(尤其是pH, Eh)对上述硝化微生物生态位分化的影响。其次,结合全基因组测序改进培养方法,获得更多可培养的comammox,以研究comammox的生理特性及功能。现有的可培养的comammox均来自水生生态系统,无法了解土壤中的comammox是否与水生生态系统中的comammox具有相似的特点,也无法判断土壤中全程氨氧化微生物对硝化作用的相对贡献。虽然许多土壤微生物仍然被认为是不能培养或不可培养的,但是在过去的很多年里,许多微生物分离和培养方法有了很大的突破,氮循环中微生物的真正作用有可能通过培养的方法和分子生态技术的结合来阐明。
