生育酚及其衍生物保护自由基诱导的生物大分子损伤和抑制HepG2细胞增殖的作用
2018-07-23韩静静田丹丹高玉星肖春霞
韩静静,田丹丹,高玉星,肖春霞
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
VE又名生育酚,是生物体内的天然抗氧化剂,广泛分布于谷物、种子、果蔬和动物产品中,具有清除自由基[1]、维持哺乳动物及禽类生育[2-3]、调节免疫[4]、抑制血小板凝集和黏附[5]等功能。但VE不溶于水,遇碱不稳定,对氧气、光照敏感,易被氧化,并且某些金属离子如Fe2+可加速其氧化[6]。此外,Reboul等[7]发现VE的生物利用率不稳定,容易受到食物基质、食品加工过程等的影响,因此限制了其在食品、药品和化妆品等领域中的应用。随着研究的深入,一系列生育酚衍生物如生育酚醋酸酯(tocopheryl acetate,TA)、生育酚烟酸酯(tocopheryl nicotinate,TN)、生育酚琥珀酸酯(α-tocopheryl succinate,α-TOS)等被陆续报道。这些衍生物均是VE的游离羟基与醋酸、烟酸、琥珀酸的羧基酯化形成的酯类衍生物,由于VE的活泼羟基被保护,这些衍生物具有更好的稳定性,而亲水性羧基基团则增加了其水溶性。此外,这些衍生物还表现出良好的生物活性,这可能是由于新引入的酸酐结构导致了VE功能的变化[8]。Badraoui等[9]通过体内、体外实验证明,TA能抑制氧化应激损伤,并能诱导乳腺癌细胞凋亡。Schlieper等[10]发现TN具有改善心律不齐的功效。Prasad等[11]研究发现,与TA、TN相比,α-TOS对黑色素瘤细胞生长分化的抑制作用更明显。此外,α-TOS对结肠癌[12]、乳腺癌[13]、胃癌[14]等多种恶性肿瘤细胞的增殖有良好的抑制作用。Rego等[15]比较了TN和α-TOS对视网膜细胞氧化的抑制作用,结果表明后者作用更为明显。大量文献表明,在众多生育酚衍生物中α-TOS的生物活性较为突出[11-15]。近年来,一种新的生育酚衍生物——生育酚聚乙二醇1000琥珀酸酯(tocopheryl polyethylene glycol 1000 succinate,TPGS)的绿色合成研究备受关注[16],TPGS是α-TOS的游离羧基与大量聚乙二醇酯化而成,亲水性聚乙二醇极大地改善了TPGS的水溶性,由于其两亲性质,可作为增溶剂、乳化剂、稳定剂等使用[17-18]。Thi等[19]以TPGS为载体制备了不溶性药物的传递体系,可延长药物在血液及组织中的循环时间。Nguyen等[20]报道TPGS包裹紫杉醇可增加其体外摄取率,使其更容易进入固态瘤中心。Zhu Xianbing等[21]发现槲皮素经TPGS包裹,增加了其水溶性及抗紫外线损伤能力,并提高了其在皮肤表皮层和真皮层的存留量。TPGS已被美国食品药品监督管理局批准为安全的药用辅料[22],但关于TPGS的生物活性鲜有报道。
本研究对比了VE、α-TOS、TPGS对自由基诱导的生物大分子氧化损伤的保护作用,以及对人肝癌细胞(HepG2细胞)增殖的抑制作用,旨在比较研究VE不同衍生物之间生物活性的差异,探讨其内在机理,为VE及其衍生物在食品中的广泛应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
VE、α-TOS、TPGS(结构式见图1) 成都艾科化学技术有限公司;牛血清白蛋白(bovine serum albumin,BSA) 上海泽龙生物工程有限公司;2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis-2-methylpropanimidamide,dihydrochloride,AAPH)、鲱鱼精DNA(herring sperm DNA,hsDNA)、亚油酸(linoleic acid,LA)、偶氮二异庚腈(2,2’-azobis(2,4-dimethyl)valeronitrile,AMVN)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 美国Sigma公司;2,4-二硝基苯肼(2,4-dinitrophenyl hydrazine,DNPH)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Amresco公司;三氯乙酸 天津市博迪化工有限公司;硫代巴比妥酸(thiobarbituric acid,TBA) 国药集团药业股份有限公司;考马斯亮蓝 北京鼎国昌盛生物技术有限责任公司;五水硫酸铜、30%过氧化氢、七水合硫酸亚铁、磷酸二氢钠、磷酸氢二钠、无水乙醇、甲醇、冰乙酸均为分析纯。
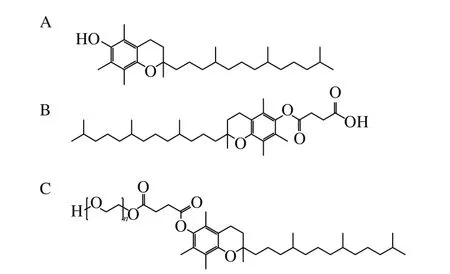
图1 VE(A)、α-TOS(B)和TPGS(C)的结构式Fig. 1 Structures of VE (A), α-TOS (B) and TPGS (C)
HepG2细胞购自上海生命科学研究院,用含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基在37 ℃、5% CO2条件下培养。
1.2 仪器与设备
电泳仪(电泳供电装置)、凝胶成像系统 美国伯乐公司;UV-2450型紫外-可见分光光度计 日本Shimadzu公司;BP211D型精密电子天平 德国Startorius公司;HH-2型恒温水浴锅 江苏省金坛市环宇科学仪器厂;Max M2型多功能微孔板检测仪 美国Molecular公司。
1.3 方法
1.3.1 Cu2+/H2O2诱导BSA氧化、羰基化的测定
在BSA终质量浓度为0.8 mg/mL的反应体系中,先加入不同浓度的VE、α-TOS和TPGS使其终浓度分别为10、50、100、500、1 000 µmol/L(均用甲醇溶解),空白组以等体积的磷酸盐缓冲液代替,模型组以等体积的甲醇代替,漩涡振荡混匀,置于37 ℃水浴中预处理10 min。然后加入Cu2+/H2O2反应体系(空白组不加),并将所有反应组用磷酸盐缓冲液定容至500 μL,使Cu2+和H2O2的终浓度分别为100 µmol/L和2.5 mmol/L,37 ℃水浴反应60 min。反应结束后,采用考马斯亮蓝R-250染色法检测BSA氧化损伤程度,采用DNPH比色法检测BSA羰基化程度[23]。
1.3.2 AAPH诱导BSA氧化、羰基化的测定
蛋白模型和VE、α-TOS、TPGS处理方法同1.3.1节,预处理结束后加入AAPH(空白组不加),使其终浓度为50 mmol/L,置于37 ℃水浴反应5 h。反应结束后,采用考马斯亮蓝R-250染色法检测BSA氧化损伤程度,采用DNPH比色法检测BSA羰基化程度[23]。
1.3.3 自由基诱导LA过氧化的测定
采用Fe2+/VC反应体系产生的羟自由基(·OH)[24]、AMVN热分解产生的烷氧自由基(ROO·)[25]诱导LA发生脂质过氧化反应。
在LA(甲醇助溶)终浓度为1 mmol/L的反应体系中,先分别加入不同浓度的VE、α-TOS和TPGS使其终浓度分别为10、50、100、500、1 000 µmol/L(均用甲醇溶解),空白组以等体积的磷酸盐缓冲液代替,模型组以等体积的甲醇代替,混匀后加入Fe2+/VC或AMVN(空白组不加),将所有反应组用磷酸盐缓冲液定容至1 mL,使反应体系中Fe2+、VC、AMVN的终浓度分别为50 µmol/L和1、10 mmol/L。Fe2+/VC体系37 ℃水浴避光反应24 h,AMVN体系反应12 h。反应结束后,以硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)浓度表示LA脂质过氧化水平[26]。
1.3.4 AAPH诱导DNA氧化损伤的测定
在hsDNA终质量浓度为2 mg/mL的反应体系中,先加入不同浓度的VE、α-TOS和TPGS使其终浓度分别为10、50、100、500、1 000 µmol/L(均用甲醇溶解),空白组以等体积的磷酸盐缓冲液代替,模型组以等体积的甲醇代替,再加入AAPH溶液(空白组不加),并用磷酸盐缓冲液将所有反应组定容至1 mL,使AAPH的终浓度为40 mmol/L,混匀后37 ℃水浴反应12 h。反应结束后采用TBA法检测DNA氧化损伤程度[27]。
1.3.5 MTT法测定细胞活力
将HepG2细胞接种于96 孔板中,置于37 ℃、5% CO2培养箱培养过夜,使细胞贴壁。分别加入不同浓度(10、20、30、40、50 µmol/L)的VE、α-TOS和TPGS,空白组不加。每组设置8 个平行,置于37 ℃、5% CO2培养箱中继续培养24 h。弃上清液,每孔加入100 μL终质量浓度为0.5 mg/mL的MTT溶液,置于培养箱中继续培养,4 h后弃去培养液,每孔加入100 μL DMSO,置于摇床上低速振荡10 min,使结晶物充分溶解。使用多功能微孔板检测仪测定各孔在570 nm波长处的OD值,并根据下式计算细胞存活率。

1.4 数据分析
2 结果与分析
2.1 VE、α-TOS和TPGS对自由基诱导蛋白质损伤的影响
2.1.1 VE、α-TOS和TPGS对Cu2+/H2O2诱导BSA氧化降解的影响
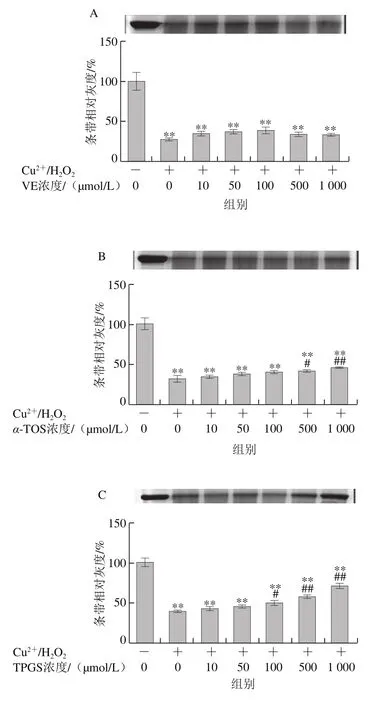
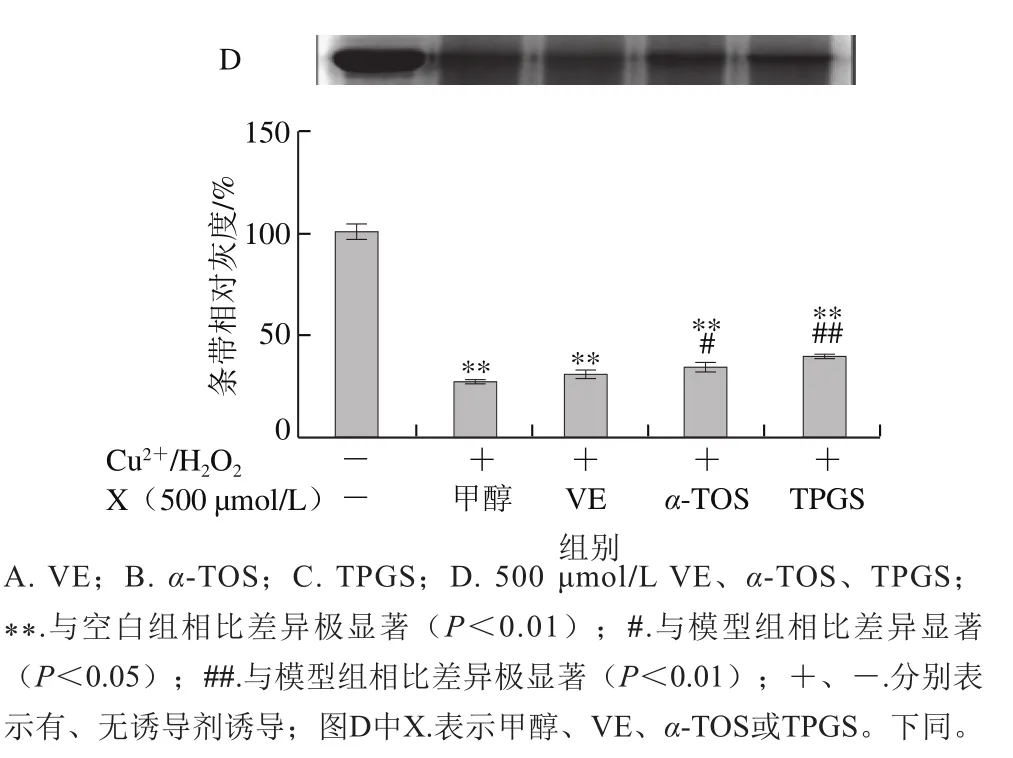
图2 VE、α-TOS和TPGS对Cu2+/H2O2诱导BSA氧化降解的影响Fig. 2 Effects of VE, α-TOS and TPGS on Cu2+/H2O2-induced BSA oxidative degradation
Fe2+、Fe3+、Cu2+、Mn2+、Ni2+等金属离子可以催化H2O2分解,产生氧化活性更高的·OH,·OH能与所有氨基酸反应[28],因此本实验采用Cu2+/H2O2反应体系诱导BSA氧化损伤,探讨VE、α-TOS和TPGS对自由基诱导BSA氧化降解的抑制作用。从图2A可以看出,VE对Cu2+/H2O2诱导的BSA氧化降解没有明显规律性。而α-TOS、TPGS均浓度依赖性地抑制了BSA的氧化降解,在500、1 000 μmol/L浓度下,α-TOS和TPGS的抑制作用显著。由图2D可知,相同浓度下(500 μmol/L),与VE、α-TOS相比,TPGS对Cu2+/H2O2诱导的BSA氧化降解的抑制作用最明显,与模型组相比差异极显著(P<0.01)。
2.1.2 VE、α-TOS和TPGS对AAPH诱导BSA氧化降解的影响
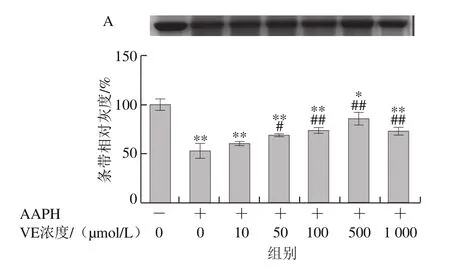
AAPH是一种水溶性的偶氮类化合物,通过均裂产生ROO·,在37 ℃和中性pH值条件下能稳定地产生自由基[29]。如图3所示,VE、α-TOS和TPGS均能显著抑制AAPH诱导的BSA氧化降解,在10~500 μmol/L浓度范围内呈浓度依赖性,并且在500 μmol/L时最强,在1 000 μmol/L时有所减弱,但与模型组相比仍有极显著差异(P<0.01)。图3D表明,相同浓度(500 μmol/L)处理时,TPGS的抑制作用最明显,且与空白组相比没有显著差异,即500 μmol/L的TPGS很好地抑制了AAPH诱导的BSA氧化降解。
2.1.3 VE、α-TOS和TPGS对Cu2+/H2O2诱导BSA羰基化的影响
如图4所示,BSA本身羰基化程度很低,在Cu2+/H2O2作用下发生明显的羰基化修饰。加入VE、α-TOS和TPGS后,BSA羰基化程度明显受到抑制,且抑制作用随浓度的升高而增强。由图4D可知,相同浓度(500 μmol/L)的VE、α-TOS和TPGS均能显著抑制BSA羰基的产生,但TPGS抑制作用最明显。
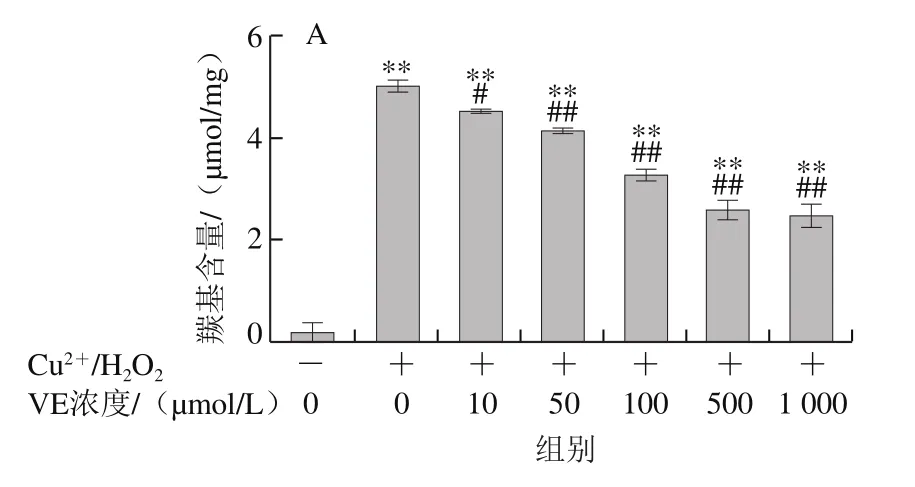
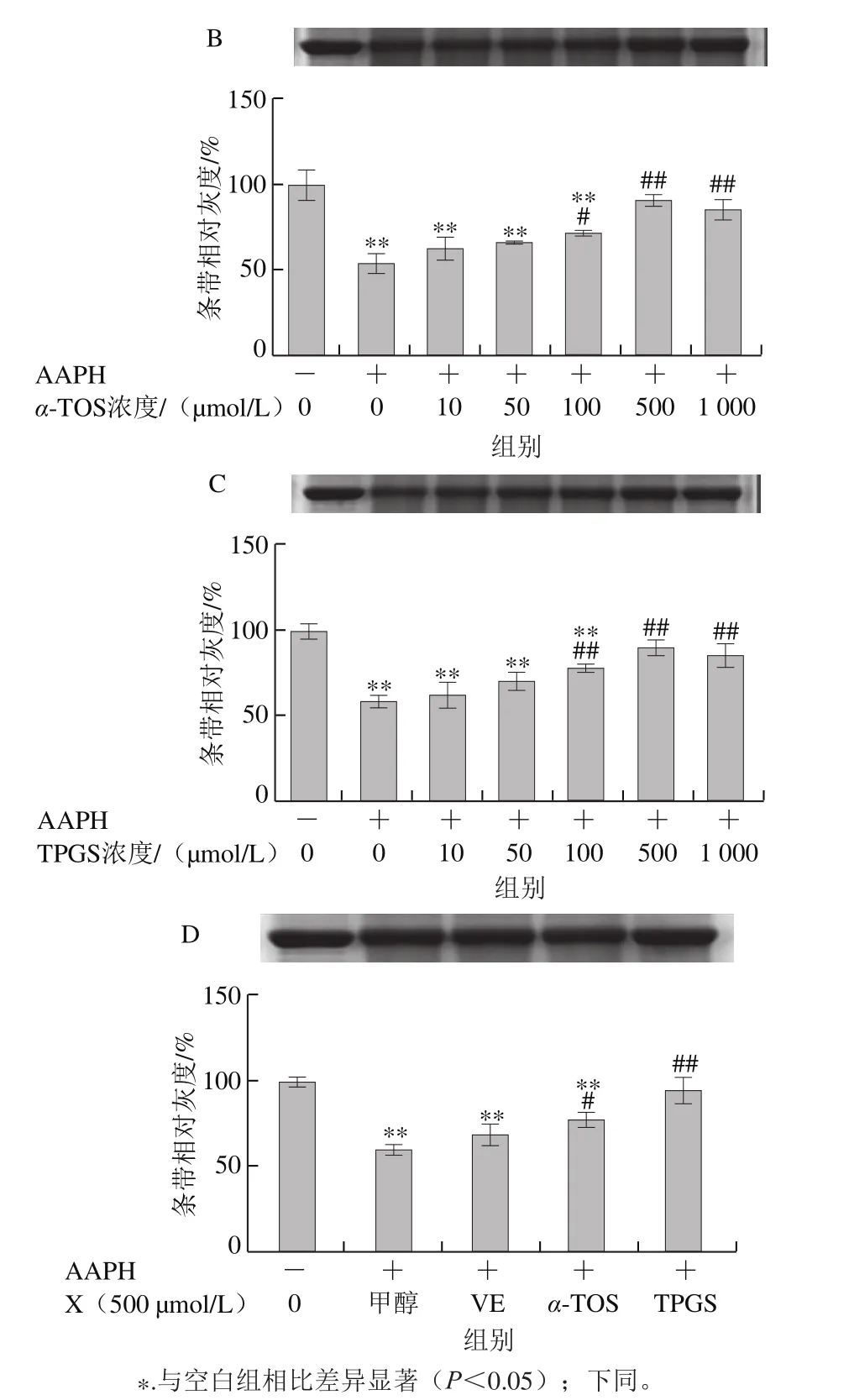
图3 VE、α-TOS和TPGS对AAPH诱导BSA氧化降解的影响Fig. 3 Effects of VE, α-TOS and TPGS on AAPH -induced BSA oxidative degradation
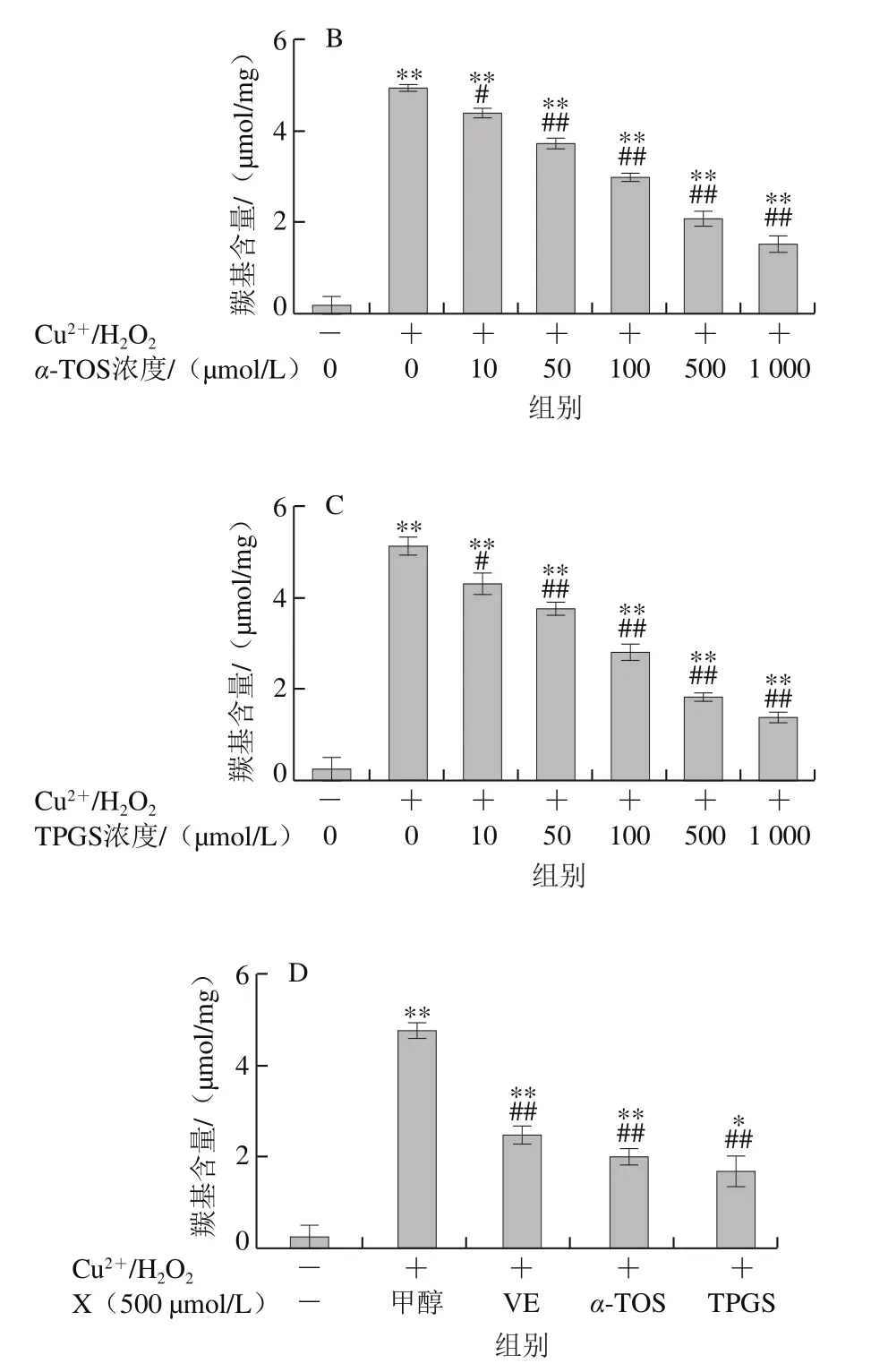
图4 VE、α-TOS和TPGS对Cu2+/H2O2诱导BSA羰基化的影响Fig. 4 Effect of VE, α-TOS and TPGS on Cu2+/H2O2-induced carbonylation of BSA
2.1.4 VE、α-TOS和TPGS对AAPH诱导BSA羰基化的影响

图5 VE、α-TOS和TPGS对AAPH诱导BSA羰基化的影响Fig. 5 Effects of VE, α-TOS and TPGS on AAPH-induced carbonylation of BSA
由图5可知,AAPH诱导BSA发生明显的羰基化修饰。VE、α-TOS和TPGS均浓度依赖性地抑制BSA羰基化修饰。如图5D所示,500 μmol/L的VE、α-TOS和TPGS均显著抑制了BSA羰基的产生,其中TPGS对AAPH诱导的BSA羰基化损伤的抑制作用最明显。
2.2 VE、α-TOS和TPGS对自由基诱导LA过氧化的影响
2.2.1 VE、α-TOS和TPGS对Fe2+/VC诱导LA过氧化的影响
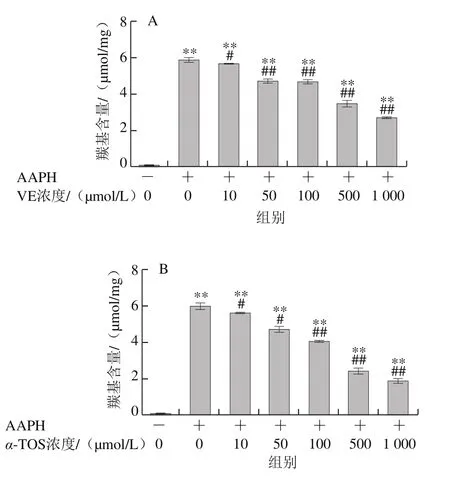
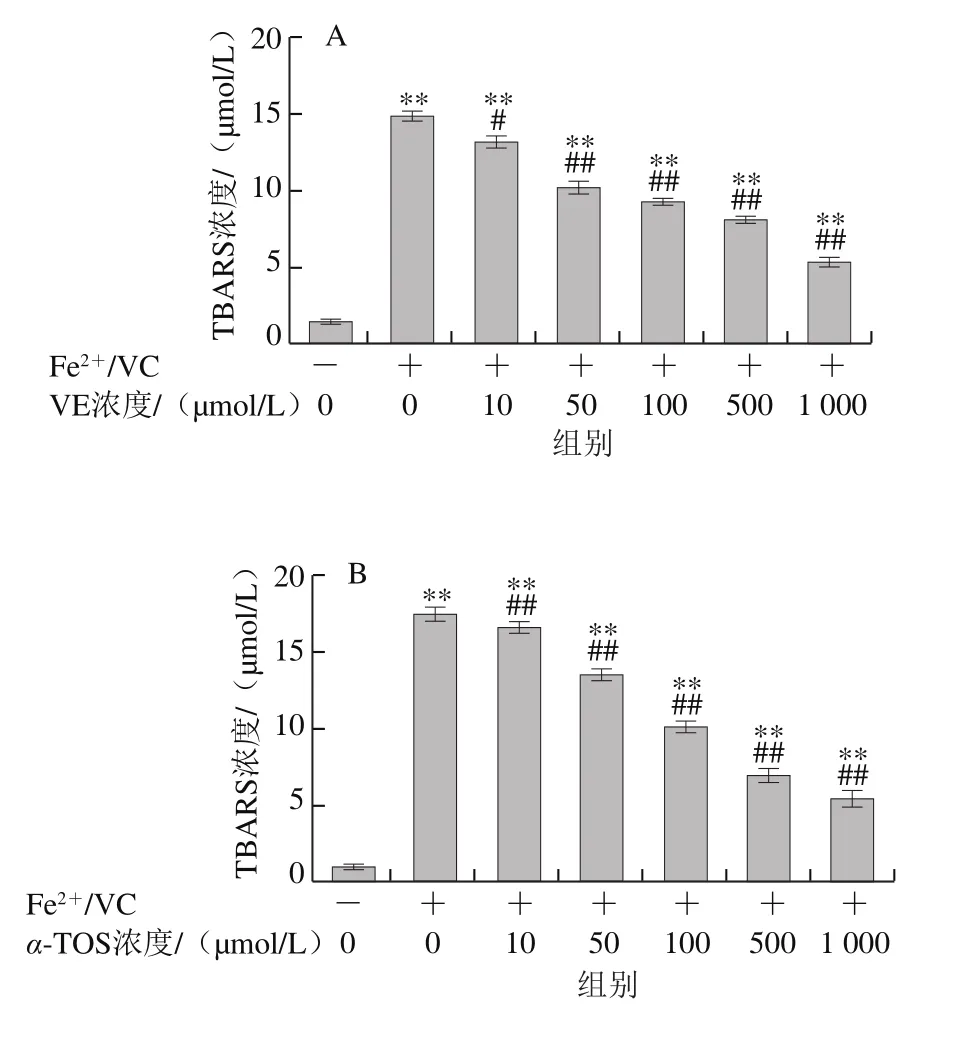
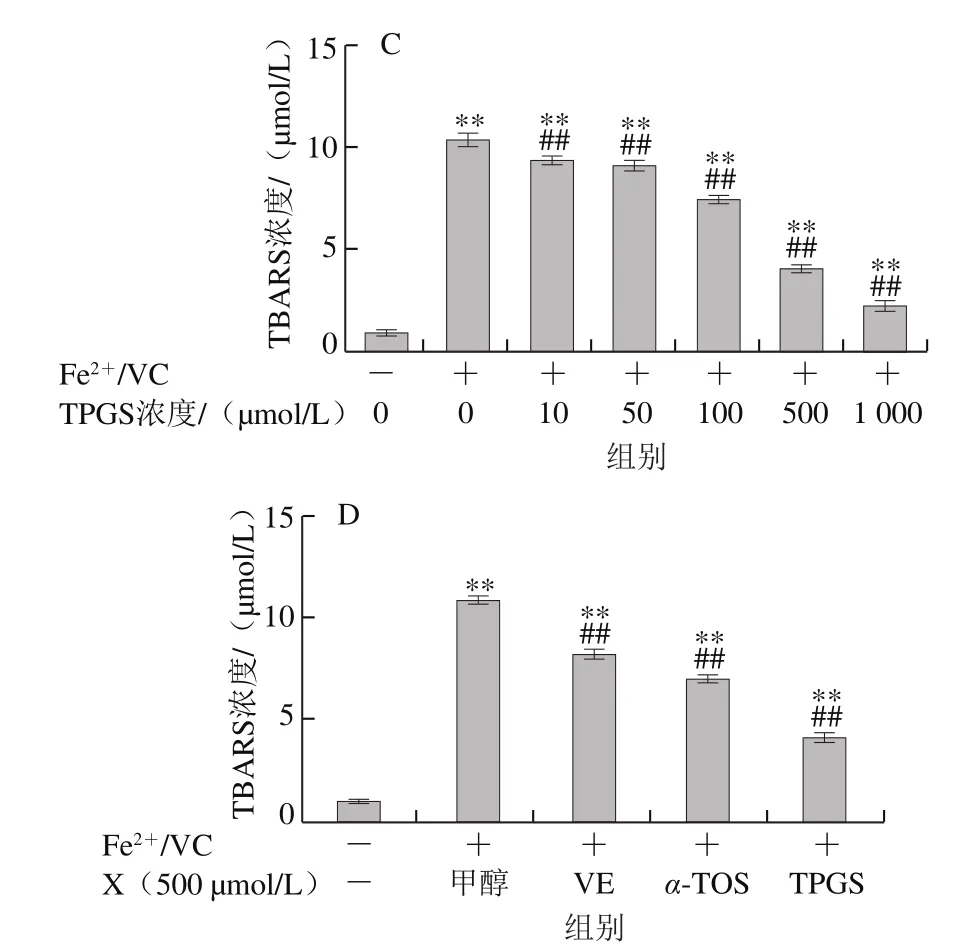
图6 VE、α-TOS和TPGS对Fe2+/VC诱导LA过氧化的影响Fig. 6 Effects of VE, α-TOS and TPGS on LA peroxidation induced by Fe2+/VC
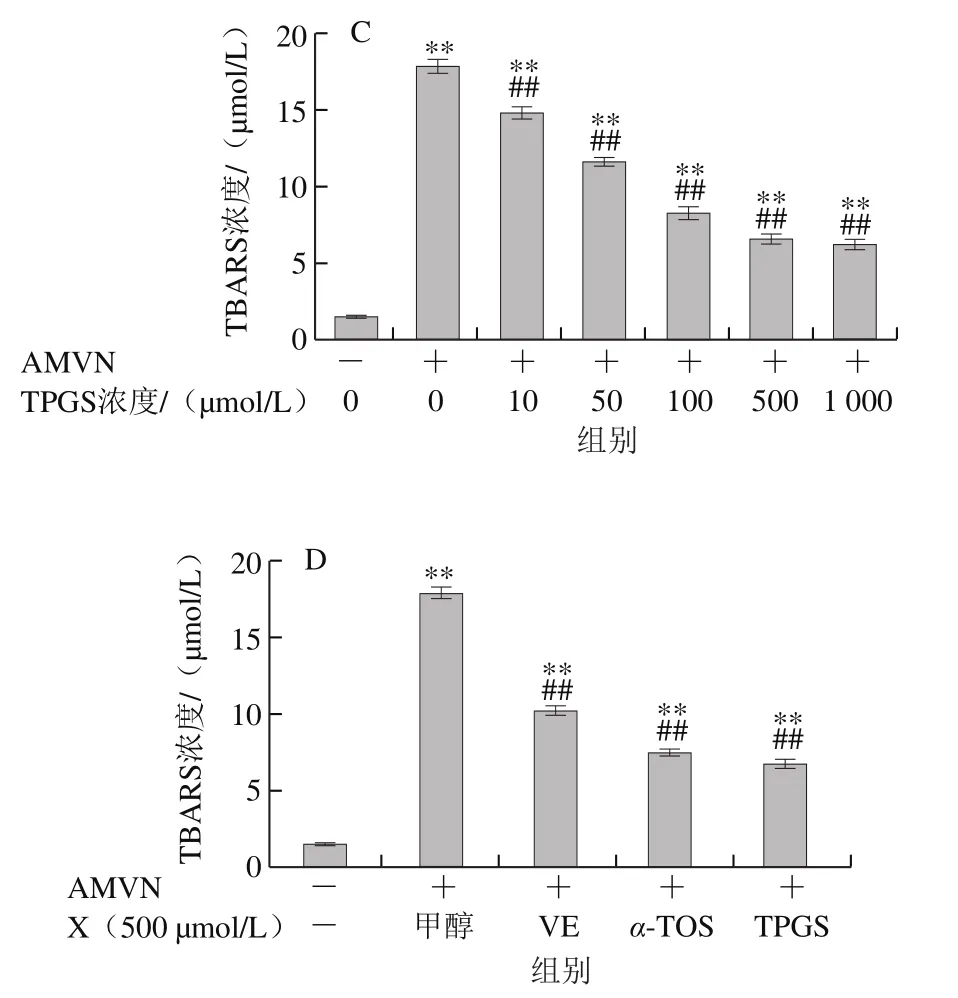
图7 VE、α-TOS和TPGS对AMVN诱导LA过氧化的影响Fig. 7 Effects of VE, α-TOS and TPGS on LA peroxidation induced by AMVN
LA在脂质过氧化过程中会形成亚油酸氢过氧化物、4-羟基壬烯醛、丙二醛等氧化产物,这些产物能与TBA发生反应生成TBARS,其含量是衡量脂质过氧化程度的重要指标之一[30]。由图6可知,LA在自然条件下自氧化反应很慢,生成TBARS浓度较低,Fe2+/VC反应体系诱导LA发生过氧化反应,VE、α-TOS和TPGS均显著抑制了LA过氧化,且其抑制作用随浓度的升高而增强。图6D表明,相同浓度(500 μmol/L)下,TPGS对LA过氧化的抑制作用最强。
2.2.2 VE、α-TOS和TPGS对AMVN诱导LA过氧化的影响

AMVN是一种脂溶性偶氮类化合物,通过热分解产生ROO·,常作为自由基引发剂用于脂质过氧化反应模型的建立[31]。如图7所示,LA自然条件下生成的TBARS浓度很低,AMVN诱导LA发生过氧化反应,TBARS浓度极显著增加(P<0.01)。图7A~C表明,VE、α-TOS和TPGS均浓度依赖性地抑制了LA过氧化。图7D表明,相同浓度(500 μmol/L)的VE、α-TOS和TPGS中,TPGS对AMVN诱导的LA过氧化的抑制作用最强。
2.3 VE、α-TOS和TPGS对AAPH诱导DNA氧化损伤的影响

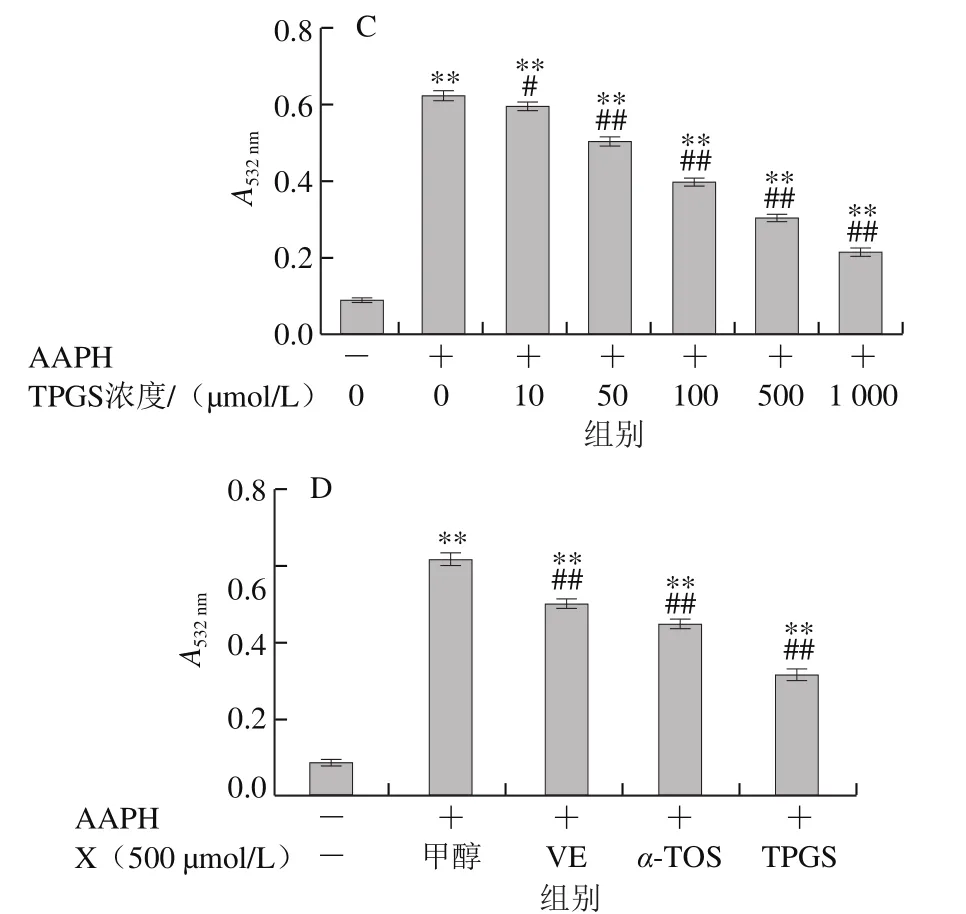
图8 VE、α-TOS和TPGS对AAPH诱导DNA氧化损伤的影响Fig. 8 Effects of VE, α-TOS and TPGS on AAPH-initiated DNA oxidation
AAPH热分解生成的ROO·使DNA分子的双螺旋结构解旋,并最终生成含有羰基的20余种小分子化合物,DNA形成的裂解产物在酸性条件下与TBA反应生成TBARS[27],本实验通过检测TBARS含量来研究不同浓度的VE、α-TOS和TPGS对ROO·诱导DNA氧化损伤的抑制作用。由图8可知,hsDNA在AAPH诱导下发生氧化损伤。随着加入VE、α-TOS和TPGS浓度的增加,其对DNA氧化损伤的抑制作用增强。从图8D可以看出,相同浓度(500 μmol/L)下,TPGS对AAPH诱导的DNA氧化损伤的抑制作用最强。
2.4 VE、α-TOS和TPGS对HepG2细胞活力的影响
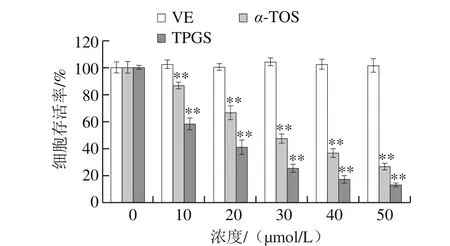
图9 VE、α-TOS和TPGS对HepG2细胞活力的影响Fig. 9 Effects of VE, α-TOS and TPGS on HepG2 cell viability
活细胞能将外源性的MTT还原为水不溶性的蓝紫色结晶甲瓒,并沉积在细胞中,经DMSO溶解并测定其OD值可间接反映活细胞数量。MTT法是测定细胞活力最常见、直接的方法[32]。如图9所示,以空白组细胞存活率为100%,VE对HepG2细胞存活率没有明显影响;而随着α-TOS、TPGS浓度的增加,HepG2细胞存活率逐渐下降,与空白组相比差异极显著(P<0.01),其中TPGS对HepG2细胞增殖抑制作用最强。
3 讨 论
VE常作为油脂加工中的抗氧化剂应用在肉类腌制中防止亚硝胺的生成,此外还具有多种生理功能。Azzi等[33]报道VE能改善与氧化应激相关的心血管疾病、癌症、神经退行性疾病、白内障等疾病。Bošković等[34]发现补充一定量的VE可改善精神分裂症患者的运动阻滞状况。但VE在氧气存在条件下不稳定,α-TOS和TPGS通过酯化修饰提高了化学稳定性,其中α-TOS能显著抑制巨噬细胞NO的生成[35],并降低环孢菌素A对大鼠肝细胞的毒性[36]。TPGS由于具有良好的水溶性,被广泛应用于难溶药物的传递体系中,以提高药物的渗透性和吸收效率[18,37-38],但尚鲜有针对VE和其水溶性衍生物α-TOS、TPGS生物活性差异的报道。
自由基具有未配对电子,化学性质非常活泼。在正常条件下,自由基参与细胞内的信号转导、免疫防御、增殖、凋亡等多种生理活动[39]。当体内氧化和抗氧化体系平衡被打破时,过量的自由基就会攻击体内的蛋白质、脂质、DNA等生物大分子,最终造成机体损伤。活性氧簇(reactive oxygen species,ROS)是自由基的一种,在应激状态下可攻击蛋白质、脂质、DNA等,进而诱发多种疾病,例如肿瘤[40]、神经退行性疾病[41]等。研究表明,ROS不仅参与肿瘤的产生,还与肿瘤的转移密切相关[42]。
本实验以Cu2+/H2O2、AAPH、AMVN等体系诱导产生自由基,对比研究VE、α-TOS、TPGS对自由基引起的生物大分子体外损伤的保护作用,结果表明,与VE、α-TOS相比,TPGS对生物大分子(蛋白质、脂质、DNA)损伤的保护作用最强。许多学者曾认为α-TOS发挥抗肿瘤功效是由于α-TOS水解释放的VE发挥的作用,但多项研究表明,α-TOS是以整体的分子形式发挥作用,并不依赖于VE[43-44]。本研究结果显示,TPGS对自由基诱导的生物大分子损伤的保护作用优于VE,推测TPGS可能也是以整体分子形式发挥抗氧化作用的,而不依赖于其水解产生的VE。TPGS结构中的琥珀酸酯保护了化学性质活泼的酚羟基,提高其稳定性,而高度聚合的聚乙二醇结构保护琥珀酸的另一个游离羧基,随着聚乙二醇链段长度的增加,亲水性也随之增加。TPGS由于具有两亲性,在磷酸盐缓冲液中,其疏水端与生物大分子(蛋白质、脂质、DNA)相互作用,吸附在生物大分子表面,而聚乙二醇与水具有较强的亲和力,在磷酸盐缓冲液中充分伸展,为自由基攻击生物大分子提供了较大的空间位阻,从而达到对生物大分子的最佳保护效果。在HepG2细胞模型中,VE对HepG2细胞的存活率没有明显影响,而α-TOS和TPGS均能够显著降低HepG2细胞存活率,其中TPGS的抑制作用更为明显。这可能是由于TPGS亲水性强,与生物膜磷脂成分的相互作用弱,透过生物膜时的阻力减小、效率增加,在HepG2细胞内有效浓度大大增加。P-糖蛋白是一种由基因编码的跨膜蛋白,在小肠、肝、肾等组织中分布广泛,能够外排大量结构和功能各异的外源性分子,Dintaman等[45]的研究表明TPGS是一种P-糖蛋白的抑制剂,可以抑制P-糖蛋白的外排作用,由此推测TPGS可能通过抑制HepG2细胞膜P-糖蛋白的外排作用,增加其在细胞内的浓度,从而更有效地抑制HepG2细胞增殖。
4 结 论
本实验采用多种自由基体系对比研究VE及其衍生物α-TOS、TPGS对自由基引起的生物大分子体外损伤的保护作用,并从抑制HepG2细胞增殖方面比较其生物活性的差异,发现TPGS的抑制作用最显著。这可能是由于TPGS引入了亲水性强的聚乙二醇结构,在磷酸盐缓冲液中充分伸展,为自由基攻击生物大分子提供了较大的空间位阻;并且TPGS亲水性强,更容易透过生物膜,减少生物膜的外排作用,提高在细胞中的有效浓度。作为一种安全的食品药品传递载体,相较于VE和传统的VE衍生物,TPGS具有更好的水溶性和稳定性。本研究结果将对VE及其衍生物的广泛应用提供一定的理论依据。
