不同覆盖对红花玉兰根系细菌群落结构及多样性的影响1)
2018-07-20周明明段晓婧段二龙马履一杨杨
周明明 段晓婧 段二龙 马履一 杨杨
(北京林业大学,北京,100083) (北京农学院)
红花玉兰(MagnoliawufengensisL. Y. Ma et L. R. Wang)为木兰科木兰属玉兰亚属新种,2004年首次被发现,其通大的干型,通直的树体[1],花型多样,花色多彩,花片数多变,是目前我国唯一内外花被均呈纯红色的玉兰科植物[2],具有极高的科研、园林绿化和药用价值。其引种到北京需要一系列地面管理技术才可使其更好地生长[3]。地面覆盖措施被认为具有改善土壤结构、调节土壤温湿度和提高土壤肥力等环境正效应[4-5],是最好的地面管理措施。地面覆盖还可以有效的改善土壤微生物多样性,不同的覆盖材料对土壤微生物产生不同的影响[6]。杨文权等[7]研究发现,在苹果园覆盖牧草和麦秸、白膜和黑膜以及碎石可显著提高0~20 cm土壤细菌数量,但0~20 cm土壤中放线菌数量在沙子、碎石、白膜和黑膜覆盖后均显著下降。郭子武等[8]研究发现,微生物总数在雷竹林进行土壤覆盖后呈先升高后下降的趋势,土壤主要养分质量分数和有机碳库在林地覆盖后显著增加,从而提高了微生物活性。Houand et al.[9]研究发现,将植物残体施加到土壤表面,土壤真菌活性能够提高,从而使植物残体的分解率加快,使土壤中碳的滞留量增加。陈月星等[10]通过对渭北旱作苹果园进行覆盖研究,得出不同覆盖模式下土壤细菌群落结构和多样性存在显著差异,生草覆盖和秸秆覆盖显著改善了土壤细菌群落结构,土壤中细菌的多样性和丰富度因此被增加了。Huang et al.[11]用植物体进行覆盖,使微生物群落功能多样性高于不加任何覆盖的对照处理。
综上所述,现有的研究大多集中在农作物和果树的覆盖对土壤微生物的结构和多样性的影响上,对观赏类木本植物的研究较为鲜见。此外,覆盖方式多为覆膜、秸秆或者砂石,结构比较单一,没有进行多种材料的叠加覆盖。因此,本研究采用单层和多重覆盖对红花玉兰处理,应用Illumina HiSeq测序平台的高通量测序法揭示不同的覆盖处理下红花玉兰根系细菌群落结构组成,分析不同覆盖处理对红花玉兰根系细菌群落结构及其多样性的影响,为红花玉兰的北引栽培提供土壤管理方面的技术手段和理论依据。
1 试验地概况
本试验在北京林业大学鹫峰教学实习基地普照院苗圃(39°48′N,116°28′E,海拔130 m)于2016年3—11月份进行。该地区为暖温带半湿润大陆性季风气候。年最低气温-19.6 ℃,最高气温39.7 ℃,年均气温9 ℃,有效积温3 798 ℃;年均降水量600 mm;年均日照时间2 769 h,无霜期180 d左右。土壤为淋溶褐土,淤积母质,质地中壤,耕作层土壤以团粒状为主,通透性良好。土壤有机质质量分数1.81%,碱解氮质量分数81 mg·kg-1,速效磷质量分数5.9 mg·kg-1,速效钾质量分数110 mg·kg-1,pH值7.6,山地母质多为岩石风化的残积和坡积物[3]。
2 材料与方法
2.1 试验材料与设计
本试验以4年生、栽植株行距1.5 m×2.0 m的红花玉兰为试验材料。于2016年4月1号进行覆盖。分别对苗木设置免耕不覆盖(T1)、垄膜覆盖(T2)、覆秸秆(T3)、覆秸秆/地膜(T4)、覆地膜/秸秆(T5)5种处理方式(表1)。根据试验地具体情况本试验采用v=5、k=3的平衡不完全区组设计模式(BIB),共设计10个区组,每个区组设置3个小区,每个小区的样本为3株红花玉兰,共计90株。处理后的田间试验设计图如图1所示。

表1 5种处理方式的具体操作
图1 平衡不完全区组田间布置试验图
2.2 样品采集
于红花玉兰生长季末(2016年10月15号),分别在每个处理的18棵红花玉兰根系集中分布区(土层0~20 cm),用直径4 cm的根钻钻取0~20 cm深的土样,将附着在根系上的土壤用毛刷轻轻刷下即为根际土样,每个处理一共18个样点,然后完全随机将6个取样点混均为一个样,3次重复,共15个样品。再清除土样里面剩余的断根和石块等杂质,之后分两部分,一部分用密封袋将样品密封放入干冰冰盒中,带回实验室保存在冰箱中零下80 ℃的超低温条件下,另一部分风干过筛测定土壤全氮、速效磷、速效钾质量分数。
2.3 土壤速效氮、磷、钾质量分数的测定
土壤全氮质量分数用半微量凯氏法测定;土壤速效磷质量分数用Olsen法测定;速效钾质量分数采用NH4OAc浸提-火焰光度计法测定,土壤pH值采用10 g土壤加入25 mL水制作悬浊液水测定[12]。数据统计采用EXCEL工作表进行统计。
2.4 土壤微生物DNA提取及测序
称取冰箱中超低温保存的新鲜土壤样品约0.2 g,各土壤样本总DNA采用CTAB方法提取,然后DNA纯度和浓度用1%琼脂糖凝胶电泳经Gold View染色检测,用离心管取适量的检查样品,加无菌水把样品稀释到0.001 g·L-1。PCR扩增是以稀释后的基因组DNA为模板在Bio-rad T100梯度PCR仪上进行,引物为515F5’-GTGCCAGCMGCCGCGGTAA-3’和806F5’-GGACTACHVGGGTWTCTAAT-3’的16 S V4区段。在指定的测序区域,合成带有barcode的特异引物。PCR采用30 μL反应体系,反应程序为98 ℃预变性1 min;98 ℃变性10 s;50 ℃退火30 s;72 ℃延伸30 s,共进行30个循环;72 ℃延伸5 min[13-14]。PCR产物使用质量分数为2%的琼脂糖凝胶进行电泳检测。使用Thermo Scientific公司的GeneJET凝胶回收试剂盒对PCR产物回收。在按照测序要求合格后进行相应比例混合,之后干冰保存送往北京诺禾致源生物信息科技有限公司进行HiSeq测序。

图2 地膜覆盖田间布置示意图
2.5 数据分析与处理
2.5.1 序列OTU聚类分析和物种注释
将测序所得全部有效的Tags序列以97%的一致性进行OTUs(Operational Taxonomic Units)聚类得到有代表性的OTUs序列,然后通过SILVA的SSU rRNA数据库(设定阈值为0.8~1.0)采用Mothur方法对其进行物种注释分析以此获得其分类学信息。然后用MUSCLE(Version 3.8.31)软件对所有OTUs代表序列快速多序列比对得其系统发生关系。
2.5.2 样品多样性分析
丰富度指数(Chao1)、香农多样性指数(Shannon)、辛普森多样性指数(Simpson)、覆盖率(Coverage)指数以及用于构建UPGMA样品聚类树的Unifrac距离的计算在Qiime软件(Version 1.7.0)进行[14],稀释曲线在R软件(Version 3.4)中绘制并进行Alpha多样性指数和Beta多样性指数有参数检验和非参数检验组间差异分析。
丰富度指数(Chao1)计算公式:
其中,S为Chao1丰富度指数;So,b,s为实际观测的OUT数;n1为只含有一条序列的OUT数目;n2为只含有两条序列的OUT数目。
多样性指数(Shannon)计算公式:
其中,H为Shannon多样性指数;So,b,s为实际测量出的OUT数目;ni为只含有i条序列的OUT数目;N为所有的序列。
2.5.3 RDA分析
冗余分析(RDA)是一种约束性线性直接梯度排序方法。它能够独立保持各个环境变量对生物群落变化的贡献率,其样方排序值既反映了物种组成及生态重要值对群落的作用,同时也反映了环境因子的影响[15]。在R(Version 3.4)语言先对细菌群落数据进行DCA分析,分析结果显示排序梯度最大值是否小于3,如果小于3则适合用RDA分析。
3 结果与分析
3.1 优化序列统计
用于以后分析的最终有效数据是从HiSeq测序得到的Raw PE Reads通过拼接和质控成Clean Tags再进行进一步嵌合体过滤得到,即Effective Tags。处理之后共得到1 169 031条序列,总碱基数292 653 120 bp(bp即碱基对),最小44 bp,最大390 bp,平均长度为255 bp。具体各处理数据预处理统计及质控见表2。
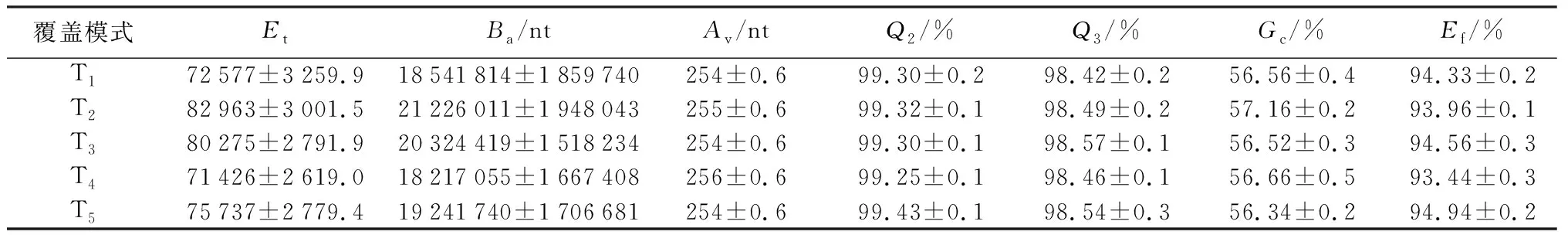
表2 数据预处理统计及质控
注:表中数据为平均值±标准差(n=3);Et表示过滤嵌合体后,用于最终分析的Tags序列;Ba为最终有效数据的碱基数目;Av为有效序列的平均长度;Q2和Q3分别表示有效序列中碱基质量值大于或等于20和30(测序错误率小于0.1%)的碱基所占的百分比;Gc为有效序列中GC碱基的质量分数;Ef为有效序列的数目与Raw PE数目的百分比[19]。
3.2 不同覆盖模式下红花玉兰根系土壤细菌多样性指数
本试验采用97%的一致性对所有样品的有效序列进行聚类来研究样品的物种组成多样性。分析5种不同覆盖模式下红花玉兰根际土壤细菌群落多样性指数(表3)。由覆盖度均超过98%可知,在选择OTU为0.03相似度水平下能够表现所测样本中细菌的真实情况。细菌群落结构多样性结果表明,各覆盖处理土壤细菌的香农多样性指数均高于对照,其中除T4与T1相比差异显著外,其他覆盖处理与对照相比差异不显著,各覆盖处理之间差异不显著,T4最高为10.565,高出对照9.565%。丰富度指数以T2最高达到5 838.12,高出对照7.366 2%,其他由大到小顺序是T3、T5、T4、T1。各覆盖处理均显著高于对照,但是T4和T5之间差异不显著。
表3红花玉兰根际土壤细菌群落在不同覆盖模式下多样性指数
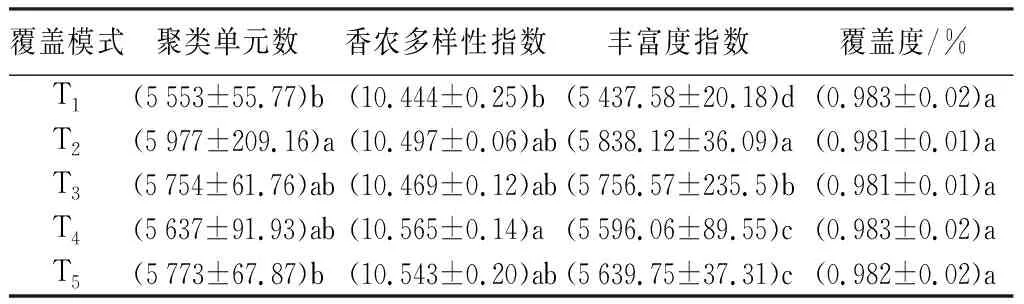
覆盖模式聚类单元数香农多样性指数丰富度指数覆盖度/%T1(5553±55.77)b(10.444±0.25)b(5437.58±20.18)d(0.983±0.02)aT2(5977±209.16)a(10.497±0.06)ab(5838.12±36.09)a(0.981±0.01)aT3(5754±61.76)ab(10.469±0.12)ab(5756.57±235.5)b(0.981±0.01)aT4(5637±91.93)ab(10.565±0.14)a(5596.06±89.55)c(0.983±0.02)aT5(5773±67.87)b(10.543±0.20)ab(5639.75±37.31)c(0.982±0.02)a
注:表中数据为平均值±标准差(n=3);同列不同小写字母代表处理间差异显著(P<0.05)。
3.3 不同覆盖模式下红花玉兰根系土壤细菌群落结构
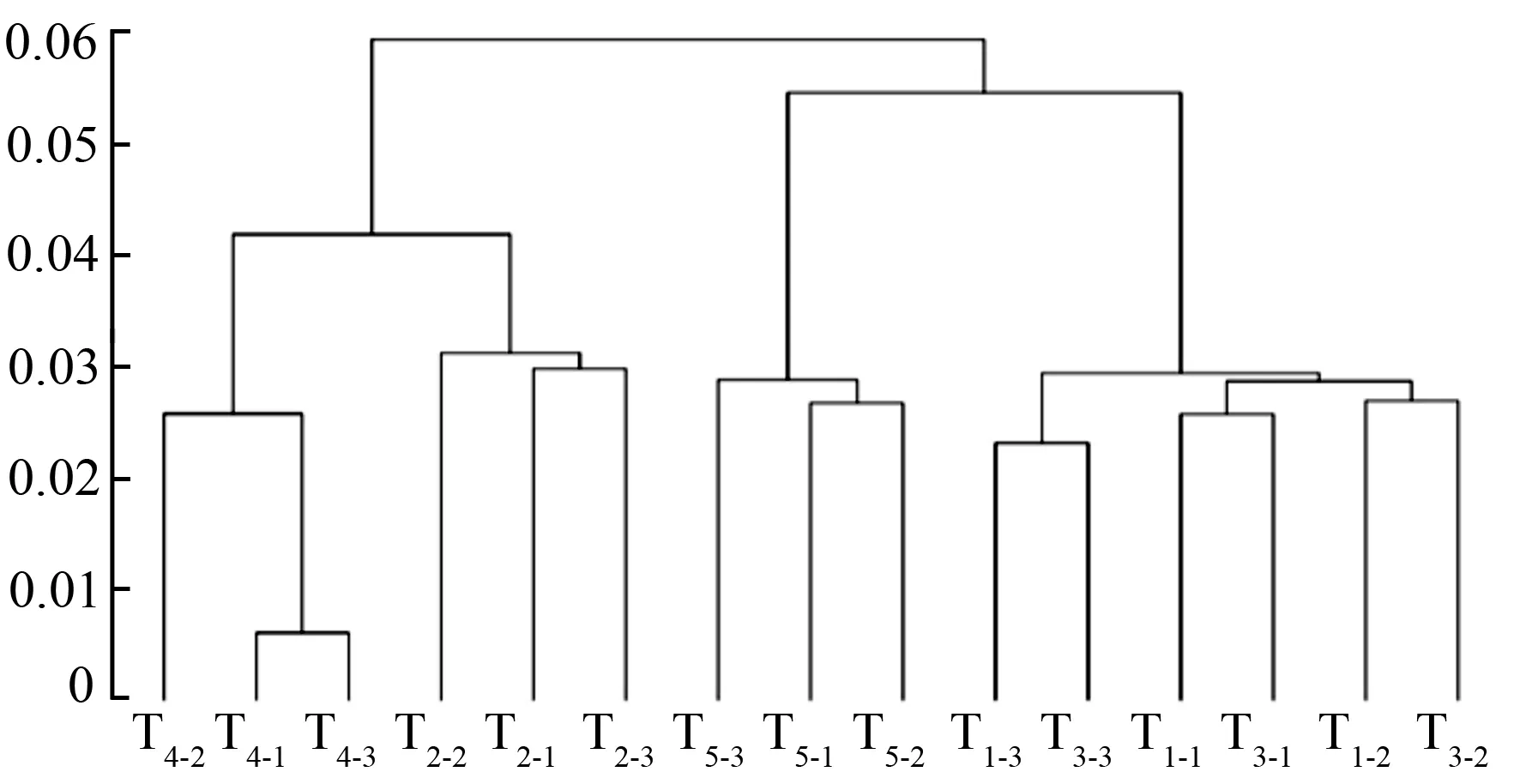
将聚类得到的结果与Silva数据库进行比对,然后在各个分类水平上统计各样本的群落组成。在不同的处理中按门分类水平进行优势门分析(图3),从图3可知,不同覆盖处理间细菌群落结构相似度较高,其中丰度较高的有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)。变形菌门为所有覆盖处理中的优势菌门,所占比例由大到小的顺序为T5、T3、T1、T4、T2。T5覆盖所占比例为42.60%、T3为40.5%,两者分别高出对照9.54%和4.13%。T2和T4所占比例分别低于对照17.75%和10.11%。即秸秆直接与土壤接触的两种覆盖中变形菌门比例较其他覆盖高。除丰富度较高的几个菌门外,不同覆盖处理的群落结构中还包括绿弯菌门(Chloroflex)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)等,所占比例较低,均为3%~8%。将不同覆盖处理的细菌组成聚类,结果表明(图4),15个土壤样品依据门水平上的丰富度共分为2大类,T2和T4有一定的相似性聚集在一起,与对照和其他覆盖处理样品分离。T3、T5和T1聚为一大类。他们又可分为两类,即T5为一类,T3和T1为一类,这表明T2、T4和T5能显著改变红花玉兰根系土样细菌群落结构。
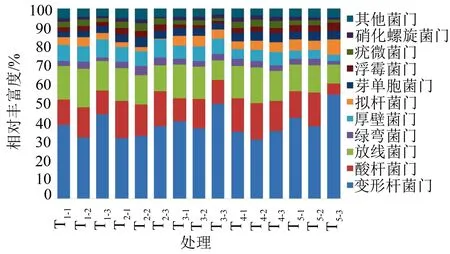
T1-1~T1-3.不覆膜对照处理;T2-1~T2-3.地膜覆盖;T3-1~T3-3.秸秆覆盖;T4-1~T4-3.秸秆/地膜覆盖;T5-1~T5-3.地膜/秸秆覆盖。
图3不同覆盖处理对红花玉兰土壤细菌群落结构分析
T1-1~T1-3.不覆膜对照处理;T2-1~T2-3.地膜覆盖;T3-1~T3-3.秸秆覆盖;T4-1~T4-3.秸秆/地膜覆盖;T5-1~T5-3.地膜/秸秆覆盖。
图4不同覆盖处理对红花玉兰土壤细菌群落结构聚类分析树状图
3.4 不同覆盖模式下红花玉兰根系土壤细菌系统发育
将5个覆盖处理测序所得的有效序列进行OTU聚类,然后在属分类水平上根据所有样品的物种注释及丰富度信息,选取丰富度排名前35的属进行系统发育学分析,确定各物种间的亲缘关系及分类学地位,利用热图(Heatmap)(图5)通过颜色梯度及相似程度来反映5个处理在各分类水平上细菌群落组成的相似性、多样性及丰富度。结果表明,不同覆盖方式红花玉兰根系土壤中细菌群落排名前35的属所属的门主要为变形菌门、酸杆菌门、放线菌门、厚壁菌门、芽单胞菌门、硝化螺旋菌门(Nitrospirae)。在纲水平上的丰富度较高的有α-变形杆菌纲(Alphaproteobacteria)、酸杆菌纲(Acidobacteria)、δ-变形菌纲(Deltaproteobacteria)、放线菌纲(Actinobacteria)、丙型变形菌纲(Gammaproteobacteria),他们总和占总细菌纲质量分数的比例由大到小的顺序为T5、T3、T4、T2、T1。T5最高,为54.8%,较对照高8.98%,T3、T4、T2分别比对照高5.29%、3.73%、3.38%,均达到了显著水平。目水平所有处理的优势目为根瘤菌目(Rhizobiales),其中处理T5和T3高于对照,T5最高,为10.98%,较对照高25.57%;T3为9.81%,较对照高12.24%,差异显著。T4和T2均低于对照,T2最低,为7.2%,较对照低21.1%;T4为7.85%,较对照低11.46%,差异显著。属水平丰富度较高的有芽孢杆菌属(Bacillus)、微枝形杆菌属(Microvirga)、短根瘤菌属(Bradyrhizobium)、红色杆菌属(Rubrobacter)、乳杆菌属(Acidobacterium)、鞘脂单胞菌属(Sphingomonas)、节杆菌属(Arthrobacter)。其中T1、T2、T3的优势菌为芽孢杆菌属,T4的优势菌为节杆菌属,T5的优势菌为乳杆菌属。芽孢杆菌属占所有细菌属的比例由大到小的顺序为T3、T1、T2、T4、T5,T3最高,为11.54%,对照T1为11.36%,T5最低,为5.17%,各处理差异不显著。
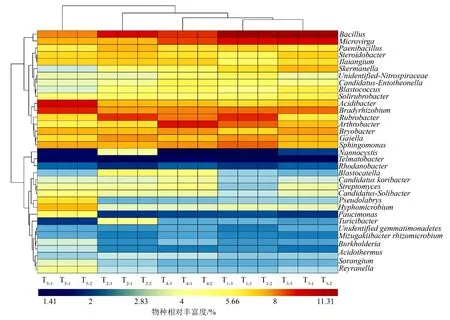
T1-1~T1-3.不覆膜对照处理;T2-1~T2-3.地膜覆盖;T3-1~T3-3.秸秆覆盖;T4-1~T4-3.秸秆/地膜覆盖;T5-1~T5-3.地膜/秸秆覆盖。
3.5 不同覆盖处理下细菌群落多样性与土壤理化性质间RDA分析
将群落多样性与土壤理化性质之间的关系进行RDA分析(图6)。结果显示,第一排序轴解释了62.54%的变异,第二排序轴解释了19.40%的变异。图中的黑色箭头表示关注的变量的“梯度方向”;箭头的长短表示该变量对该方向上样本差异的贡献,越长代表该变量对该方向上样本的贡献越大,相关性越强。本研究中着重关注细菌群落多样性与土壤理化性质之间的关系。从图6中可以看出,通过1年覆盖处理,土壤全氮、速效磷、速效钾质量分数和pH值与细菌丰富度指数、香农多样性指数、辛普森多样性指数夹角都比较大,说明他们之间相关性不大。即经过1年覆盖引起的土壤全氮、速效磷、速效钾质量分数及pH值的改变与细菌多样性指数差异不显著。
进一步考察处理与各变量的关系,从原点到处理点位置的方向与变量方向夹角越小,表示相关性越大。图6中全氮、速效磷、速效钾质量分数所在的方向与T3和T5处理夹角最小。说明T3和T5处理能够显著的提高土壤中全氮、速效磷、速效钾质量分数。另一方面细菌丰富度指数、香农多样性指数、辛普森多样性指数所在的方向与T2、T4处理夹角最小,即T2和T4处理能够显著提高细菌多样性指数,这也和3.2中得出的结果相一致。
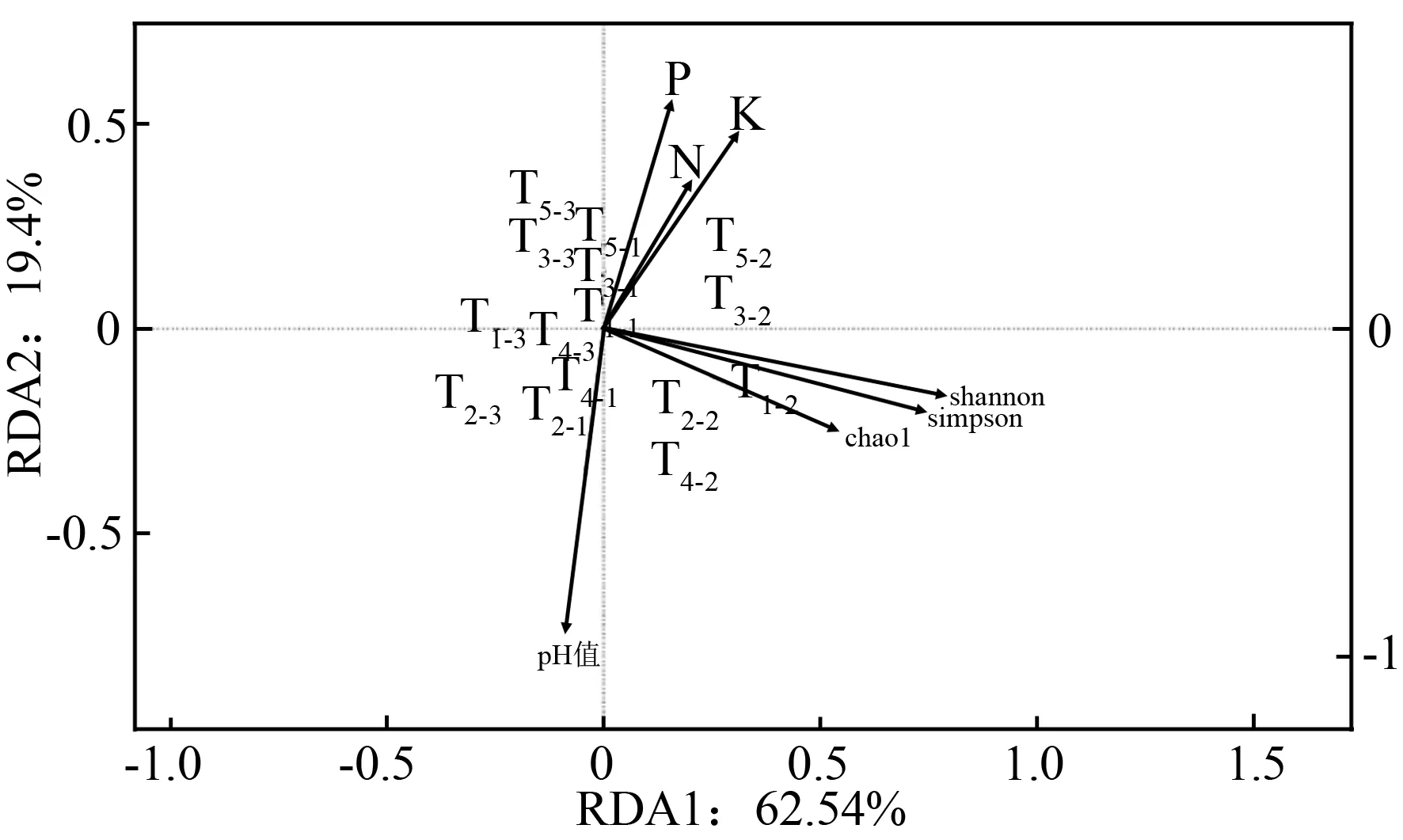
T1-1~T1-3.不覆膜对照处理;T2-1~T2-3.地膜覆盖;T3-1~T3-3.秸秆覆盖;T4-1~T4-3.秸秆/地膜覆盖;T5-1~T5-3.地膜/秸秆覆盖;N、K、P.分别表示土壤全氮、速效磷、速效钾质量分数;Chao1.丰富度指数;Shannon.香农多样性指数;Simpson.辛普森多样性指数。
图6不同覆盖处理下微生物群落多样性与土壤理化性质间RDA分析
4 结论与讨论
微生物作为土壤健康状况重要的生物学指标[16-18],其参与有机质分解、腐殖质形成、土壤养分和循环等过程,是土壤有机质与养分转化、循环的动力,直接反映土壤养分的供给能力[19]。地面覆盖措施被认为具有改善土壤结构、调节土壤温湿度和提高土壤肥力等环境正效应[4-5],因此,地面覆盖会影响土壤细菌生长代谢和繁殖,进而影响其群落结构和多样性。微生物多样性指数是评价土壤微生物群落多样性高低的非常有效方法之一,高的多样性指数表明微生物群落多样性较高[20]。本研究结果也显示,不同的覆盖模式中样本的细菌多样性指数均高于对照。尤其秸秆/地膜覆盖模式中细菌香农多样性指数最高,这是因为全膜覆盖在提高土壤温度的同时也大幅度提高了土壤水分的保蓄率、降水利用率和提高水分利用[21]。尤其是地膜覆盖对地下5~15 cm处提高地温有显著效果。另一方面,也有研究表明,在一定温度范围内,微生物生长受土壤温度和土壤水分的影响,土壤微生物活性及呼吸率随土壤温度的升高而升高[22]。因此,T4覆盖增加土壤贮水量,提高了土温,同时地膜上面的秸秆相当于大地的一层棉被进一步缓解了土温的变化,促进土壤微生物的繁殖[23-24]。有研究也显示秸秆覆盖能够显著降低0~30 cm各土层土壤密度,并显著提升土壤孔隙度[24]。
本研究RDA分析结果也显示T3和T5处理与土壤全氮、速效磷、速效钾质量分数有很强的正相关关系,即T3和T5处理能显著提高土壤全氮、速效磷、速效钾质量分数;这可能是由于这两种处理中覆盖的玉米秸秆直接与土壤接触,这对于土壤细菌来说是巨大的碳氮和能源补充,从而使秸秆得到进一步分解成各种营养元素,促进土壤全氮、速效磷、速效钾质量分数的增高。然而,本研究显示土壤细菌多样性与土壤全氮、速效磷、速效钾质量分数和pH值相关性不强,这与其他研究土壤pH值和速效钾质量分数是影响土壤微生物群落结构特征的重要因素之一[25-26]不同。可能是由于本试验只覆盖一个生长季,各种覆盖对土壤理化性质的改善刚刚起作用还没有达到显著水平,因此,细菌香浓指数中除T4处理与对照达到显著差异外其他处理与对照并没有显著差异。因此还需要做进一步的跟踪试验研究。
土壤细菌多样性及其群落结构的组成对生态系统的平衡起着重要作用,但由于许多细菌种类的生活史未知以及其不可培养性使得土壤细菌的重要性被低估[27]。高通量测序技术在16 S rRNA基因的测序中能够得到覆盖深度非常高的测序数据[21],成为了土壤微生物研究者的重要研究方法。本研究采用升级后的HiSeq测序技术,对不同覆盖处理下红花玉兰根系细菌群落结构进行研究。结果表明,5种覆盖处理的细菌包含了43门,90纲,184目,564属。覆盖能改变细菌群落组成,如在门水平上主要有变形菌门、酸杆菌门、放线菌门、厚壁菌门、芽单胞菌门、硝化螺旋菌门,其中变形菌门T5和T3变形菌门质量分数最高,与对照达到了显著差异水平。有研究表明,变形菌门在细菌类群中丰度最高,形态、生理和代谢多样性上的差异性很大,参与地下的碳、氮和硫等的生物地球化学循环[28]。T5和T3均为秸秆直接与土壤接触覆盖。表明秸秆直接与土壤接触的覆盖对变形菌门的影响更大,这可能是由于玉米秸秆增加了土壤养分和碳储量,从而影响土壤细菌群落结构[29-31]。在纲水平上,α-变形杆菌纲为所有处理的优势纲。在属水平上,T1、T2、T3的优势属为芽孢杆菌属,T4为节杆菌属,T5为乳杆菌属。因此,本研究明确了单层覆盖模式下和多重覆盖模式下红花玉兰根系土壤的优势菌属不一样,T3、T5处理有利于提高土壤全氮、速效磷、速效钾质量分数,T4、T2处理有利于提高微生物多样性。由于本试验为覆盖处理1年,对于连年覆盖下土壤微生物种群落结构和多样性还需要进一步研究。
