1株木霉的分离鉴定及抑菌和植物促生作用1)
2018-07-20潘宣圳曾晓春刘伟璐刘志华王金杰范海娟
潘宣圳 曾晓春 刘伟璐 刘志华 王金杰 范海娟
(东北林业大学,哈尔滨,150040)
木霉菌无性阶段为木霉属(Trichoderma),有性阶段为肉座菌属(Hypocrea)[1],广泛存在于多种生态系统中[2]。大多数木霉菌具有生长迅速,适应能力强,环境友好的特点。目前已经报道的木霉菌有250多种[3],包含许多对农林业发展非常重要的植物病害生物防治菌,譬如哈茨木霉(T.harzianum)、棘孢木霉(T.asperellum)、深绿木霉(T.atroviride)、绿木霉(T.virens)等。生防木霉菌通过竞争、抗生、重寄生和诱导植物抗性等多种机制对至少18个属29种植物病原真菌有拮抗作用[4]。生防木霉不仅可用于植物生长期病害防护,也可用于果蔬及园林植物材料的储运保鲜和储藏期病害防护[5-6]。在抗病的同时,生防木霉还能促进植物生长和提高土壤肥力[1,7]。所以,木霉资源的收集鉴定及生防能力测试对生防木霉的开发应用具重要价值。小白菜(Brassicachinensis)是十字花科芸薹属蔬菜,营养丰富,生长周期短,是非常适合东北种植的设施蔬菜。种植过程中,病害、化肥超量施用、农药残留、重金属污染都会降低其品质并影响其生长速度。而木霉能改善小白菜品质,同时也促进其生长[8-10]。本研究将哈尔滨本地分离的1株木霉,经平板抑菌检测后固体发酵,探索其对小白菜的促生长作用,旨在开发一种东北地区适用的促小白菜生长的木霉菌剂。
1 材料与方法
1.1 菌株及植物材料
以东北林业大学城市林业示范基地野生益母草(Leonurusjaponicus)根际土为材料进行木霉分离。拮抗指示菌杨叶枯病菌(Alternariaalternata)、尖孢镰刀菌(Fusariumoxysporum)、杨树烂皮病菌(Cytosporachrysosperma)由东北林业大学林学院保存。小白菜种子由甘肃武威市蔬菜种苗研究所育种。
1.2 培养基
孟加拉红培养基:蛋白胨5.00 g,葡萄糖10.00 g,磷酸二氢钾1.00 g,硫酸镁(无水)0.50 g,琼脂20.00 g,孟加拉红0.03 g,氯霉素0.10 g,蒸馏水1 L,121 ℃高压蒸汽灭菌20 min。
马铃薯葡萄糖琼脂培养基(PDA):土豆200 g、葡萄糖20 g、琼脂20 g,蒸馏水1 L,121 ℃高压蒸汽灭菌20 min。
PD培养基:PDA中不加琼脂。
Luria-Bertani培养基(LB):酵母提取物5 g,胰蛋白胨10 g,氯化钠5 g,琼脂20 g,蒸馏水1 L,pH值为7.4~7.6,121 ℃高压蒸汽灭菌20 min。
LB液体培养基:LB中不加琼脂。
1.3 木霉的分离鉴定
采集益母草根际土样[11],系列稀释后涂布于无菌孟加拉红平板。28 ℃培养3 d后,挑取其上疑似木霉的单孢菌落,转接到PDA斜面,28 ℃培养7 d后,置于冰箱中4 ℃保存,菌株缩写为Lj。
将纯化的Lj转接到PDA平板上,28 ℃培养,观察描述菌落特征、生长速度。另,采用插片法[12]进行形态学鉴定。
将Lj孢子接入PD培养基,28 ℃振荡培养48 h,过滤收集菌丝体。用CTAB法提取菌丝体DNA,PCR扩增其ITS序列[13]。纯化后ITS连入pMD18-T载体并转化大肠杆菌Top10感受态细胞。挑单克隆LB液体培养,PCR验证为阳性后送上海生工测序。所得序列用TrichOKEY[14]和TrichoBLAST[15]在线软件进行木霉鉴定。
1.4 木霉Lj菌株对植物病原真菌的抑制作用检测
在Lj和供试植物病原真菌的PDA平板分别打孔获得菌饼(d=5 mm),转接到新铺制的PDA平板,二者相距6 cm,分别以每皿接种1和2个植物病原真菌菌饼的平板为对照1和对照2。每个试验6次重复,接菌后平板置于28 ℃恒温培养。培养5 d后,用十字交叉法测量植物病原菌菌落半径,计算抑菌率[12]。
1.5 木霉Lj菌株对小白菜促生作用测定
对Lj进行固态发酵[16],产物用自来水稀释,孢子浓度为109、108、107、106个·mL-1,分别灌土后播种催芽2 h的小白菜,以浇灌等量自来水的小白菜为对照,每浓度3个重复。在播种后15、30、45 d测小白菜叶长、根长、鲜质量。取15 d第1、2真叶,30 d第3真叶,45 d第5真叶,蒸馏水洗净吸干表面水份后-80 ℃冻藏,用以测定叶绿素总质量分数和过氧化物酶(POD)活性。叶绿素总质量分数和POD活性检测均使用苏州科铭生物技术有限公司生产的相应试剂盒。
数据分析时,叶绿素总质量分数和POD活性的结果为3个样每样3次重复的平均值,其他指标的结果为30株苗(10株/重复×3次重复)的平均值。用统计软件SPSS 19.0进行处理间的差异显著性分析,Duncan法进行多重比较(P<0.05)。
2 结果与分析
2.1 木霉的分离纯化
孟加拉红培养基28 ℃培养3 d时,白色菌丝形成疑似木霉的菌落(图1Aa、图1Ab)。挑取菌丝到PDA斜面,28 ℃培养2 d,获得纯化的Lj菌株(图1Bc)。培养7 d,产生大量绿色分生孢子(图1Bd)。
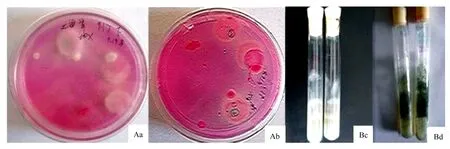
A.孟加拉红培养基;B.PDA培养基;a.培养3 d(正面);b.培养3 d(背面);c.培养2 d;d.培养7 d。
2.2 木霉Lj菌株的形态
28 ℃ PDA平板培养3 d,菌落直径约为90 mm,菌丝白色、丛毛状。产孢簇外观绒状,培养3 d产孢区为黄绿色(图2a),培养7 d为暗黑绿色(图2b)。菌丝宽度为1~9 μm,分枝多呈锐角,少数近直角(图2c)。分生孢子梗直径6~9 μm,常有2~3次分枝,近基部的分枝一般成对,而近顶部的分枝一般单生或对生。分生孢子瓶梗安瓿形,具细而短的颈部,排列成轮枝状或排列不规则。分生孢子椭圆形,长3~4 μm,宽1.5~2.5 μm,壁薄而光滑,单个时浅灰色,聚集时灰绿色(图2d、图2e)。其形态基本与毛簇木霉(T.velutinum)[17]236-238一致。
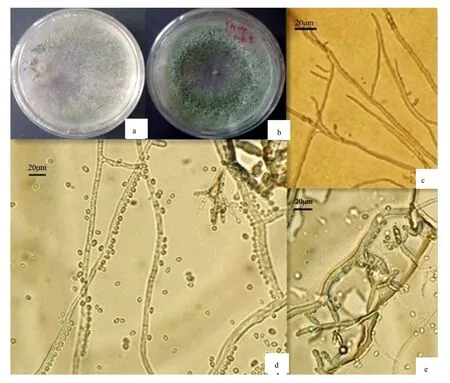
a、b.纯化后Lj菌株(3 d和7 d);c.菌丝(2 d);d、e.分生孢子及分生孢子梗(7 d)。
2.3 木霉Lj菌株的ITS鉴定
以菌株Lj菌丝体基因组DNA(图3a)为模板,PCR扩增其ITS序列,序列大小为500~750 bp(图3b)。将该PCR产物切胶纯化(图3c)后进行TA克隆,转化子经PCR验证,确认阳性克隆(图3d),测序得到ITS基因序列,长度约620 bp。该序列的GenBank接受号为MG386272。经TrichOKEY和TrichoBLAST分析ITS序列,Lj被鉴定为毛簇木霉。
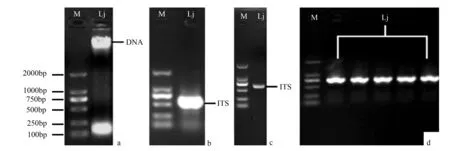
a.菌丝体基因组DNA;b.ITS序列的PCR扩增产物;c.纯化后的ITS序列;d.ITS序列TA克隆的PCR验证(M为DL 2000 marker)。
2.4 木霉Lj菌株对植物病原真菌的拮抗效果
木霉菌株Lj对供试的3种植物病原真菌菌丝生长有显著的抑制效果(图4)。对峙培养5 d后,与对照1相比,木霉菌株Lj对A.alternata、F.oxysporum和C.chrysosperma抑制率为(44.56±1.79)%、(37.51±3.03)%和(60.90±1.07)%,与对照2相比,抑制率分别为(38.39±1.91)%、(28.40±3.05)%、(52.63±1.43)%。抑菌率为6次重复的平均值±标准差。
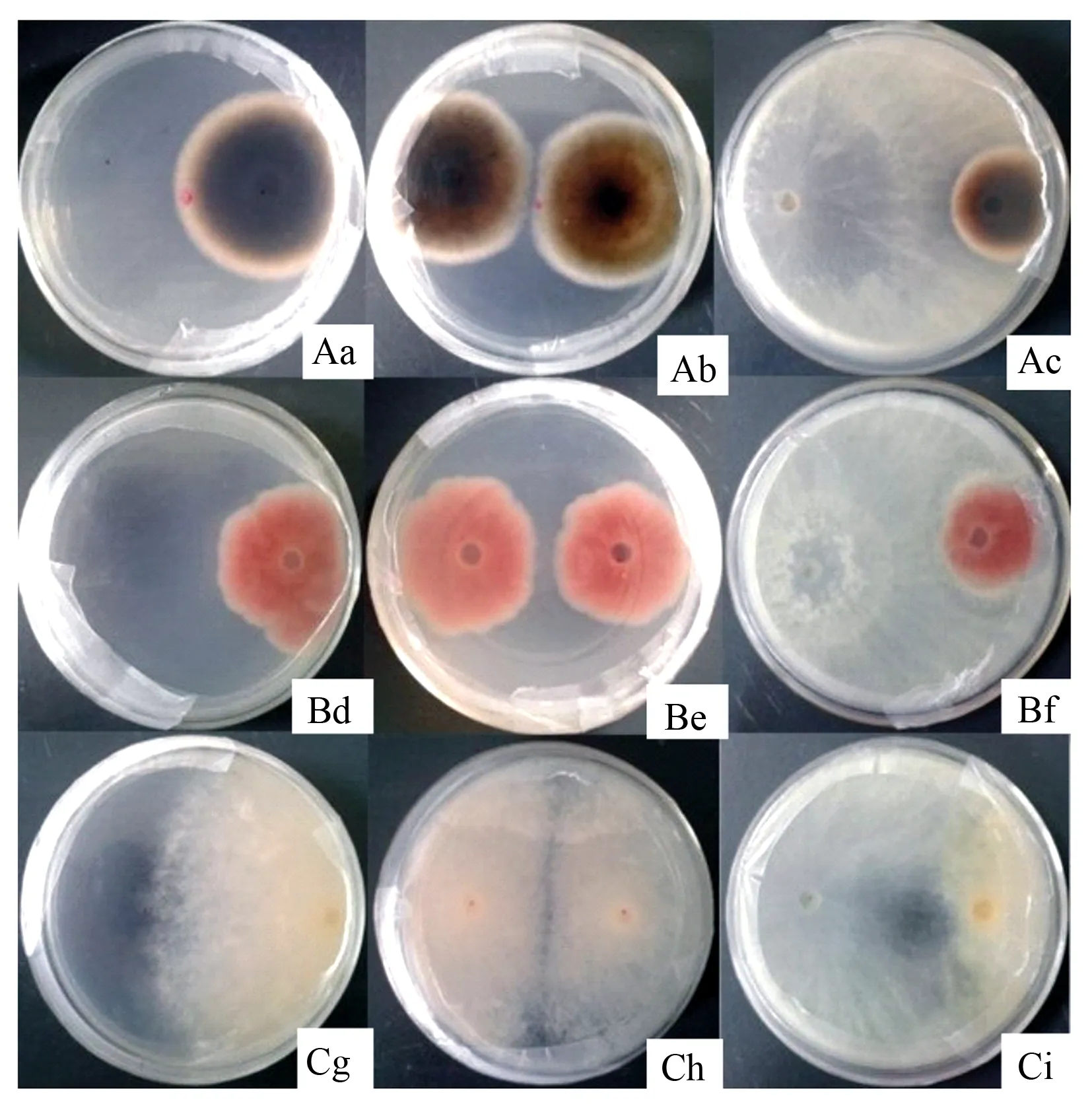
A.A.alternata;B.F.oxysporum;C.C.chrysosperma;a、d、g.对照1;b、e、h.对照2;c、f、i.Lj与植物病原真菌的对峙。
图4木霉Lj菌株对植物病原真菌的拮抗效果
2.5 木霉Lj菌株对小白菜的促生作用
植物叶绿素质量分数与植物的光合作用、营养状况密切相关,是反映植物生长状况的重要指标。而POD广泛存在于植物细胞中,能够消除过氧化氢和酚类、胺类对植物的毒性[18]。
由图5、6可见,各时段木霉处理组小白菜的生长状态均好于对照组。由表1可见,处理组小白菜的叶长、根长和鲜质量在播种后15 d和30 d均明显大于对照组。相应地,处理组小白菜的叶绿素总质量分数明显高于对照,各时段均表现为随Lj孢子浓度下降而增加,并在106个·mL-1组最高(表2)。叶POD活性在15 d时与对照无显著差异,30 d和45 d时大部分处理组显著高于对照,分别在109和106个·mL-1组最高(表2)。可见,木霉对小白菜有前期促生长和后期提高POD活性的作用。

A.处理15 d;B.处理30 d;C.处理45 d;a、f、k.对照;b、g、l.孢子浓度为1×109个·mL-1;c、h、m.孢子浓度为1×108个·mL-1;d、i、n.孢子浓度为1×107个·mL-1;e、j、o.孢子浓度为1×106个·mL-1。
图5木霉Lj菌株处理后小白菜的总体生长状况
3 结论与讨论
有些广泛存在且重要的木霉至今未发现有性型[19],而已知有性型的木霉种也很难人工培养获得有性阶段子实体,所以目前最常用的Gams & Bissett木霉分类系统仍以无性阶段特征为分类依据[20]。但木霉无性型在形态学上存在渐变现象[17]26,实际应用中按形态特征分类不好把握,所以木霉分类常用形态学与分子生物学相结合的方法。ITS序列分析是木霉分类鉴定中较常用的简便快速而且准确的方法[17]57-59。经形态鉴定和ITS序列分析,菌株Lj被一致鉴定为毛簇木霉(T.velutinum)。

A.处理15 d;B.处理30 d;C.处理45 d;a-c.对照;d-f.孢子浓度为1×109个·mL-1;g-i.孢子浓度为1×108个·mL-1;j-l.孢子浓度为1×107个·mL-1;m-o.孢子浓度为1×106个·mL-1。
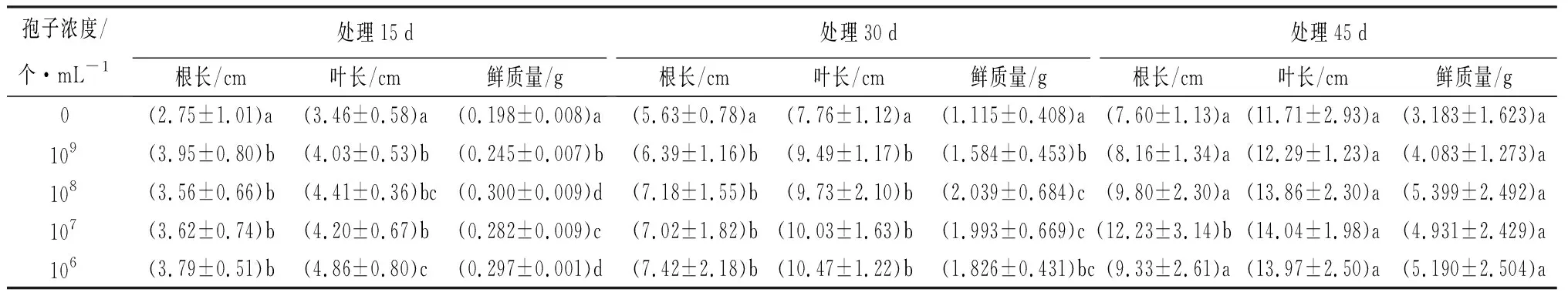
图6 木霉Lj菌株处理后小白菜的个体生长状况
注:表中数据为30株苗的平均值±标准差。同列数据后不同字母表示差异显著(P<0.05)。
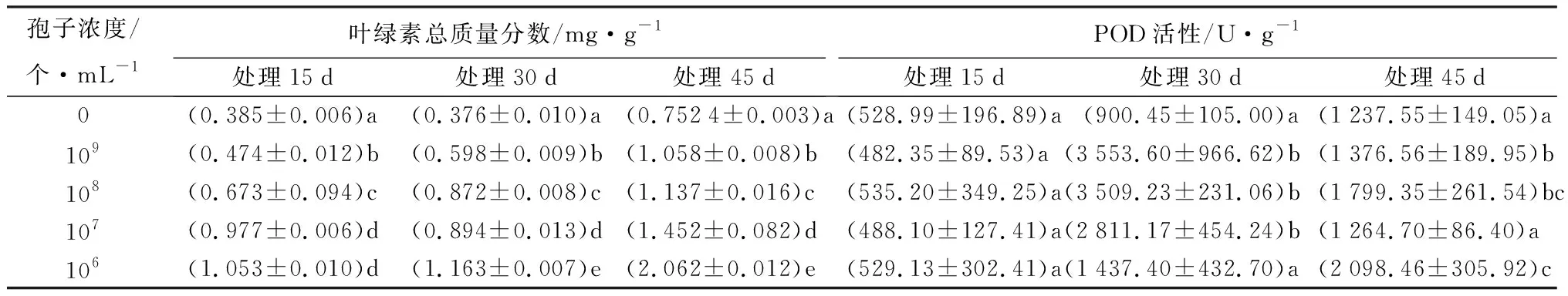
表2 木霉Lj菌株处理对小白菜叶绿素总质量分数及POD活性的影响
注:表中的数据为3个样每样3次重复的平均值±标准差。同列数据后不同字母表示差异显著(P<0.05)。
毛簇木霉已在我国广东、四川、山东、河南等省份的土壤中分离到[21-22]。该种在印度也被发现,被认为是嗜冷真菌[23],能产生非核糖体肽和细胞壁降解酶,可作为生防制剂[24]。对峙培养时毛簇木霉对烟草疫霉菌(Phytophthoraparasiticavar.nicotianae)、尖孢镰刀菌(F.oxysporum)、杨叶枯病菌(A.alternata)、辣椒炭疽病菌(Colletotrichumcapsici)、棉花黄萎病菌(Verticilliumdahliae)有拮抗作用[22,24]。与前人研究结果相似的是,本研究也发现毛簇木霉Lj对尖孢镰刀菌、杨叶枯病菌和杨树烂皮病菌(C.chrysosperma)具较强拮抗作用。而且,3种植物病原菌中,对杨树烂皮病菌的拮抗作用最强,抑菌率可达60.9%。认为毛簇木霉Lj菌株可开发为生防制剂。
Zachow et al.发现毛簇木霉能在甜菜根表面和根内定植,同时处理组甜菜叶长显著大于对照组[25]。本研究发现毛簇木霉菌肥施用于小白菜后,30 d内处理组植株根长、叶长和鲜质量明显高于对照组,相应的小白菜叶绿素总质量分数显著较高,施肥最适浓度为106个·mL-1。可见,毛簇木霉Lj菌肥一次施用对小白菜生长的促进作用至少可持续30 d。预期该菌肥在设施小白菜的增产方面具有一定应用价值。
已报道木霉促植物生长主要途径为代谢产物的促生作用,与促生根际微生物的有益互作,以及促进土壤中营养物质释放等方面[25-26]。而毛簇木霉菌株Lj对小白菜的促生作用机理有待进一步研究。
木霉促植物生长的过程往往伴随着植物防御酶活性的增加和植物抗逆能力的提升。植物过氧化物酶(POD)是重要的解毒酶之一,可降低逆境对植物生长的影响,其活性与植物抗逆能力密切相关[18]。本研究中,小白菜叶片POD活性在30 d和45 d时大部分处理显著高于对照,分别在109、106个·mL-1组最高。毛簇木霉菌肥的处理可能有助于提高生长后期小白菜植株的抗逆能力。由于植物光合作用、次生代谢产物合成、胁迫条件的变化均可能影响抗氧化酶活性,使之产生非线性的变化[27],本研究中取样点较少,时间间隔较长,可能无法找到POD变化的拐点,不能精确反映其变化规律。
