双色蜡蘑对黑松幼苗生长量及其根系形态的影响
2018-07-19周晓莹李红丽仇苏倩范小莉
周晓莹,梁 玉,李红丽*,高 娅,仇苏倩,范小莉,董 智
(1 山东农业大学 林学院,山东省土壤侵蚀与生态修复重点实验室,泰山森林生态站,山东泰安 271018;2 山东省林业科学研究院,济南 250014)
菌根是土壤中菌根真菌与植物根系形成的互利共生的联合体,是自然界中一种普遍存在的真菌和植物共生的现象[1-2]。植物根际的许多真菌能入侵植物根系并形成不同类型的菌根[3]。菌根真菌可在宿主植物根部形成共生结构[1],以此增加宿主植物对土壤中营养元素和水分吸收、利用[4-9]以及碳水化合物代谢[10],促进植物生长和产量的提高[8-14],增强植物对逆境胁迫的忍耐性,增强抗旱、抗盐能力,诱导植物产生系统抗性[15-18]。特别值得一提的是,菌根真菌侵染能诱导植物根系发生明显变化,改变植株根系构型,使根系分支增加,从而促进更多侧根的形成,增加根长和直径[19-21]。大量的研究表明,利用优良的菌根真菌进行接种,培育菌根化苗可以增加植物对水分和养分的吸收,提高植物抗逆性,并促进其生长发育。
双色蜡蘑(Laccariabicolor)属于担子菌亚门(Basidiomycotina)、口蘑科(Tricholomataceae)、蜡蘑属(Laccaria)的外生菌根真菌[22]。这种真菌分布于世界各地,在森林苗圃[23]和成熟的林分[24]都很常见,能够定殖于植物根部,促进植物侧根形成[25],增加植物对土壤中营养元素的吸收,对宿主植物具有显著的促生效应[26-27],它还能够提高植物对重金属等非生物逆境的抵抗能力[27],是一种优良的外生菌根真菌,但国内对双色蜡蘑的研究较少。
黑松(Pinusthunbergii)是一种耐盐碱、抗逆性较强的树种,是暖温带海岸防护林建设中常用的常绿针叶树种[28]。但是,黑松幼苗期生长缓慢,而人工接种菌根菌可以有效地提高苗期的生长、造林成活率和苗木质量[29]。1992年法国开发了一个研究项目,通过接种双色蜡蘑来促进花旗松(Pseudotsugamenziesii)的生长[30];2000年,双色蜡蘑的S238N菌株在法国商业上应用于苗圃和森林种植园中花旗松的接种,这种菌株可以使木材总产量增加60%[31]。但接种双色蜡蘑能否促进黑松幼苗的生长、根系发育?其接种后何时发挥作用?其促生作用是否持续加强?对于这些问题的研究尚未见报道。基于此,本研究以黑松为材料,探讨其接种双色蜡蘑后一段时间内的地上部分与根系的生长动态及根系形态的动态变化,以期揭示双色蜡蘑对黑松生长的影响,观测双色蜡蘑发挥作用的时间及其生长效应,为双色蜡蘑在黑松育苗上的应用提供理论依据。
1 材料和方法
1.1 试验材料
供试树种为黑松,种子来源于山东乳山市垛山林场。供试菌种为外生真菌双色蜡蘑,引自于加拿大阿尔伯塔大学,经培养后,将液体菌剂用搅拌机打碎用于实验接种。
1.2 试验设计
黑松种子利用90%的酒精和0.2%的HgCl2清洗10 s,然后用无菌的去离子水反复冲洗,再将种子置于灭菌培养皿的无菌滤纸上进行催芽处理,催芽期间用无菌的去离子水浸润种子保证其催芽所需湿度。将培养皿放置于智能人工气候培养箱中催芽,温度25 ℃。
试验于2017年4~9月在山东农业大学林学实验站温室中进行,4月20日,用消毒液及紫外线杀菌灯管对温室及营养杯进行消毒灭菌,营养杯高18 cm、直径9 cm。培养基质以泥炭土与珍珠岩3∶1混合,经高温高压灭菌2 h后装入营养杯中。试验共设置接菌(接种双色蜡蘑,文中用LB代替,下同)和不接菌对照(CK) 2个处理。将催芽露白的黑松种子播入营养杯,待黑松出苗后,立即分别接种培养好的打碎的双色蜡蘑液体菌剂,接种量为每营养杯每次10 mL菌液,对照不接菌,每处理100株苗。1个月后重复接种1次。所有试验苗均在25 ℃温室中培养,期间用25%的 Hoagland营养液作为黑松的营养来源,接种前后2周不浇营养液,光照和浇水等管理措施一致。
1.3 指标测定
1.3.1侵染率参照常双双等的台盼蓝染色[32]方法,于接种黑松2个月后测定侵染率,其侵染率为34.55%,对照没有侵染。
1.3.2生长量与根系形态参数各处理于接菌后15 d测定第1次株高,其后分别于30 d、60 d、90 d、120 d测定株高。同时,随机选择幼苗10株带回实验室,把幼苗从营养杯中全部取出,尽量不伤害根系,经自来水清洗后,从根茎处将幼苗分成地上植株和根系两部分;立即于EPSON 平板扫描仪扫描完整的根系,获得根系图片,采用 WinRhizo根系分析仪测定长度、表面积、体积、分支数等根系形态参数。测定完成后,将地上部分和根系于80 ℃烘干12 h后称得干重。
双色蜡蘑对植物生长的作用可用其生物量的积累效应—生长效应(mycorrhizal growth response,MGR)表示,其计算公式[33]为:
MGR(%)=100×(BA-BNA)/BNA
其中,BA表示接种双色蜡蘑后植物的生物量,BNA表示不接种双色蜡蘑时植物的生物量。MGR>0表示双色蜡蘑促进了植物的生长,MGR<0表示双色蜡蘑抑制了植物的生长,MGR= 0表示双色蜡蘑对植物生长没有影响。
另外,根系分形维数采用王义琴等的方法[34]计算。
1.4 数据处理
使用SPSS19.0对黑松生长量和根系参数进行统计分析与ANOVA方差分析,并且检验处理间差异的显著性,显著性水平α=0.05。采用Excel 2010进行绘图。
2 结果与分析
2.1 接种双色蜡蘑对黑松株高和生物量的影响
表1显示,接种双色蜡蘑15和30 d,接种黑松幼苗株高与对照组差异不明显(P>0.05),接种30 d较对照增加11.58%;接种60~120 d,双色蜡蘑显著地促进了黑松株高的生长,接种处理株高比对照组显著增加29.08%~74.04%(P<0.05)。可见,接种双色蜡蘑对黑松幼苗株高生长有促进作用,该效应随接种时间的延长呈持续增长趋势。
同时,由表1还可知,黑松接种双色蜡蘑第15和30天时,接菌处理地上部生物量与对照组均没有显著差异;从接种后第60天开始,双色蜡蘑对黑松地上部分的生物量产生了显著的促进作用 (P<0.05),在接种第60~120天时生长效应为100.00%~195.00%。另外,接种黑松根系生物量在第15天时就高于对照组,但与对照差异不显著;在接种第30~120天时,双色蜡蘑处理的黑松根系生物量均显著高于对照组(P<0.05),期间双色蜡蘑对黑松根系生长的促进作用上升比较平稳,较对照平均增长91%。整体来看,接种双色蜡蘑对黑松生物量的促进作用同样随接种时间延长而持续增长。
2.2 接种双色蜡蘑对黑松根系形态、根长和根系分支数的影响
图 1显示, 在接种双色蜡蘑15~120 d期间,接种双色蜡蘑处理黑松幼苗主根长度、侧根长度、总根长、根系的分支数等根系构型均明显优于未接种的对照。首先,接种的黑松苗总根长在各个生长阶段中均不同程度大于未接种对照(图2,A),其在接种第15天时就开始表现出与对照组的显著差异(P<0.05),在接种第90d~120天时总根长增长量较大,并于第120天时总根长达到最大(303.55 cm),远大于现未接种CK(141.84 cm)。其次,接种双色蜡蘑黑松幼苗根系分支数从第60天开始也显著高于不接种对照(图2,B),其于接菌后90~120 d期间根系分支数增长量最大,接种第120天时根系分支数(1 218.33)远远大于CK(410.00)。
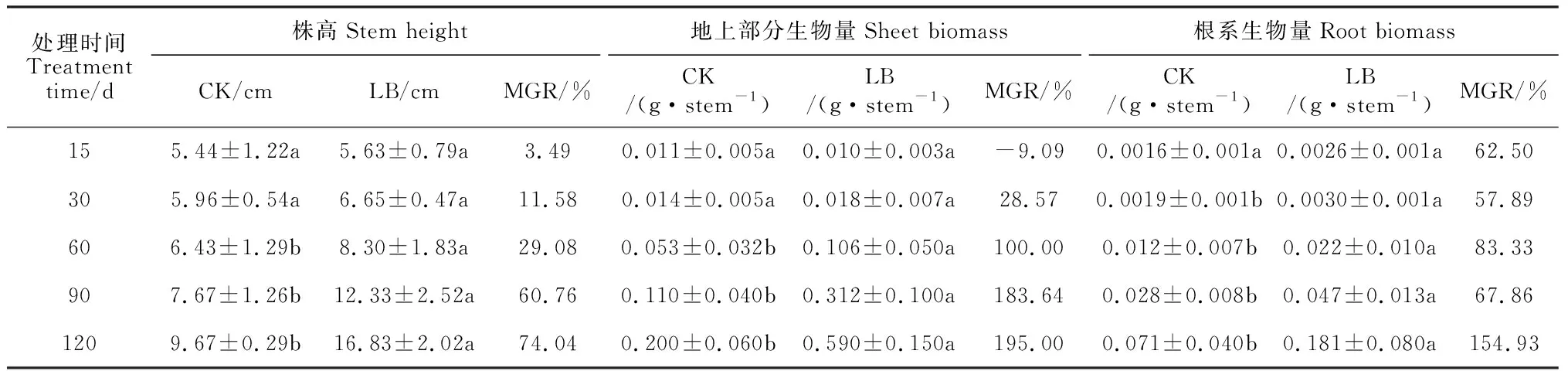
表1 不同处理下黑松株高和干生物量的动态变化
注:CK.不接菌对照;LB.接种双色蜡蘑;MGR.生长效应;同行不同小写字母表示处理间在0.05水平存在显著性差异 (P<0.05);下同Note: CK. Without inoculation; LB. Inoculation withLaccariabicolor; MGR. Mycorrhizal growth response; Different small letters within same row meant significant difference between treatments at 0.05 level (P<0.05). The same as below

图1 不同处理下黑松根系构型Fig.1 Root system architecture of P. thunbergii seedlings under different treatments
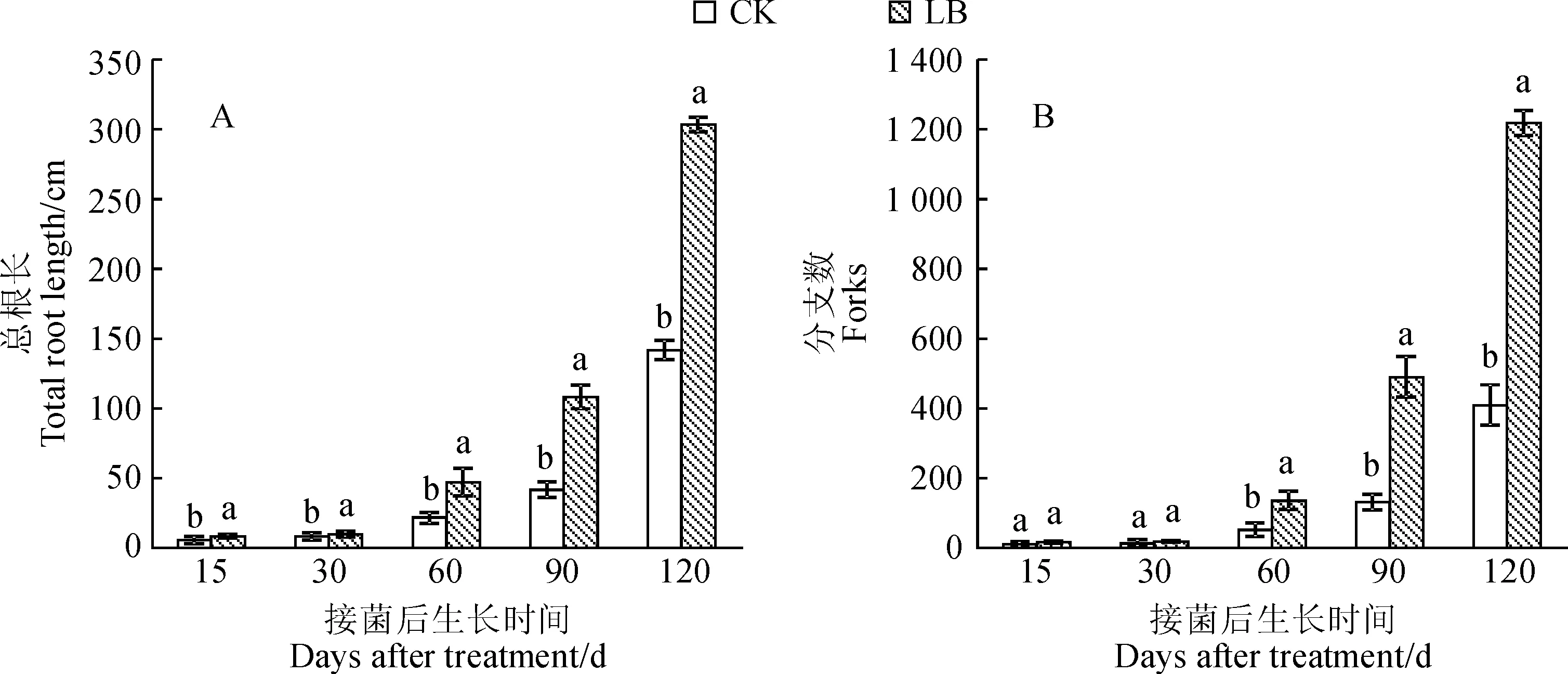
图中不同小写字母表示同期处理间差异显著(P<0.05),下同。图2 不同处理下黑松幼苗根系总根长和分支数Different small letters within same stage meant significant difference among treatments at 0.05 level. The same as below.Fig.2 Total root length and forks of P. thunbergii seedling under different treatments
2.3 双色蜡蘑对黑松根系表面积和体积的影响
不同处理根系表面积的变化趋势与总根长基本一致(图3,A)。在实验过程中,接种双色蜡蘑处理黑松幼苗的根系表面积均不同程度高于未接种对照,其在接种15 d后就开始与对照组产生了显著的差异(P<0.05),并随着接种时间的延长均始终显著大于对照组。同时。在接种处理条件下,黑松幼苗根体积随着接种时间的延长逐渐增大(图3,B)。与不接种的对照组相比,接种处理根系体积在黑松生长各时间点均不同程度大于不接种对照;接种处理黑松苗根系体积在接种第15天时与对照组相比差异不显著,从接种第30天时起与对照组产生了显著的差异(P<0.05),其在接种第120天时根系体积(0.898 0 cm3)显著大于未接种CK(0.312 3 cm3)。
2.4 双色蜡蘑对黑松根系分形特征的影响
植物根系形态的分形维数直接反映了植物根系在不同生长环境影响下发育程度的差异[35]。植物根系越发达,分支越多,分形维数越高,而较小的分形维数反映出根系的分生能力相对较弱[36-37]。从图4可知,接种处理和对照黑松幼苗根系分形维数均随着接种时间逐渐增加,但接种双色蜡蘑处理菌根苗根系分形维数在接种后不同时期均不同程度高于未接种对照(P<0.05),其在接种后15 d、30 d时与对照组分形维数无显著差异(P>0.05),而其从接种第60~120天根系分形维数均显著高于对照组。说明接种双色蜡蘑促进了黑松根系主根与侧根的生长,使根系变得更为发达。
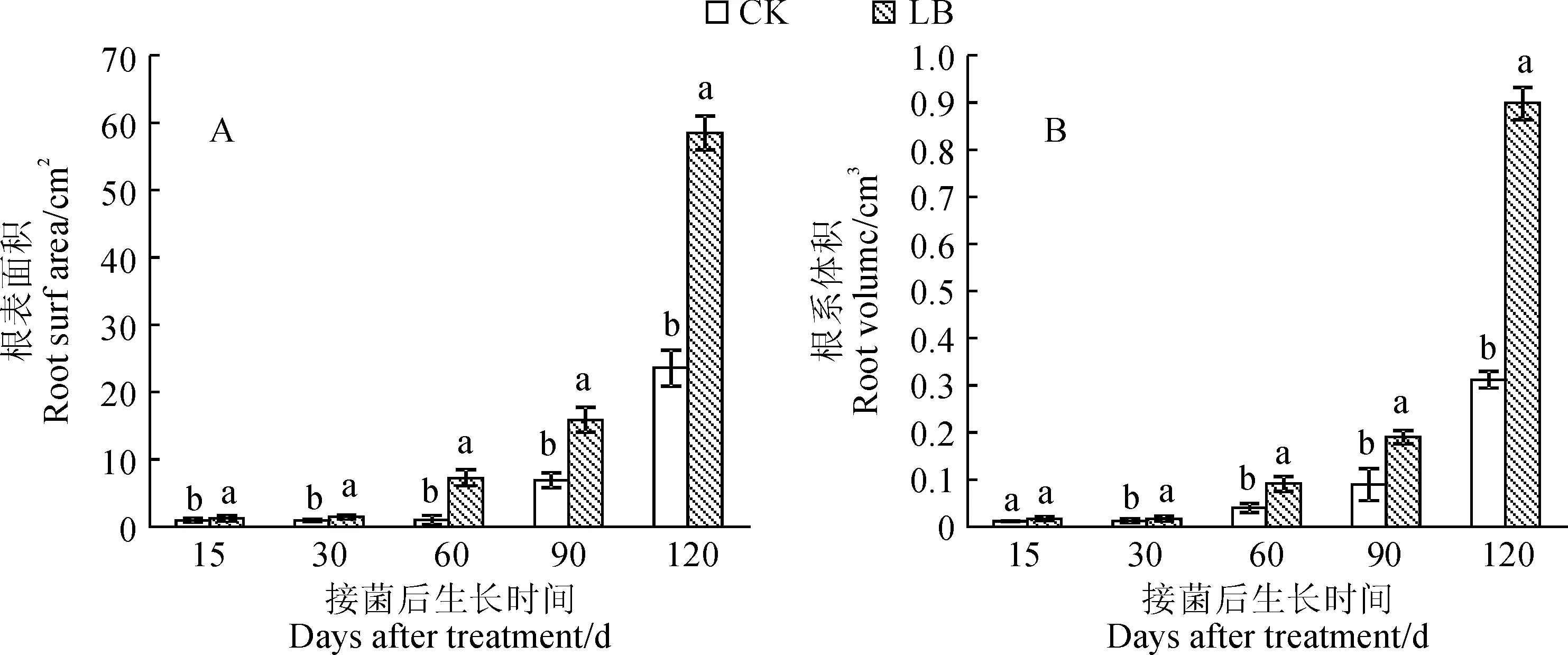
图3 不同处理下黑松幼苗根系表面积和体积Fig.3 Total root surface area and volume of P. thunbergii seedling under different treatments
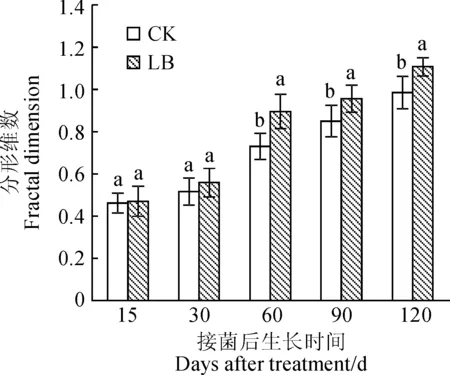
图4 不同处理下黑松幼苗根系的分形维数Fig.4 Fractal dimension of root of P. thunbergii seedlings under different treatments
3 讨 论
研究表明,双色蜡蘑能促进植物的生长,辜夕容等证实双色蜡蘑对马尾松幼苗具有促生作用,能显著促进马尾松幼苗生长、增加养分吸收,并且接种双色蜡蘑不仅具有促进生长和改善营养的作用,还可以提高马尾松幼苗的抗铝能力[22]。Selosse等研究发现,与未接种的自然菌根树木相比,接种双色蜡蘑可以使花旗松木材总产量增加60%[31]。本研究表明,在双色蜡蘑与黑松互作过程中,能够成功定殖于黑松根部,接种双色蜡蘑促进了黑松幼苗地上植株、地下根系的生长及其生物量的积累,表现出明显的促生作用;在幼苗地上部分生物量、株高、根系分支数、分形维数等方面,其在接种后15 d和30 d时与对照组相比差异并不显著,但各个指标从接种后60 d开始显著受到促进作用;在根系生物量、根系体积方面,其在接种第30天时表现出与对照组的显著差异;而在根长、根系表面积方面,接种后15 d就与对照组产生了显著的差异。双色蜡蘑可以促进黑松的生长,且在对黑松苗生长的促进作用上,对根系发育的显著促进作用早于地上部分。这可能与双色蜡蘑可以产生生长素类物质促进植物生长发育有关[38]。
根系是植物从土壤中吸收水分和矿质营养的重要器官,良好的根系可促进植物生长发育,而根系形态可以直接反映根系的生长情况[39]。接种双色蜡蘑后,与对照相比,黑松幼苗根系形态参数都发生了明显的变化。已有研究发现,菌根真菌与宿主植物形成菌根共生体之后,有利于根系碳库的积累,特别是葡萄糖含量的提高,这为根系发育提供了代谢底物,有利于根系构型的建立[10],可以诱导植物根系形态发生显著变化[21],造成根系分支数增多,使根系形成更高级的次根,增加根长和直径[19-21]。吴小芹等[40]发现,接种菌根菌后可促进黑松主根长、侧根总级数、分支数等根系参数不同程度地增加。本研究表明,接种双色蜡蘑的黑松幼苗根系形态参数如根系总长度、分支数、表面积和体积显著高于不接种菌根菌的对照,并使根系分形维数增大,且所有参数在接种120 d时均表现为接种处理大于未接种处理。这说明双色蜡蘑能促进黑松幼苗根系形态的构建,具有正向促进效应,且随着接种时间的延长,其促进作用更加明显。双色蜡蘑使根系变得发达,增加了根系的表面积和体积。
综上所述,双色蜡蘑能够成功定殖于黑松根部,促进了黑松幼苗地上、地下部的生长及其生物量的积累,同时显著促进根系形态参数如根系总长度、分支数、表面积和体积增加,并使根系分形维数增大,表现出明显的促生作用,且双色蜡蘑对黑松幼苗根系发育的显著促进作用早于地上部分。这可能与双色蜡蘑产生的促进植物生长的激素首先与根系接触有关,这需要在今后深入研究各时间段的侵染率、养分、激素的动态变化状况等,进一步阐明双色蜡蘑对黑松的促生作用机理。
