抗人PD-L1单克隆抗体的瞬转表达
2018-07-19史晶莹吴丛梅殷玉和
史晶莹, 郭 晶, 李 雪, 董 雪, 孙 博, 吴丛梅, 殷玉和
(1. 长春工业大学 化学与生命科学学院, 长春 130012; 2. 吉林大学 生命科学学院, 长春 130012)
程序性死亡配体1(PD-L1)是一种相对分子量约为53 000的Ⅰ型跨膜蛋白[1]. PD-L1与其程序性死亡受体1(PD-1)结合, 其分子途径是共信号通路的负调节剂[2-4], 作为细胞检查点能抑制针对癌症的炎症和免疫应答[5]. 在肿瘤的微环境中, 激活PD-1/PD-L1通路可导致免疫抑制并介导肿瘤细胞免疫逃逸[6-8]. 目前, PD-L1抗体药物研发已成为抗肿瘤药物研究的热点. PD-L1抗体的常用转染方式分为瞬转和稳转, 表达PD-L1抗体宿主细胞主要有HEK293和CHO等[9]. 在转染方式上, 稳转比瞬转产量高, 但其过程较长, 费用较高, 不适合高效小规模表达抗体蛋白[10]; 瞬时转染重组DNA不与染色体上的DNA整合, 可在较短时间内得到由重组DNA表达的产物, 且基因拷贝数和转染效率相对稳定[11], 适用于抗体药物前期的研发. HEK293细胞与CHO细胞相比, 具有生长速率快并提高抗体表达量等优点[12], HEK293 6E细胞是腺病毒核抗原转入HEK293细胞中, 二者基因发生整合, 其稳定表达能增强巨细胞病毒(CMV)启动子后的外源基因转录能力的腺病毒13SEla蛋白[13]. 通过基因整合的HEK293 6E细胞能更高效表达抗体蛋白. 由EBNA病毒改造的HEK293 6E与含有OriP元件的pTT5载体结合可导致核定位. 由于载体通过核孔进入细胞核能加大外源基因与细胞基因组整合[14], 因此无血清悬浮培养的HEK293 6E细胞与对应的pTT5载体更适于研究抗体表达.
本文通过无血清培养HEK293 6E悬浮细胞, 筛选适合HEK293 6E细胞生长和表达的最佳培养基, 在此基础上优化瞬时转染条件, 最终获得高质量浓度的PD-L1抗体, 成功建立了无血清悬浮培养HEK293 6E细胞瞬转表达PD-L1抗体体系.
1 材料与方法
1.1 材 料
1.1.1 细胞与质粒 HEK293 6E细胞与已构建好的以pTT5为载体抗体轻重链质粒, 由长春工业大学细胞生物学实验室保存.
1.1.2 培养基与试剂 FreeStyleTMF17无血清细胞培养基购于美国Thermofisher公司; A,B,C无血清细胞培养基均为国产培养基; 聚醚酰亚胺(PEI, 货号23966-2)购于美国Polysciences公司; PD-L1蛋白购于北京义翘神州公司; 羊抗人IgG-HRP和TMB(3,3′,5,5′-四甲基联苯胺)底物显色液购于北京索莱宝公司; 无内毒素大提试剂盒购于北京天根生化科技有限公司.
1.2 方 法
1.2.1 HEK293 6E细胞无血清悬浮培养 在显微镜下观察细胞状态: 取20 μL细胞培养物进行计数, 确定活率>90%, 细胞密度为0.8~1.0×106个/mL. 将细胞稀释至0.5×106个/mL培养, 摇瓶中的培养液体积为培养瓶总体积的20%. 标记细胞类型、代次、日期和来源后, 将培养瓶放入CO2摇床(瑞士Infors公司), 于120 r/min, 37 ℃,φ(CO2)=5%悬浮培养. 细胞培养的传代密度不大于2.0×106个/mL.
1.2.2 无内毒素质粒提取 按照无内毒素大提试剂盒说明书操作.
1.2.3 HEK293 6E细胞生长培养基的筛选 将HEK293 6E细胞通过FreeStyleTMF17,A,B,C无血清培养基进行培养, 每天记录活细胞密度、细胞活率, 并观测细胞的生长周期.
1.2.4 HEK293 6E表达培养基的筛选及抗体蛋白表达 以FreeStyleTMF17和A无血清培养基转染, 每天记录活细胞数和细胞活率, 并收集细胞表达的上清液, 用ELISA方法检测抗体蛋白的质量浓度.
1.2.5 PD-L1抗体瞬转表达条件优化 将表达PD-L1抗体的质粒用PEI共转染到 HEK293 6E细胞株中, 优化转染密度、质粒DNA与PEI的质量比及最佳收获时间等实验条件. 将转染密度稀释为1×106,2×106,4×106个/mL. 每天记录活细胞数和细胞活率, 并收集细胞表达的上清液, 用ELISA方法检测抗体蛋白的质量浓度. 将筛选的最佳转染密度用于筛选DNA与PEI的质量比. 先设定m(DNA)∶m(PEI)=1∶1,1∶2,1∶5,2∶1,3∶1, 再进行转染, 每天记录细胞活率和活细胞数, 并离心细胞上清液. 用ELISA检测细胞上清液中抗体蛋白的表达量, 以确定最佳收获时间.
1.2.6 抗体蛋白的纯化及ELISA鉴定 将收获的细胞培养上清液经Protein A亲和层析柱纯化. 先用10倍柱体积的结合缓冲液(20 mmol/L Na2HPO4, 0.15 mol/L NaCl, pH=7.0)平衡层析柱; 再上样, 样品为经过离心及0.45 μm滤膜过滤的细胞表达上清液, 流速为1 mL/min; 最后加入洗脱缓冲液(0.1 mol/L甘氨酸盐酸缓冲液, pH=2.7)洗脱. 用4 mL EP管收集洗脱的样品, 2.4 mL/管, 每个EP管内需预先加入中和缓冲液(pH=9.0, 1 mol/L Tris-HCl)600 μL. 用SDS-PAGE蛋白电泳胶进行分析. 利用30 000蛋白超滤管浓缩, 将SDS-PAGE电泳图中的蛋白通过Quantity One软件进行纯度测定. 利用间接ELISA法定量抗体的质量浓度. PD-L1蛋白溶于包被液中包被96孔板, 于4 ℃过夜, 磷酸盐吐温缓冲液(PBST)洗涤96孔板3次后, 用含质量分数为5%的牛血清蛋白(BSA)的包被液封闭2 h, 以纯化已知质量浓度的PD-L1抗体为标准抗体, 加入连续稀释的样品, 在37 ℃温育1 h后, 与羊抗人IgG-HRP结合, 最后TMB显色, 用2 mol/L H2SO4终止. 用酶标仪检测450~650 nm处的吸光度, 并进行数据处理.
2 结果与讨论
2.1 HEK293 6E细胞生长培养基的筛选
采用A,B,C及FreeStyleTMF17四种无血清细胞培养基对HEK293 6E细胞进行培养, 细胞的生长变化如图1所示. 由图1可见: 在B和C无血清细胞培养基, 随着培养时间的增长, HEK293 6E细胞的细胞活率显著下降, 活细胞数缓慢增长后下降; 在FreeStyleTMF17和A无血清细胞培养基中, HEK293 6E细胞随培养时间的增长而增多, 细胞倍增时间分别为37,33 h, 细胞活率最高均大于95%, 活细胞数在第6天达到最高, 为5.81×106个/mL. 表明HEK293 6E细胞更适合在FreeStyleTMF17和A无血清生长液中悬浮培养. 因此选择FreeStyleTMF17和A无血清培养基在转染实验中作为表达培养基, 进而比较瞬时转染PD-L1抗体的表达量.

图1 在不同培养基中培养的HEK293 6E细胞的活细胞密度(A)和细胞活率(B)Fig.1 Cell densities (A) and sell viability (B) of HEK293 6E cells cultured in different culture media
2.2 HEK293 6E表达培养基的筛选及抗体蛋白表达
在FreeStyleTMF17和A无血清培养基中表达抗体, 每天记录活细胞数和细胞活率, 并收集细胞表达的上清液, 用ELISA方法检测抗体蛋白的质量浓度, 结果如图2所示. 由图2可见: 两种表达培养基中抗体的表达量均随细胞数目的增加而增加, 在第5天表达量最高; FreeStyleTMF17培养基中最高活细胞密度为3.99×106个/mL, 表达量为60.7 μg/mL; A培养基中最高活细胞密度为5.59×106个/mL, 表达量为83.2 μg/mL, 并且A培养基价格低廉, 因此在后续实验中均选用A无血清培养基进行细胞培养.
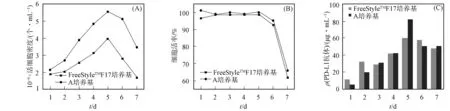
图2 FreeStyleTMF17和A培养基中HEK293 6E细胞的细胞密度(A)、细胞活率(B)及1~7 d的PD-L1抗体质量浓度(C)Fig.2 Cell densities (A), cell viability (B) and 1—7 d PD-L1 antibody mass concentrations (C) of HEK293 6E cells in FreeStyleTMF17 and A culture media
2.3 PD-L1抗体瞬转表达条件优化
将转染细胞密度稀释为1×106,2×106,4×106个/mL, 每天记录活细胞数和细胞活率, 并收集细胞表达的上清液, 用ELISA方法检测抗体蛋白的质量浓度, 结果如图3所示. 将筛选最佳转染的细胞密度用于筛选DNA与PEI的质量比. 设定m(DNA)∶m(PEI)=1∶1,1∶2,1∶5,2∶1,3∶1, 每天记录活细胞数和细胞活率, 并收集细胞表达的上清液, 用ELISA方法检测抗体蛋白的质量浓度, 结果如图4所示. 由图3和图4可见, 当转染细胞密度为2×106个/mL时, 抗体表达量达到最高, 为132.8 μg/mL, 其中m(DNA)∶m(PEI)=1的细胞活率和抗体表达量最理想, 第4天表达量最高, 为170.9 μg/mL. 即细胞密度为2×106个/mL,m(DNA)∶m(PEI)=1为最佳转染条件, 第4天为最佳收获时间, 其PD-L1抗体表达量为未经转染抗体表达量的2倍.
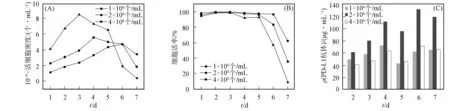
图3 不同转染密度的活细胞密度(A)、细胞活率(B)及PD-L1抗体质量浓度(C)随转染时间的变化Fig.3 Cell densities (A), cell viability (B) and PD-L1 antibody mass concentrations (C) of different transfection densities varied with transfection time

图4 DNA和PEI不同质量比的活细胞密度(A)、细胞活率(B)及PD-L1抗体质量浓度(C)随转染时间的变化Fig.4 Cell densities (A), cell viability (B) and PD-L1 antibody mass concentrations (C) of different mass ratios of DNA and PEI varied with transfection time
2.4 抗体蛋白的纯化及ELISA鉴定
PD-L1抗体经Protein A亲和层析柱纯化后, 用SDS-PAGE凝胶电泳分析纯度, 结果如图5所示. 样品及结合缓冲液pH=7.0. 由图5(A)可见, 洗脱峰在280 nm处吸收值较高, 表明有蛋白洗脱; 由图5(C)可见, 还原性条件1,2泳道均得到2个条带, 分别在50 000,25 000附近, 与抗体轻链和重链分子量相符, 其纯度大于90%. 经ELISA鉴定, 浓缩后PD-L1抗体质量浓度为3 mg/mL.
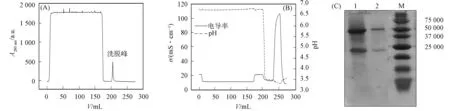
图5 纯化PD-L1抗体的紫外光谱(A)、电导率和pH值(B)及其SDS-PAGE凝胶电泳图(C)Fig.5 UV spectrum (A), conductivity and pH value (B) and SDS-PAGE gel electrophoresis (C) of purified PD-L1 antibody
综上, 本文筛选了适合HEK293 6E细胞最佳的生长和表达培养基, 使表达量提高至83.2 μg/mL, 在此基础上优化瞬时转染条件. 结果表明, 当转染密度为2×106个/mL,m(DNA)∶m(PEI)=1时为最佳瞬转条件, 第4天为最佳收获时间, 使表达量提高至170.9 μg/mL. 通过对其表达的PD-L1抗体进行纯化及ELISA鉴定, 得到了纯度大于90%的PD-L1抗体, 可满足后续抗体研究的需求, 成功建立了一个成本低、操作便利的PD-L1抗体瞬时表达体系.
