木瓜蛋白酶和碱性蛋白酶水解制备绿豆多肽
2018-07-19吴卓夫张斯童
吴卓夫, 李 萌, 张斯童, 陈 光
(吉林农业大学 生命科学学院, 吉林省秸秆综合利用技术创新平台, 长春 130118)
绿豆分离蛋白经水解后获得的绿豆多肽具有抗氧化[1-3]、降血脂、降胆固醇[4]、降血压[5-6]、改善动脉顺应性和内皮功能[7]、防止肥胖[8]等功效. 作为天然抗氧化剂, 绿豆多肽能有效延长食物的储存期. 绿豆多肽在生理上优于完整的蛋白质, 更易于被人体有效吸收[9]. 绿豆多肽的生物学功能常受多肽中氨基酸序列组成和分子量、所用水解方法及肽回收方法的影响[10].
目前, 从绿豆分离蛋白制备绿豆多肽的主要方法是酸水解法. 酸水解法具有反应高效、水解彻底、获得的产品风味极佳等优点, 但在强酸(浓盐酸)水解绿豆蛋白过程中, 易产生氯代醇(如3-氯-1,2-丙二醇(MCPD)和1,3-二氯-2-丙醇(DCP))等致癌物质[11]. 采用酶水解法[12-13]更安全、温和. 酶水解过程很少或无不良的副反应发生, 不涉及化学药品使用, 制备条件更安全, 产物中不含致癌物质, 可产生特殊风味的物质. 此外, 生化技术的发展也促进了新的酶水解绿豆蛋白产品的研发[14].
木瓜蛋白酶属于巯基蛋白酶, 可水解绝大多数肽键, 但对不同肽键水解的速率相差较大, 该酶对蛋白质或多肽中精氨酸、赖氨酸、苯丙氨酸的羧基形成的肽键非常敏感[15-18]. 碱性蛋白酶是一种内切蛋白酶, 该酶可特异性切割谷氨酰胺—组氨酸、丝氨酸—组氨酸、亮氨酸—酪氨酸、酪氨酸—苏氨酸之间的肽键[19]. 此外, 碱性蛋白酶操作安全性较高, 符合多种机构的食品级标准[20]. 由于木瓜蛋白酶和碱性蛋白酶均有各自专属的肽键切割位点, 其水解活力均较高, 因此可将这两种酶组合使用, 以对绿豆分离蛋白进行有效水解. 此外, 绿豆分离蛋白致密的分子结构将对酶的水解产生较强的抗性[4,21], 因而采用顺序水解的方法实现绿豆蛋白的高效水解, 并在单因素实验的基础上, 利用正交实验设计对碱性蛋白酶的水解条件进行优化, 为高效水解绿豆分离蛋白制备绿豆多肽提供理论依据.
1 材料与仪器
1.1 仪 器
电热恒温鼓风干燥箱(101-2-85-Ⅱ型, 上海跃进医疗器械厂); 高速粉碎机(RT-02型, 台湾弘荃机械企业有限公司); 100目筛子(上虞市道墟仪器筛具厂); 电子天平(AL204-IC型, 瑞士梅特勒托利多仪器有限公司); 磁力加热搅拌器(CJJ-931型, 江苏金坛市金城国胜实验仪器厂); 电热恒温水浴锅(TDA-8002型, 天津市泰斯特仪器有限公司); 精密pH计(E-201-C-9型, 上海越磁电子科技有限公司); 恒温震荡摇床(KYC-100B型, 上海新苗医疗器械制造有限公司); 电磁炉(KLX-20型, 中山市科立信电子电器有限公司); 台式高速低温离心机(D-37520型, 德国Sigma公司); 冷冻干燥机(ALPHR1-4LSC型, 德国Christ公司); 喷雾干燥机(MSD-1.0型, 德国Christ公司); Millipore超滤系统(01730型, 上海艾研生物科技有限公司).
1.2 试 剂
绿豆(购于长春市某农贸市场); 碱性蛋白酶(上海楷洋生物技术有限公司); 木瓜蛋白酶(北京鼎国昌盛生物技术有限责任公司); NaOH,HCl(分析纯, 北京化工厂).
2 实 验
2.1 绿豆分离蛋白的制备
用碱提酸沉法制备绿豆分离蛋白[22]: 先将绿豆用高速粉碎机研磨成60目的粉末, 再将质量分数为5%的绿豆粉在水中用1 mol/L NaOH调节pH=9.0, 10 ℃下与磁力搅拌器混合30 min. 为了增加蛋白的产量, 对残余物进行重复萃取, 离心合并提取物, 用1 mol/L HCl调节pH=4.5以沉淀蛋白质. 在10 ℃条件下, 离心10 min回收蛋白质, 用蒸馏水洗涤所得蛋白质凝乳的表面. 将凝乳用蒸馏水重新分散, 再次离心, 最后冷冻干燥.
2.2 木瓜蛋白酶的水解
先用木瓜蛋白酶对绿豆分离蛋白进行水解[23]: 配制适量的绿豆分离蛋白溶液, 调节pH=7.0; 再在45 ℃下, 加入适量的木瓜蛋白酶触发水解反应; 反应4 h后, 将样品置于沸水浴中15 min, 确保木瓜蛋白酶失活; 最后将上述绿豆蛋白水解液在室温下冷却, 置于4 ℃冰箱待用.
2.3 碱性蛋白酶水解条件的筛选
用碱性蛋白酶继续水解上述样品, 利用单因素实验筛选水解体系的pH值、酶与底物的质量比(E/S比)、水解温度、底物质量分数等因素的最佳值.
1) 筛选水解体系pH值. 在保持绿豆分离蛋白质量分数为7%、温度50 ℃、E/S比=7%的条件下, 考察水解体系pH=7.5,8.0,8.5,9.0,9.5时的水解度.
2) 筛选E/S比. 在保持水解体系pH=9.5、绿豆分离蛋白质量分数为7%、温度50 ℃的条件下, 考察在E/S比为5%,6%,7%,8%,9%下的水解度.
3) 筛选水解温度. 在保持水解体系pH=9.5、E/S比=8%, 绿豆分离蛋白质量分数为7%的条件下, 考察温度为45,50,55,60,65 ℃时的水解度.
4) 筛选绿豆分离蛋白的质量分数. 在保持水解体系pH=9.5、温度55 ℃、E/S比=8%的条件下, 考察绿豆分离蛋白质量分数为5%,6%,7%,8%,9%时的水解度.
先将水解后的样品置于沸水浴中15 min, 以确保碱性蛋白酶彻底丧失活力, 再在室温下冷却, 离心收集上清液. 采用pH-stat法测定上清液中绿豆蛋白的水解度(degree of hydrolysis, DH)[24].
2.4 正交实验优化碱性蛋白酶水解条件
基于单因素实验结果, 利用4因素3水平正交实验考察水解体系的pH值(A)、底物质量分数(B)、酶与底物的质量比(C)、水解温度(D)对水解度的影响, 确定最佳水解条件, 结果列于表1.
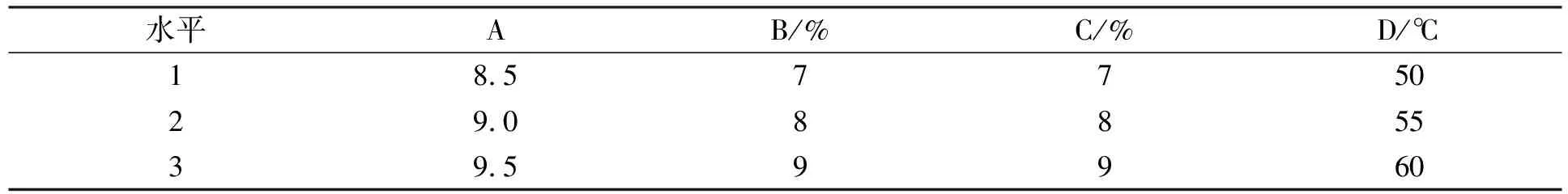
表1 L9(34)正交实验因素与水平
2.5 绿豆多肽的分离纯化
配制质量分数为5%的绿豆多肽水解液, 先将其透过截留分子量为5 000的超滤膜, 操作压力为0.18 MPa, 再将滤过液透过截留分子量为1 000的超滤膜, 操作压力为0.21 MPa, 最后利用考马斯亮蓝法测定不同截留组分中多肽的质量分数[25], 将分离后的绿豆多肽冷冻干燥.
3 结果与讨论
3.1 pH值对水解度的影响
通常, 偏酸或偏碱的环境会破坏酶的空间构象, 导致酶的可逆或不可逆变性, 从而影响酶的催化活力. pH值对碱性蛋白酶水解绿豆分离蛋白动力学曲线的影响如图1所示. 由图1可见: 当水解体系的pH=7.5~9.5时, 水解度随水解体系pH值的增加而逐渐增加; 当水解体系的pH=9.5时, 水解度达最大, 与文献[26]研究结果一致. 因此在后续的单因素实验中, 选择水解体系的pH值均为9.5.
3.2 E/S比对水解度的影响

图1 pH值对碱性蛋白酶水解绿豆分离蛋白动力学曲线的影响Fig.1 Effects of pH values on kinetic curves of isolated mung bean protein by hydrolysis of alcalase
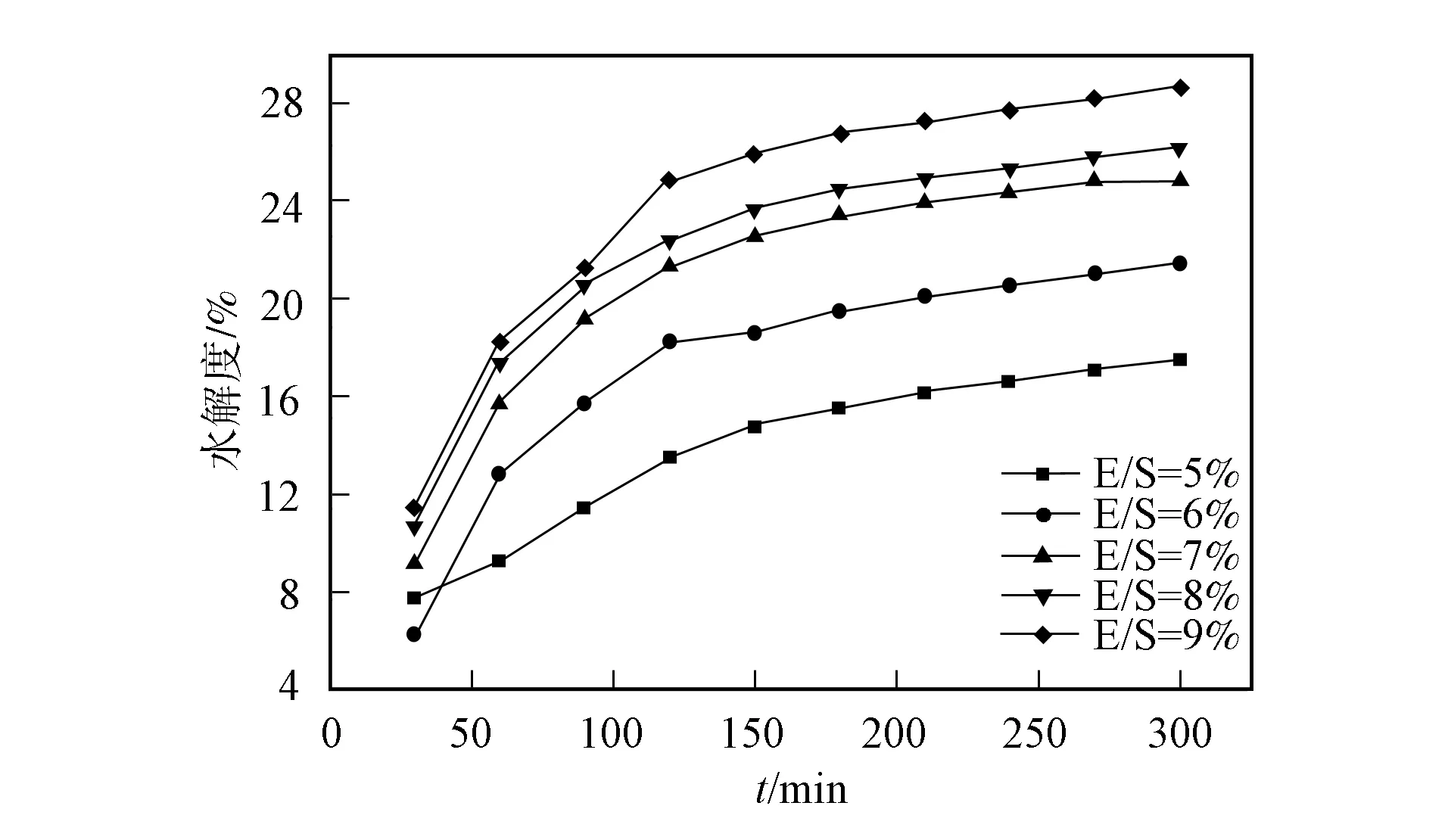
图2 E/S比对碱性蛋白酶水解绿豆分离蛋白动力学曲线的影响Fig.2 Effects of E/S ratios on kinetic curves of isolated mung bean protein by hydrolysis of alcalase
E/S比对碱性蛋白酶水解绿豆分离蛋白动力学曲线的影响如图2所示. 由图2可见, 当E/S比为5%~9%时, 水解度随E/S比的增加而增加; 当E/S比为9%时, 水解度达到最大. 在E/S比较低的情形下, 由于底物的可获得性, 因此碱性蛋白酶最初攻击在整个水解期间连续水解键中最敏感的肽键[27]. 随着E/S比的增加, 碱性蛋白酶的质量分数逐渐增大, 水解速率加快. 当E/S比大于8%时, 绿豆分离蛋白水解的趋势变缓, 表明碱性蛋白酶自身可能发生了水解反应[28]. 因此在后续单因素实验中, 选择E/S比为8%.
3.3 水解温度对水解度的影响
温度对碱性蛋白酶水解绿豆分离蛋白水解动力学曲线的影响如图3所示. 由图3可见, 碱性蛋白酶在55 ℃下的水解度最高. 当温度较低时, 碱性蛋白酶与蛋白分子运动的速率均较低, 不利用碱性蛋白酶水解蛋白; 当温度较高时, 碱性蛋白酶部分失活, 导致活力损失[29], 与文献[30]的研究结果一致. 因此在后续的单因素实验中, 选择体系的温度为55 ℃.
3.4 绿豆蛋白底物质量分数对水解度的影响
底物的质量分数对碱性蛋白酶水解绿豆分离蛋白动力学曲线的影响如图4所示. 由图4可见, 当绿豆分离蛋白底物的质量分数较小时, 水解度随其质量分数的增加而逐渐增加, 当其质量分数为8%时, 水解率达到最大, 这是由于碱性蛋白酶与绿豆分离蛋白之间的接触几率增大[31]所致. 当底物的质量分数为9%时, 水解度下降, 这是由于溶液黏度的增加影响了绿豆分离蛋白向碱性蛋白酶的扩散[32]所致.
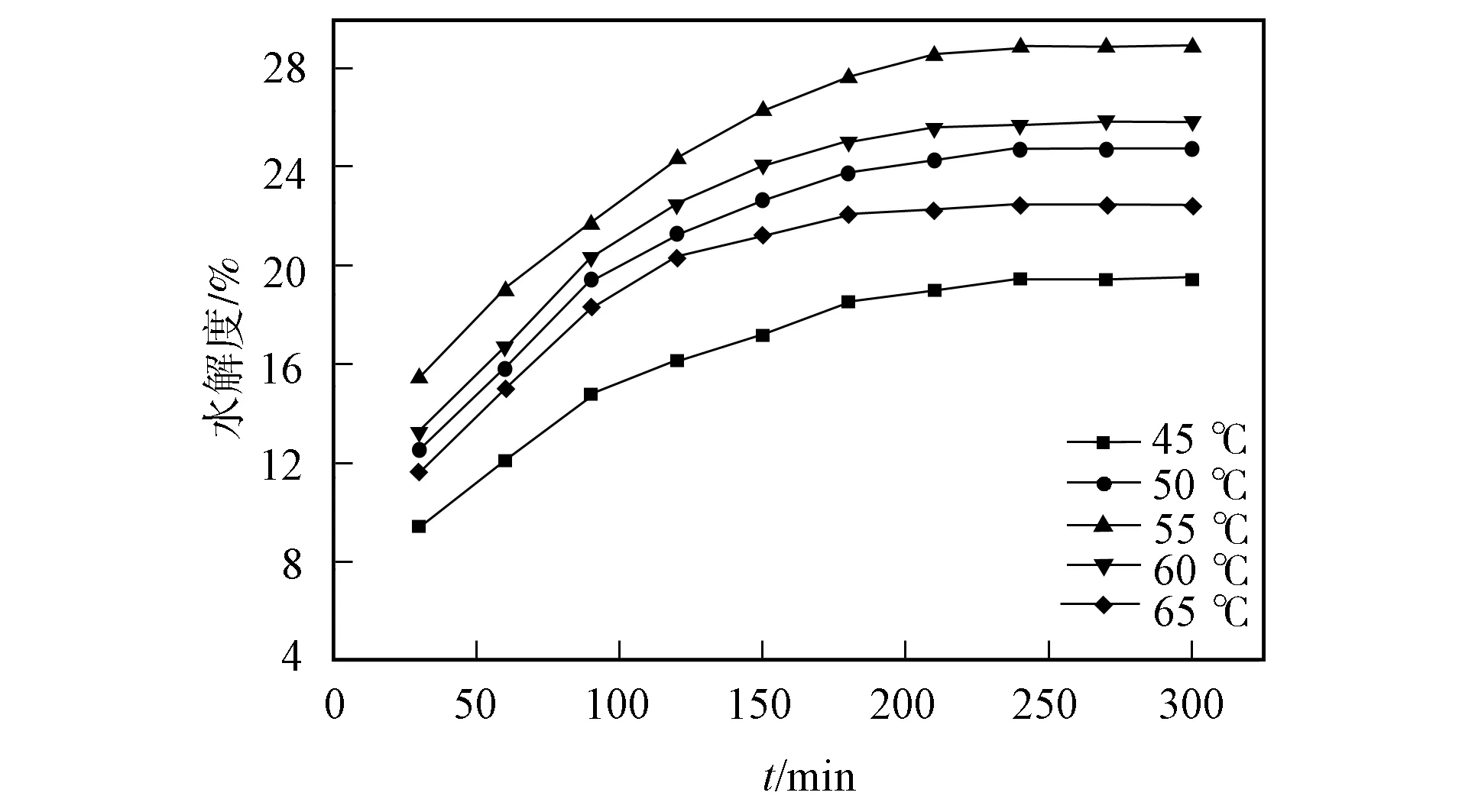
图3 温度对碱性蛋白酶水解绿豆分离蛋白水解动力学曲线的影响Fig.3 Effects of temperatures on kinetic curves of isolated mung bean protein by hydrolysis of alcalase
图4 底物的质量分数对碱性蛋白酶水解绿豆分离蛋白动力学曲线的影响Fig.4 Effects of mass fractions of substrate on kinetic curves of isolated mung bean protein by hydrolysis of alcalase
3.5 正交实验
正交实验结果列于表2, 其统计分析结果列于表3, 其中:k1,k2,k3分别为表2中A,B,C,D各因素对应水平3个实验结果之和的平均值,R为极差, 即k1,k2,k3中的最大数与最小数之差.

表2 正交实验结果

表3 正交实验结果统计分析
由表2可见: 各参数对碱性蛋白酶水解绿豆分离蛋白水解度的影响大小为B>D>C>A, 即绿豆蛋白底物质量分数>水解温度>E/S比>pH值; 最优组合为B3D2C2A2, 即绿豆分离蛋白质量分数为8%, 水解温度为55 ℃, E/S比为8%, pH=9.0. 在最佳水解条件下反应, 可获得32.58%的水解度. 将胃蛋白酶、Flavourzyme蛋白酶、中性蛋白酶、木瓜蛋白酶、碱性蛋白酶分别用于绿豆分离蛋白的水解中, 其水解度最高为28.82%[23]. 可见, 通过木瓜蛋白酶与碱性蛋白酶之间的顺序水解工艺可获得较高的水解度.
绿豆分离蛋白水解液经超滤分离后, 得到分子量>5 000的绿豆多肽约为10.08%, 分子量1 000~5 000的绿豆多肽约为3.27%, 分子量<1 000的绿豆多肽约为86.65%. 分子量<1 000的绿豆多肽能显著激活乙醇脱氢酶的活力[33].
综上所述, 本文利用木瓜蛋白酶和碱性蛋白酶的顺序水解工艺制备绿豆多肽, 优化了反应条件, 使绿豆蛋白的水解度达32.58%, 表明该水解工艺在制备绿豆多肽中具有一定的应用前景.
