环磷酰胺联合激素改善系统性红斑狼疮患者免疫功能及炎性反应的研究
2018-07-16邹晓军
邹晓军
系统性红斑狼疮(Systemic lupus erythematosus,SLE)为临床常见的免疫系统疾病,主要表现为皮肤黏膜、骨骼肌肉的异常病变,并可累及全身,临床上主要表现为关节痛、肌无力、口腔溃疡以及体温异常等症状。该病主要好发于女性,尤以青壮年最为常见。严重的系统性红斑狼疮患者能够累及神经功能、肾功能,造成肾功能异常、损伤,影响患者的生活质量[1~3]。在SLE的治疗方面,临床上主要以糖皮质激素、免疫抑制剂为主。环磷酰胺作为一种免疫抑制剂,联合激素类药物用于SLE的治疗,能够有效控制患者病情,改善预后[4,5]。为进一步证实环磷酰胺联合激素在SLE治疗中的价值,本研究以90例SLE患者为研究对象,分别单独应用激素和激素联合环磷酰胺进行治疗,以比较其治疗效果,现报道如下。
1 材料与方法
1.1一般资料
1.1.1研究对象 选择2013年9月~2017年9月我院收治的90例系统性红斑狼疮患者作为研究对象,其中男21例,女69例,20例为重度患者,70例为中度患者,年龄 26~50 岁,平均(34.4±5.1)岁,病程1~5年,平均(3.2±0.8)年。经医院伦理委员会审核通过,遵循随机、对照、平行的试验原则,使用随机数字表法将所选90例系统性红斑狼疮患者分成两组:观察组(45例)、对照组(45例)。两组患者在性别、年龄、病程以及疾病严重程度等方面比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 两组患者的基本资料比较
1.1.2入组标准 ①符合美国风湿病协会在 1997年修订的《系统性红斑狼疮诊断标准 》中的4 项及以上[6];②本次研究前的3个月内未使用激素、免疫抑制类药物等;③无心脑血管、肝、肾等重要器官相关疾病;④无精神性疾病;⑤患者及其家属签署知情同意书,同意参与本研究。
1.1.3排除标准 ①对本研究中使用药物过敏的患者;②伴有其他风湿性疾病的患者;③治疗依从性较差的患者;④处于妊娠期、哺乳期的患者。
1.2方法 对照组口服泼尼松予以治疗,初始剂量为0.8mg/kg,1次/d,连用6周,之后随病情进展调整剂量(每周减少 2.5~5mg,最低为 5~10mg/d)。观察组应用泼尼松联合环磷酰胺予以治疗,泼尼松的用法与用量同对照组;500mg环磷酰胺溶解于500ml的生理盐水中,静脉滴注,每2周1次,连用6周,之后随病情进展调整滴注次数(最低为每月1次)。治疗12周后,对两组患者的相关指标进行比较分析。
1.3观察指标
1.3.1临床疗效 记录并比较两组患者的临床疗效。根据患者的临床症状及其相关指标的变化情况将疗效分为3级,即显效、有效、无效。显效为患者治疗后的临床症状基本消失,实验室指标基本恢复正常;有效为患者治疗后的临床症状明显改善,实验室指标显著改善,但未达到正常水平;无效为患者治疗后的临床症状、实验室指标未发生变化,甚至有所恶化。总有效率=(显效例数+有效例数)/总例数×100%。
1.3.2疾病活动指数 对患者治疗前后的疾病活动指数变化情况进行比较。SLE-DAI是美国和加拿大的多数风湿病专家所选出的疾病活动性评价项目,包括9个脏器病变,分为4级,经对24个项目的数量化后在10~15分时即表示有活动性。分值越高,疾病越严重。
1.3.3细胞免疫指标 对患者治疗前后的细胞免疫指标变化情况进行比较。T 细胞亚群的检测采用贝克曼尔特流式细胞仪(美国)进行,指标包括CD3+、CD4+、CD8+的变化情况。
观察组:该组患者在对照组护理的基础上加上主动护理,主动护理是在患者没有要求的情况下,在医嘱范围内主动进行护理,主要护理方式有以下几个方面:
1.3.4体液免疫指标 对患者治疗前后的体液免疫指标变化情况进行比较。血清 IgA、IgM、IgG的检测采用日立 7600-020 型生化分析仪(日本)以速率散射免疫比浊法进行,试剂盒来源于上海荣盛生物公司。
1.3.5炎性介质 对患者治疗前后炎性介质水平的变化情况进行比较。TNF-α、IL-6、INF-α的检测采用日立7600-020 型生化分析仪(日本)以酶联免疫吸附法(ELISA)进行,试剂盒来源于上海荣盛生物公司。
1.3.6肾功能 对患者治疗前后的肾功能指标变化情况进行比较。SCr、BUN、24h尿蛋白水平的检测采用Beckman Coulter AU680型全自动生化分析仪(美国)进行,试剂盒来源于上海荣盛生物公司。
1.3.7安全性评价 记录并比较两组患者治疗过程中出现的不良反应。
1.4统计学方法 采用SPSS 22.0统计学软件进行分析,对于符合正态分布的计量资料采用均数±标准差(±s)表示,组间比较行两独立样本t检验,治疗前后指标的比较行配对样本t检验;计数资料则采用率/构成比(%)表示,比较时采用χ2检验/Fisher确切概率法进行,检验水准α=0.05,以P<0.05为差异具有统计学意义。
2 结果
2.1两组患者的临床疗效比较 观察组治疗的总有效率为91.1%,对照组为75.6%,组间比较差异具有统计学意义(P<0.05),见表 2。

表2 两组患者临床疗效比较[n(%)]
2.2两组患者的疾病活动指数比较 两组的疾病活动指数均较治疗前显著下降(P<0.05),观察组下降更为显著(P<0.05),见表 3。
表3 两组患者治疗前后疾病活动指数比较(±s)

表3 两组患者治疗前后疾病活动指数比较(±s)
组别 例数 时间 疾病活动指数观察组 45 治疗前 22.43±4.33治疗后 3.68±0.76对照组 45 治疗前 21.74±5.32治疗后 8.27±1.14 t/P观察组内 28.611/0.000 t/P对照组内 16.608/0.000 t/P治疗后组间 22.473/0.000
表4 两组患者治疗前后细胞免疫功能比较(±s)

表4 两组患者治疗前后细胞免疫功能比较(±s)
组别 例数 时间 CD3+ CD4+ CD8+观察组 45 治疗前 45.42±5.20 18.89±2.15 40.23±5.10治疗后 53.19±5.23 25.28±2.94 31.95±3.58对照组 45 治疗前 45.69±4.85 19.08±2.67 40.92±4.63治疗后 49.74±4.16 22.36±3.35 35.29±3.14 t/P观察组内 7.067/0.000 5.848/0.000 8.914/0.000 t/P对照组内 4.252/0.000 10.472/0.000 6.751/0.000 t/P治疗后组间 3.463/0.000 4.395/0.000 4.705/0.000
2.4两组患者的体液免疫指标比较 两组患者治疗后的体液免疫指标均较治疗前显著改善(P<0.05),观察组改善更为显著(P<0.05),见表5。
表5 两组患者治疗前后的体液免疫功能比较(±s,g/L)
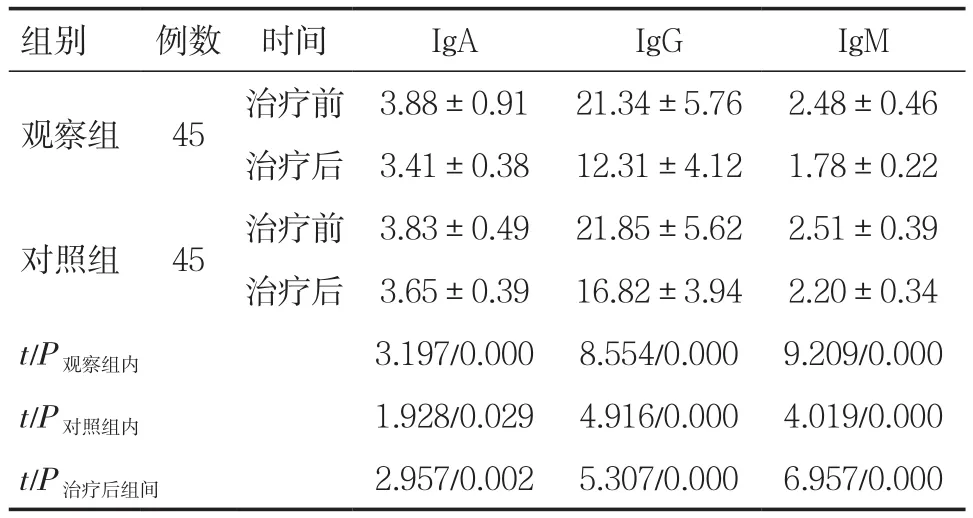
表5 两组患者治疗前后的体液免疫功能比较(±s,g/L)
组别 例数 时间 IgA IgG IgM观察组 45 治疗前 3.88±0.91 21.34±5.76 2.48±0.46治疗后 3.41±0.38 12.31±4.12 1.78±0.22对照组 45 治疗前 3.83±0.49 21.85±5.62 2.51±0.39治疗后 3.65±0.39 16.82±3.94 2.20±0.34 t/P观察组内 3.197/0.000 8.554/0.000 9.209/0.000 t/P对照组内 1.928/0.029 4.916/0.000 4.019/0.000 t/P治疗后组间 2.957/0.002 5.307/0.000 6.957/0.000
2.5两组患者的炎性介质比较 两组的炎性介质水平均较治疗前显著下降(P<0.05),观察组下降更为显著(P<0.05),见表 6。
表6 两组患者治疗前后的炎性介质水平比较(±s)

表6 两组患者治疗前后的炎性介质水平比较(±s)
组别 例数 时间 TNF-α(pg/ml) IL-6(ng/L) INF-α(ng/L)观察组 45 治疗前 49.12±10.17 41.85±9.26 5.05±1.03治疗后 26.19±8.56 13.26±6.27 2.51±0.36对照组 45 治疗前 48.83±11.4742.07±9.18 4.98±1.02治疗后 38.24±9.15 22.15±7.69 3.35±0.68 t/P观察组内 5.335/0.000 17.150/0.000 15.616/0.000 t/P对照组内 10.612/0.000 11.159/0.000 8.920/0.000 t/P治疗后组间 6.451/0.000 6.010/0.000 7.324/0.000
2.6两组患者的肾功能比较 两组患者治疗后的肾功能指标均较治疗前显著下降(P<0.05),观察组下降更为显著(P<0.05),见表 7。
表7 两组患者治疗前后的肾功能指标比较(±s)

表7 两组患者治疗前后的肾功能指标比较(±s)
组别例数时间SCr(μmol/L)BUN(mmol/L)24hpro(g/24h)观察组 45 治疗前 228.47±78.54 11.78±2.47 4.68±1.42治疗后 116.12±45.27 5.26±1.97 2.11±1.29对照组 45 治疗前 231.67±87.52 11.46±2.94 4.64±1.61治疗后 149.47±50.76 6.88±2.16 3.18±1.14 t/P观察组内 8.314/0.000 13.844/0.000 8.986/0.000 t/P对照组内 5.450/0.000 8.422/0.000 4.965/0.000 t/P治疗后组间 3.289/0.001 3.717/0.000 4.169/0.000
2.7两组患者治疗的安全性比较 两组患者在治疗过程中均未发生较为严重的不良反应,观察组总不良反应发生率为17.8%,对照组总不良反应发生率为20.0%,组间比较差异无统计学意义(P>0.05),见表 8。
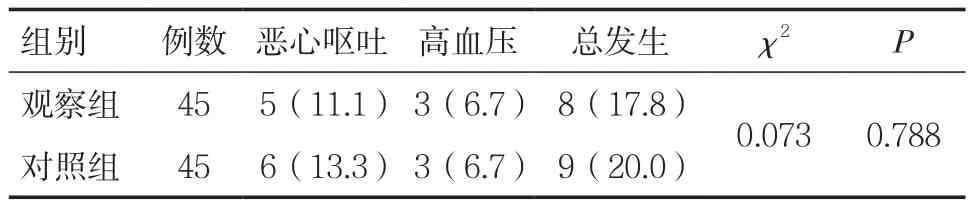
表8 两组患者治疗的安全性比较[n(%)]
3 讨论
系统性红斑狼疮(SLE)作为一种常见的自身免疫性疾病,主要好发于15~40岁的人群,尤以女性多见,严重的会损害患者的肾功能,导致严重后果,不利于患者正常生活。在SLE的治疗中,泼尼松为一种较为常用的糖皮质激素类药物,具有抗炎、抗过敏作用,能改善患者的病情,促进预后[7,8]。相关报道显示泼尼松联合免疫抑制剂治疗SLE能够进一步提高治疗效果,降低不良反应发生率[9,10]。基于此,本研究主要集中于泼尼松联合环磷酰胺对SLE的治疗作用及安全性,结果显示,观察组总有效率、疾病活动指数改善程度明显高于对照组,且不良反应未增加,这提示泼尼松联合环磷酰胺治疗SLE的有效性和安全性均较高,为该病的临床治疗提供了一定的理论依据。
SLE作为一种自身免疫性疾病,目前对其发病机制的了解仍然较为有限,一般认为可能与遗传、内分泌异常、感染以及免疫异常等有关。淋巴细胞的异常活化、抗体的大量存在是SLE发病的重要原因,同时也是相关并发症发生的重要因素,在患者其它脏器、组织的损害中发挥着一定的作用,常见的如肾损伤[11,12]。由此可见,对SLE患者免疫功能的调节在该病的治疗中有重要的意义。本研究中,两组患者的免疫功能都得到了改善,且观察组更为明显,这提示泼尼龙联合环磷酰胺更有助于SLE患者免疫功能的调节,提高疗效,促进预后。究其原因,主要在于泼尼松、环磷酰胺的免疫抑制作用,有助于免疫功能异常情况的改善,免疫蛋白水平的下降,且环磷酰胺能够通过对T淋巴细胞亚群的调节作用,促进T淋巴细胞水平的改变。
近年来,越来越多的认知表明SLE发病机制的研究对该病的治疗有重要的意义,在此基础上,炎性介质在SLE发生、发展中的作用引起了越来越多的注意。多种炎性介质在SLE的发生与发展中起一定的作用,如TNF-α、IL-6、INF-α,这些介质在该病的诊断及其预后判断中起着一定的作用。相关研究提示,INF-α对于SLE的发生可能起着重要的作用,但目前仍有争议[13,14]。白细胞介素在SLE中的作用亦未得到阐明,但一般认为其可以通过自我调控的方式介导自身免疫性反应,这对SLE的发生和发展可能起着一定的作用。TNF-α作为临床常用炎性介质,其水平在SLE患者中也会异常升高,但其对SLE的影响同样仍未清楚。虽然TNF-α、IL-6、INF-α在SLE发病中的作用仍未明确,但其水平均会异常升高,这对SLE的诊断、预后评价有着积极的参考意义。本研究中,两组治疗后的TNF-α、IL-6、INF-α均显著下降,提示这些介质在SLE病情判断中的价值,且观察组下降更为显著,这进一步提示激素联合免疫抑制剂治疗SLE的效果肯定,能够改善炎性反应,促进预后。
肾功能损伤为SLE患者的常见并发症,严重的可发展为肾炎,影响患者的肾功能,增加治疗难度[15]。因此,对于SLE患者肾功能的改善也有着积极的意义。本研究中,观察组肾功能的改善程度明显高于对照组,提示激素联合免疫抑制剂治疗SLE亦能够改善患者的肾功能,这对病情的改善以及避免相关肾脏并发症的发生有积极的临床意义,且有助于预后效果的提高,改善患者的生活质量。最后,在安全性方面,环磷酰胺的应用不会增加患者不良反应发生,在发挥有效治疗效果的同时,表现出较高的安全性。
总之,环磷酰胺联合泼尼松的应用,有助于SLE患者症状的缓解,免疫功能的恢复,炎性反应的控制,肾功能的改善,且不会增加治疗风险,是一种安全、有效的治疗方案,值得临床推广和应用。
