Lipocalin2真核表达载体的构建及在HK-2细胞中的表达
2018-07-16金立新陈明
金立新 陈明
脂质运载蛋白2(Lipocalin2,也被称作SIP24,24p3,或 NGAL),Lipocalin家族的新成员,是新近报道的调控E-cad表达的重要因子[1],在维持肾小球基底膜的正常代谢功能,促进胚胎间充质细胞向肾小管上皮细胞分化及哺乳动物近端肾单位发育过程中的间充质-上皮转换过程中起重要作用。然而,Lipocalin2可否通过调节E-cad的表达而抑制TEMT过程,从而抑制肾小管间质纤维化值得进一步研究。我们根据基因文库中Lipocalin2基因(登录号BC033089)的cDNA序列设计引物,扩增Lipocalin2基因全编码区,定向克隆入质粒pEGFP-C3 中,利用脂质体(Lipofectamine 2000 Reagent)介导,将重组质粒转染入HK-2细胞中,为进一步研究Lipocalin2在人肾近曲小管上皮细胞转分化的作用及机制奠定基础。
1 材料与方法
1.1实验材料 人肾近曲小管上皮细胞株(HK-2),来源于American Type Culture Collection (ATCC)由重庆医科大学肾内科惠赠。限制性内切酶Bam H I、Xho I、T4 DNA 连 接 酶、DL2000DNA marker、pEGFP-C3载体、Lipofectamine 2000 Reagent均购自Invitrogen公司, 抗人Lipocalin2单抗购自R&D公司;RNA提取试剂盒、RT-PCR试剂盒、质粒抽提试剂盒、DNA凝胶纯化试剂盒、琼脂粉、抗生素购自北京Tiangen公司;胰蛋白胨和酵母粉提取物为美国Gibco公司产品。大肠杆菌DH5a菌株(泸州医学院中心实验室常规保存)。
1.2实验方法
1.2.1lipocalin2基因的合成 根据已经报道的Lipocalin2基因的cDNA序列(基因文库登录号BC033089)设计引物,扩增Lipocalin2基因全编码区,全长597bp。根据Lipocalin2基因和真核表达载体pEGFP-C3的基因序列、蛋白编码框架及起始、终止密码子的位置,选用Xho I 、Bam H I作为亚克隆时酶切位点,引物设计如下:

PCR扩增目的基因,电泳鉴定后,参照天根公司的普通琼脂糖凝胶DNA回收试剂盒说明书收集DNA溶液,测定其浓度,保存-20℃备用。
1.2.2重组质粒构建及鉴定 将扩增的目的基因Lipocalin2和空载体pEGFP-C3质粒用Xho I和Bam H I进行双酶切,取5μl行琼脂糖凝胶电泳,用DNA凝胶纯化试剂盒回收质粒载体后定量,按照目的基因∶载体为3∶1、T4DNA连接酶、10 x连接缓冲液,总反应体积为10μl,16℃连接过夜。再将连接产物转化入感受态细胞扩增,参照天根质粒抽提试剂盒抽提质粒,Xho I和Bam H I双酶切重组质粒,琼脂糖凝胶电泳鉴定,并将阳性克隆提取质粒后送上海生工生物技术公司对重组质粒进行测序鉴定并将重组质粒命名为pEGFP-C3-Lipocalin2。
1.2.3重组质粒转染HK-2细胞 选择对数增长期生长状态良好的HK-2细胞,胰酶消化细胞,以5×105个接种到6孔板中,24h后细胞长到60%~70%左右融合,进行转染,按照脂质体试剂说明书操作,转染后48h加入筛选抗生素G418(800ng/ml)持续培养14d后,挑出单克隆,扩大培养,同时设对照组细胞。
1.2.4RT-PCR检测Lipocalin2 mRNA的表达 分别取转染pEGFP-C3-Lipocalin2及空载体pEGFP-C3的细胞,收集细胞,提取细胞总RNA(按RNA抽提试剂盒说明书操作),逆转录合成cDNA,以cDNA为模板,PCR扩增Lipocalin2基因,10g/L琼脂糖凝胶电泳,凝胶电泳成像系统分析。
1.2.5Western blotting检测Lipocalin2 蛋白的表达 分别取转染pEGFP-C3-Lipocalin2及空载体pEGFP-C3的细胞,提取细胞总蛋白,同时加入蛋白酶抑制剂PMSF(100mg/L)和抗氧化剂β-巯基乙醇(1mg/L),蛋白样品在100℃变性5min,用12ml/L聚丙烯酰胺凝胶电泳,每孔上样30μg。电泳后用电转仪转移到PVDF膜上,室温下(洗好膜后)用5mg/L脱脂奶粉(DSM,in TBST),封闭 2h,分别一抗 4℃过夜 ,洗膜后加入二抗,室温孵育2h,应用发光液(PIERCE)显色,凝胶成像仪与Quangtity one软件照相显影。
2 结果
2.1Lipocalin2全序列PCR扩增后电泳鉴定Lipocalin2全序列PCR扩增产物10g/L琼脂糖凝胶电泳,凝胶电泳成像系统分析,在597bp左右可见一条清晰的条带,与DNA Maker相比,扩增产物大小与预测结果一致,见图1。
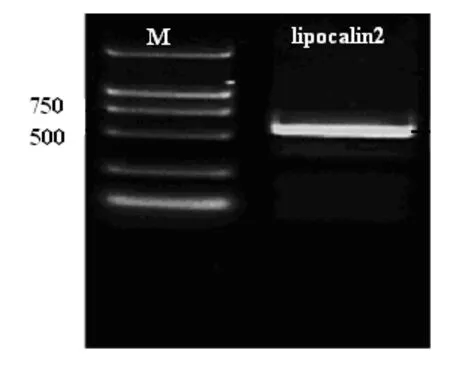
图1 Lipocalin2全序列电泳鉴定
2.2重组质粒pEGFP-C3-Lipocalin2的酶切鉴定重组质粒pEGFP-C3-Lipocalin2用限制性内切酶Xho I和Bam H I酶切后,10g/L琼脂糖凝胶电泳,凝胶电泳成像系统分析,可见位于597bp和4700bp处的两条清晰的条带,与DNA Maker相比,产物大小与理论结果一致,见图2。

图2 重组质粒pEGFP-C3-Lipocalin2酶切鉴定
2.3重组质粒pEGFP-C3-Lipocalin2的测序鉴定测序结果经blast分析与基因文库所提供序列一致,基因序列:ATGCCCCTAGGTCTCCTGTGGCTGGGC CTAGCCCTGTTGGGGGCTCTGCATGCCCAGGCCC AGGACTCCACCTCAGACCTGATCCCAGCCCCACC TCTGAGCAAGGTCCCTCTGCAGCAGAACTTCCAG GACAACCAATTCCAGGGGAAGTGGTATGTGGTAG GCCTGGCAGGGAATGCAATTCTCAGAGAAGACAA AGACCCGCAGAAGATGTATGCCACCGTCTATGAG CTGAAAGAAGACAAGAGCTACAATGTCACCTCCG TCCTGTTTAGGAAAAAGAAGTGTGACTACTGGAT CAGGACTTTTGTTCCAGGTTGCCAGCCCGGCGAG TTCACGCTGGGCAACATTAAGAGTTACCCTGGAT TAACGAGTTACCTCGTCCGAGTGGTGAGCACCAA CTACAACCAGCATGCTATGGTGTTCTTCAAGAAA GTTTCTCAAAACAGGGAGTACTTCAAGATCACCC TCTACGGGAGAACCAAGGAGCTGACTTCGGAACT AAAGGAGAACTTCATCCGCTTCTCCAAATCTCTGG GCCTCCCTGAAAACCACATCGTCTTCCCTGTCCCA ATCGACCAGTGTATCGACGGCTAG,提示重组质粒pEGFP-C3-Lipocalin2构建成功。
2.4转染pEGFP-C3-Lipocalin2及空载体pEGFP -C3的细胞的鉴定
2.4.1细胞形态学观察 以488nm波长激发光激发,激光共聚焦显微镜下观察,转染pEGFP-C3-Lipocalin2及空载体pEGFP-C3的细胞呈立方形或球形,具有典型的上皮细胞铺路石样特征,均发绿色荧光,转染pEGFP-C3细胞荧光主要集中在细胞核,而转染pEGFP-C3-Lipocalin2细胞荧光均匀分布在胞浆胞核,见图3。

图3 pEGFP-C3-Lipocalin2及空载体pEGFP-C3在细胞中的表达
2.4.2Lipocalin2 mRNA表达检测 PCR扩增产物10 g/L琼脂糖凝胶电泳,凝胶成像系统分析,稳定转染pEGFP-C3-Lipocalin2、空载体pEGFP-C3细胞及对照组细胞在600bp左右均可见一条清晰的条带,与DNA Maker相比,扩增产物大小与预测结果一致,且稳定转染pEGFP-C3-Lipocalin2的细胞Lipocalin2 mRNA表达明显高于空载体pEGFP-C3细胞及空白对照组细胞,初步提示稳定转染pEGFP-C3-Lipocalin2及空载体pEGFP-C3的细胞筛选成功,见图4。

图4 Lipocalin2基因电泳鉴定
2.4.3稳定转染pEGFP-C3-Lipocalin2及空载体pEGFP-C3细胞Lipocalin2蛋白表达检测 Western blot结果显示稳定转染pEGFP-C3-Lipocalin2、空载pEGFP-C3细胞及空白对照组细胞在25KD左右均可见一条清晰的条带,与蛋白Maker相比,产物大小与预期结果一致,且稳定转染pEGFP-C3-Lipocalin2的细胞Lipocalin2蛋白表达明显高于空载体pEGFP-C3的细胞,进一步提示稳定转染pEGFP-C3-Lipocalin2及空载体pEGFP-C3的细胞筛选成功,见图5。

图5 Lipocalin2蛋白表达鉴定
3 讨论
Lipocalin2(也被称做 NGAL/24p3)是 Kjeldsen等1993年在中性粒细胞中发现的一种脂质运载蛋白,广泛分布于肾、支气管、胃、小肠、胰腺等组织中,参与铁及脂肪酸的转运,促进凋亡的发生,抑制细菌的生长,参与炎症趋化的调节。Jiang等[2]在研究中发现,Lipocalin2可以诱导乳腺癌细胞间充质-上皮转分化,通过上调E-cad的表达使转分化的乳腺肿瘤细胞恢复上皮细胞的形态,稳定上皮细胞的表型而抑制肿瘤细胞的迁移和扩散。Ratana等[3]发现Lipocalin2在上皮性卵巢肿瘤中明显表达,而给予上皮生长因子诱导EMT使上皮性肿瘤向间质性肿瘤转变过程中,Lipocalin2表达减少,且与成纤维细胞的标志—波形蛋白的表达相关,表明Lipocalin2参与维持了卵巢肿瘤的上皮表型。Ioannis等[4]在肾急性缺血-再灌注损伤模型过程中,局部缺血前、中、后期静脉给予的重组Lipocalin2可显著改善小鼠肾脏细胞的形态和功能,并可显著减少小管细胞组织病理学损伤及降低血清肌酐水平,其机制可能如下:①Lipocalin2作为铁转运蛋白参与了损伤后肾小管上皮细胞内的铁转运和诱导血红素加氧酶的生成,从而有利于损伤小管的再生;②Lipocalin2结合铁而抑制E-cad磷酸化使E-cad降解减少[1];③诱导肾小管-间质中浸润的中性粒细胞发生凋亡以保护肾组织免受炎细胞的侵害;④诱导肾间充质细胞向肾小管上皮细胞的转化,从而诱导肾小管上皮细胞的再生[1]。研究发现Lipocalin2参与了哺乳动物近端肾单位发育过程中的间充质-上皮转换过程,而肾脏发育的基本特征就是间质细胞向上皮细胞转化,Yang 等[5]分离小鼠的后肾间充质细胞和输尿管芽,用纯化的、有活性的输尿管芽处理后肾间充质细胞,培养48h后,细胞中E-cad快速表达,2~4d后细胞出现上皮形态学改变,7~9d后形成肾小管和肾单位,进一步研究发现输尿管芽中促进胚胎间充质细胞向肾小管上皮细胞分化的物质就是Lipocalin2,表明Lipocalin2可通过促进E-cad的表达而促进胚胎间充质细胞向肾小管上皮细胞分化。最新研究发现,Lipocalin2不仅作为急性肾小管损伤的早期标志物[6,7],在CKD中与肾脏损伤程度的关系日益受到重视[8~10]。但有关Lipocalin2在肾小管上皮细胞转分化过程中的表达及意义,尚有待深入探讨,含有Lipocalin 2基因的高表达的真核载体是深入研究的工作基础。
本实验选用的载体是pEGFP-C3,充分发挥了eGFP优点:荧光强度增强,稳定性增加,持续时间延长,能长期持续观察目的基因在HK-2活细胞中的表达;同时以pEGFP-C3为载体所构建的重组质粒可以在大肠杆菌中扩增,可转染入哺乳动物细胞中。在构建重组质粒时,采用的是定向克隆的方法,采用这种定向克隆构建重组质粒有以下优点:目的基因只以一个方向插入载体中,没有了正、反筛选的问题;载体的两个粘性末端不同,减少了载体自身环化的机率,故所得的阳性克隆多为重组质粒;保留了目的基因和载体两端的限制性内切酶位点,有利于重组质粒的酶切鉴定。构建好的重组质粒经限制性酶切和测序均说明Lipocalin2基因已连接到载体pEGFP-C3上,重组质粒pEGFPC3-Lipocalin2构建成功为下一步实验奠定了重要基础。将外源性DNA导入细胞有瞬时转染与稳定转染两种方法,DNA转染后,转入基因的表达可以在1~4d内检测到,只有一部分细胞的DNA被转运到细胞核内进行转录并最终输出mRNA到细胞质进行蛋白合成,为了进行稳定表达,转入的目的基因必须在宿主细胞染色体上稳定整合,故本实验采用了稳定转染的方法,使用Invitrogen公司生产的lipofectamine2000作为转染试剂,将Lipocalin2基因导入HK-2细胞,G418筛选稳定表达Lipocalin2基因的细胞株。RT-PCR和Western blot结果显示pEGFP-C3-Lipocalin2及空载体pEGFP-C3被成功转染入HK-2细胞中并表达,为下一步实验奠定了基础。
