拉米夫定和阿德福韦酯双重耐药HBV株临床检出特点与表型特性分析
2018-07-13陈容娟李晓东杜凤霞思兰兰许智慧姚增涛戴久增徐东平段昌柱
陈容娟,刘 妍,李晓东,杜凤霞,思兰兰,李 乐,许智慧,姚增涛,戴久增,徐东平,段昌柱
核苷(酸)类似物[nucleos(t)ide analogues,NAs]是最主要的抗慢性HBV感染药物。在我国,最早上市的拉米夫定(lamivudine, LAM)和阿德福韦酯(adefovir, ADV)仍被临床广泛应用。其中LAM具有较高的耐药发生率(5年耐药率为70%)[1],且与ADV无交叉耐药位点,因此临床上积累了大量的LAM耐药换用ADV单用或联用进行挽救治疗的慢性HBV感染者[2-3]。在长期LAM或ADV单药序贯治疗下,由于药物压力产生耐药病毒,患者产生同时耐LAM和ADV的双重耐药HBV的几率增加[4],继而发生病毒学和/或生化学突破,不仅加大临床治疗难度,同时其传播风险也给公共卫生安全带来了隐患[5]。目前,临床上对HBV感染的LAM/ADV双重耐药谱尚缺乏全面的分析。在前期对我国患者多重耐药HBV的研究基础上[6-7],本研究通过对我国临床大样本来源的慢性HBV感染者中LAM/ADV双重耐药HBV株的检出率、病毒突变类型及突变病毒株演变和表型耐药分析,以期为深入了解我国临床流行的LAM/ADV双重耐药HBV感染特点提供参考,并为LAM/ADV双重耐药HBV感染的防治和挽救治疗提供实验依据。
1 对象和方法
1.1 对象与方法 研究对象为2007年7月—2015年12月在解放军第三〇二医院诊治的26 553例慢性HBV感染患者,均接受相关的NAs治疗。诊断标准符合《慢性乙型肝炎防治指南(2015年更新版)》[8],HBV DNA定量(2012年4月前临床检测下限为100 IU/ml,4月后为40 IU/ml)、血清生化学和免疫学常规检查项目由解放军第三〇二医院临床检验中心完成。无其他病毒重叠或混合感染,血清冻存于-20 ℃。
1.2 主要试剂 病毒DNA-OUT提取试剂盒(北京天恩泽公司),pGEM-Teasy载体(美国Promega公司),pTriEx-HBV(C)1.1倍载体(法国里昂大学Zoulim教授惠赠),恩替卡韦(entecavir,ETV)(中美上海施贵宝制药有限公司),ADV(天津葛兰素史克有限公司),替诺福韦酯(tenofovir,TDF)(美国吉利德公司)和实时荧光定量PCR试剂盒(上海复星公司)。引物合成和克隆测序均由北京天一辉远公司完成。
1.3 方法
1.3.1 耐药突变检测分析 26 553例患者的血清样本均采用本课题组创新建立的超灵敏巢式PCR方法(国家发明专利ZL 200910092331.1,检测下限为10 IU/ml),进行HBV反转录酶(reversetranscriptase, RT)区耐药突变检测[9-10]。对PCR产物进行DNA双向测序,应用DNASTAR Lasergene 7.1、Vector NTI Suite 8 对 rt180、rt181、rt184、rt202、rt204、rt236和rt250等与LAM、ADV或ETV相关耐药位点[11]的序列峰图进行分析。采用Mega 4软件进行HBV基因分型。
1.3.2 基因克隆 将PCR产物连接至pGEM-Teasy载体中,每份样本挑选至少20个阳性克隆测序并分析耐药突变。
1.3.3 pTriEx-HBV1.1倍重组质粒构建 分别提取4种多重耐药(multidrug-resistant, MDR)质粒及其对应的野生型克隆质粒,其RT区片段经XhoⅠ和SphⅠ双酶切后定向克隆至pTriEx-HBV(C)1.1倍表达载体上,随机挑取4个克隆对重组质粒进行测序鉴定,确定HBV表达质粒构建成功。
1.3.4 表型耐药分析 将HepG2细胞接种于24孔板(1×105个/孔),18 h后每孔转染0.25 μg质粒。5 h后,将细胞用1×PBS洗2遍,加入在含或不含 NAs(ETV+ADV/TDF/TDF+ETV,ADV、ETV、TDF 的浓度分别为 50、10、200 μmol/L)的 DMEM培养液,隔天换药。4 d后收集细胞培养上清,用实时荧光定量PCR法检测上清的HBV DNA,实验独立重复3次。
1.3.5 统计学处理 用描述性统计学方法进行描述,计算相应的频数或率。连续变量呈正态分布或近似正态分布,用±s表示。
2 结 果
2.1 LAM/ADV双重耐药株检出率及基因突变类型 对26 553例患者血清样本HBV RT区PCR产物进行直接测序分析发现,LAM/ADV双重耐药HBV株的检出率为0.6%(147/26 553),共检出12种LAM/ADV双重耐药HBV株,其中主要突变类型为rtL180M+A181V+M204V(65.3%)、rtA181V+M204I(10.2%)、rtL180M+A181V+M204V+N236T(5.4%)和rtL180M+M204V+N236T(5.4%)(图1)。
2.2 LAM/ADV双重耐药患者抗HBV用药信息 147例LAM/ADV双重耐药患者临床抗HBV用药时间平均为63(36~151)个月,用药方案复杂多样,其中有60(40.8%)例患者经历了LAM→ADV单药序贯或联合治疗;57(38.8%)例患者经历了LAM→ADV→ETV单药序贯或联合治疗;12(8.2%)例患者经历了替比夫定(telbivudine, LdT)→ADV单药序贯或联合治疗。
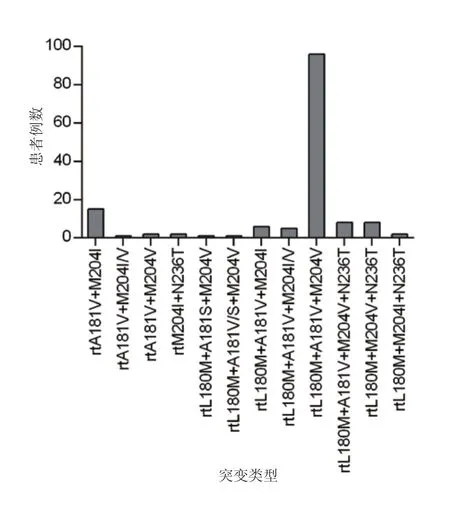
图1 LAM/ADV双重耐药HBV株突变类型Figure 1 Mutational patterns of LAM/ADV dual-drug resistant HBV mutants
2.3 代表性患者LAM/ADV双重耐药HBV株的动态演变 患者1应用LAM治疗24个月无法获得完全病毒学应答,换用LdT与ADV联合治疗,病毒仍无法被完全抑制,并在治疗5个月(P1-1)时病毒突破至1.35×107IU/ml,病毒准种池中100%为rtA181V突变株;换用LAM与ADV联合治疗8个月(P1-2),病毒应答不佳,此时rtA181V突变株占42.11%,rtM204I突变株占5.26%,rtL80I+M204I突变株占42.11%,rtA181V+M204I占10.53%,原方案持续治疗12个月,病毒仍为无应答状态后更换为ETV+ADV联合治疗,治疗12个月后获得部分病毒学应答,但在第16个月(P1-3)时发生病毒学突破,HBV DNA为1.01×103IU/ml,此时病毒准种池中rtA181V突变株占31.58%,rtM204I突变株占5.26%,rtL80I+M204I突变株占57.89%,rtA181V+M204I占5.26%;ETV+ADV持续治疗35个月(P1-4),此时病毒准种池中全部为rtA181V突变株;随后病毒学发生部分应答,并在治疗47个月后获得完全病毒学应答(HBV DNA达到检测不到水平),第50个月(P1-5)时,病毒准种池中均为野生型病毒株,直至治疗第90个月,患者都处于完全病毒学应答状态(HBV DNA持续检测不到),并在第64个月(P1-6)和82个月(P1-7)时,均未检出NAs耐药相关突变(图2A)。
患者2应用LAM治疗应答不佳,发生病毒学和生化学突破,HBV DNA为1.41×106IU/ml,ALT为130 U/L,此时患者更换ADV进行挽救治疗。在ADV挽救治疗12个月,患者获得了完全病毒学应 答,HBV DNA< 80.00 IU/ml,ALT为 27 U/L。但ADV持续治疗第17个月(P2-1)时,再次发生病毒学突破,HBV DNA为1.01×104IU/ml,此时RT区克隆结果显示病毒准种池中为100% 的rtN236T突变株。更换LdT治疗3个月时获得了部分病毒学应答,在LdT持续治疗8~10个月时发生病毒学突破,并在第10个月(P2-2)时,病毒学突破至3.45×106IU/ml,此时病毒准种池全为rtL180M+A181V+M204V突变株;换用ETV治疗9个月无法获得完全病毒学应答后加用ADV联合治疗,在6个月后获得完全病毒学应答,并持续67个月,HBV都处于完全病毒学应答状态,且在ETV+ADV联合挽救治疗22个月(P2-3),未检出NAs耐药相关突变;ETV+ADV挽救治疗82个月(P2-4)时,发生病毒学和生化学突破,HBV DNA 为 2.6×105IU/ml,ALT为 148 U/L,此时病毒准种池中rtL180M+M204V突变株占35.00%,rtL180M+S202G+M204V占65.00%;换用TDF治疗6个月后获得完全病毒学应答(图2B)。
2.4 代表性LAM/ADV双重耐药突变株的复制力及表型耐药特点分析 选取4种检出率最高的LAM/ADV突变株构建至HBV 1.1倍基因组长HBV突变株和相应野生株重组复制子,其复制力测定结果显示,与相应野生株相比,LAM/ADV突变株的复制力明显降低。将野生株复制力设定为100%,rtA181V+M204I株、rtL180M+A181V+M204V株、rtL180M+M204V+N236T株和rtL180M+A181V+M204V+N236T株的复制力分别为相应野生株的37.5%、44.6%、52.0%和32.8%;体外强效NAs对4种突变株的抑制结果显示:ETV+ADV、TDF和TDF+ETV均可有效抑制野生株复制,抑制率为98.5%~99.5%。 对于4种LAM/ADV双重耐药突变株,ETV+ADV、TDF和TDF+ETV也展示良好的抑制效果(抑制率分别为80.6%~92.5%、86.1%~97.9%和89.2%~97.5%),相对而言,TDF和TDF+ETV的抑制效果更好(表1)。
3 讨 论
长期应用NAs抗HBV治疗是限制或逆转疾病进展的关键,但治疗过程中产生病毒耐药导致治疗失败的问题,使得抗HBV治疗更加棘手[8,12-13]。耐药病毒株是由药物压力下适应性强的突变病毒获得选择性扩增产生或直接通过耐药株的水平传播产生,且MDR HBV株对联合治疗的抗药性更强[14-15]。对于LAM耐药的慢性HBV感染者,指南推荐换用TDF或加用ADV挽救治疗。在2014年以前,TDF未在中国批准用于抗HBV治疗的情况下,LAM耐药患者均采用加用ADV进行挽救治疗,且联合治疗是预防MDR的有效方式[16],但有少数患者仍会产生MDR[4]。
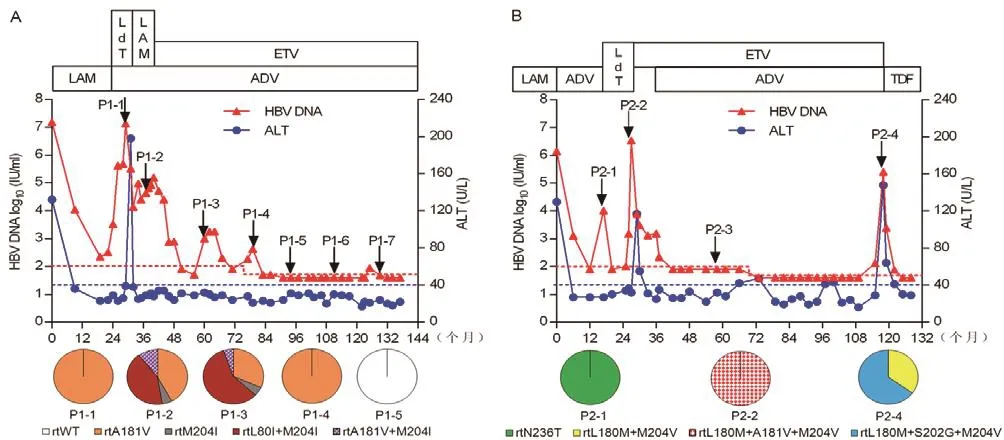
图2 2例患者临床信息和病毒学演变信息A.患者1血清生化学及病毒学演变信息;B.患者2血清生化学及病毒学演变信息Figure 2 Clinical information and virologic evolutions of 2 representative patients
表1 LAM/ADV耐药突变株相对复制力及表型分析(±s,%)Table 1 Relative replication capacity and phenotypic characteristics of LAM/ADV resistant HBV strains(±s, %)
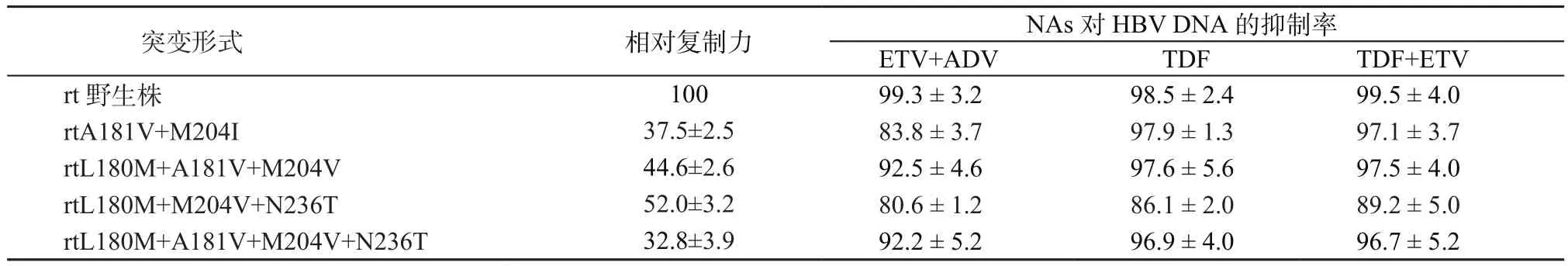
表1 LAM/ADV耐药突变株相对复制力及表型分析(±s,%)Table 1 Relative replication capacity and phenotypic characteristics of LAM/ADV resistant HBV strains(±s, %)
突变形式 相对复制力 NAs对HBV DNA的抑制率ETV+ADV TDF TDF+ETV rt野生株 100 99.3 ± 3.2 98.5 ± 2.4 99.5 ± 4.0 rtA181V+M204I 37.5±2.5 83.8 ± 3.7 97.9 ± 1.3 97.1 ± 3.7 rtL180M+A181V+M204V 44.6±2.6 92.5 ± 4.6 97.6 ± 5.6 97.5 ± 4.0 rtL180M+M204V+N236T 52.0±3.2 80.6 ± 1.2 86.1 ± 2.0 89.2 ± 5.0 rtL180M+A181V+M204V+N236T 32.8±3.9 92.2 ± 5.2 96.9 ± 4.0 96.7 ± 5.2
本研究针对147例LAM/ADV双重耐药血清样本进行回顾性分析,其中LAM/ADV双重耐药HBV株主要突变类型为rtL180M+A181V+M204V(65.3%)和rtA181V+M204I(10.2%)。患者临床用药方案显示,40.8%的患者经历了LAM→ADV单药序贯或联合治疗;38.8%的患者经历了LAM→ADV→ETV单药序贯或联合治疗。许多患者在LAM耐药后选择低耐药基因屏障药物ADV或含有共同耐药谱的ETV进行挽救治疗情况较为常见,这些都使HBV发生MDR的风险增大。
对2例代表性LAM/ADV双重耐药患者的抗HBV治疗过程进行分析,患者1是在LAM应答不佳后采用LdT+ADV挽救治疗再换用LAM+ADV后仍应答不佳,此时患者血清病毒准种池中发现部分LAM/ADV双重耐药株与LAM耐药株和ADV耐药株并存。患者2在应用LAM应答不佳后,换用ADV单药序贯治疗发生病毒学突破再换用LdT单药序贯治疗再次发生病毒学突破,此时病毒耐药检测出LAM/ADV双重耐药病毒株。NAs应答不佳时再次选用低耐药基因屏障的NAs药物进行单药随意序贯、频繁换药或加药等也增加了MDR发生的可能性[17]。
在发生MDR突变时,指南推荐ETV+TDF或ETV+ADV挽救治疗[8]。TDF未在中国上市前,ETV+ADV是发生MDR患者的最优挽救治疗方案。患者1和患者2在发生双重耐药突变后采用ETV+ADV挽救治疗,均在3年后获得完全病毒学和生化学应答。对2例LAM/ADV双重耐药患者在应用ETV+ADV挽救治疗后动态血清克隆为双重耐药株消失,病毒准种池中为单一NAs耐药株或随着获得完全病毒学应答时间的延长,病毒准种池中优势株由单一耐药株逐渐转换为野生株,最后用本课题组超敏感的巢式PCR扩增专利方法也无法检测出RT区耐药基因。ETV+ADV是LAM/ADV双重耐药慢性HBV感染者的有效挽救治疗选择,但须密切监测肝功能和HBV DNA水平的变化,才能达到理想的治疗效果。
TDF初始治疗慢性HBV感染者8年数据显示病毒学应答率良好,并未检测到TDF相关耐药突变[18]。另外TDF在治疗NAs经治后发生单一NAs耐药或MDR的患者都表现出较高的病毒学应答率,且耐受性良好[19-20]。患者2在应用ETV+ADV挽救治疗6年后发生病毒学和生化学突破,此时病毒准种池中主要为ETV耐药株与LAM耐药株并存,换用TDF治疗6个月后,获得完全病毒学应答,TDF是ETV+ADV联合治疗效果应答不佳的有效选择,本研究的体外表型结果与此相一致。4种LAM/ADV突变株体外表型结果显示ETV+ADV、TDF和TDF+ETV均能有效抑制病毒复制,并且TDF和TDF+ETV的抑制效果更好。
总之,本研究通过临床大样本HBV耐药分析,首次明确了LAM/ADV双重耐药的临床发生特点,并对2例LAM/ADV双重耐药典型患者的样本进行了HBV突变株产生特点及耐药病毒在治疗期间的演变进行了深入分析,结果显示对于LAM耐药患者选用低耐药基因屏障药物进行挽救治疗更易发生MDR从而影响治疗效果;ETV+ADV是LAM/ADV MDR患者有效的挽救治疗方案,且获得完全病毒学应答的时间越长,越有利于耐药株为主向野生优势株为主的转变,从而恢复对多种NAs药物的敏感性;对于MDR株,选择高耐药基因屏障药物TDF或TDF+ETV挽救治疗可以更快的获得完全病毒学应答,这对于辅助临床医生在发现多重耐药病毒株的HBV患者制定优化治疗策略具有重要的指导意义。
