苏氨酸铁对缺铁性贫血大鼠 铁营养状况的改善
2018-07-11谢明勇王光然虞俊翔易成意胡晓波
李 虎,谢明勇,王光然,虞俊翔,易成意,胡晓波
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
铁是人和动物体内不可或缺的微量元素之一,铁缺乏或利用障碍均会导致贫血发生,若患者仅为轻度贫血,通过日常饮食及药物帮助可恢复正常[1]。缺铁性贫血(IDA)是贫血的一种,是当前世界范围内患病率较高的营养性疾病,特别是在发展中国家[2-3]。一般情况下,较低的膳食铁含量和生物利用率易造成铁缺乏,使红细胞中血红蛋白(Hb)含量大幅减少,进而降低红细胞数目,造成细胞及组织供氧不足,最终出现缺铁性贫血[4-5]。
通过对膳食中铁含量进行强化来预防和治疗铁缺乏被广泛地认为是最为有效的方法[6]。传统铁强化剂或多或少地存在铁腥味,对胃肠道的刺激性较大,生物利用率也不理想[7],因此有必要开发新型补铁制剂。氨基酸铁螯合物具有溶解性好、稳定性强、吸收快、无毒害作用、无刺激性等特点,具有较高的生物利用率和生物学效价[8-10]。在治疗和改善IDA时,氨基酸螯合铁具有优于无机铁和有机酸铁的应用性能[11]。Cristina lost等[12]针对IDA儿童研究发现,食用氨基酸螯合铁强化的液体奶可以缓解IDA儿童Hb水平较低的症状。江素梅[13]在预防仔猪贫血的研究中对仔猪或母猪饲喂氨基酸铁,能直接或间接预防仔猪贫血,提高免疫力。
实验以初断乳斯泼累格·多雷(SD)大鼠建立IDA模型,通过对IDA大鼠补充苏氨酸铁(Thr-Fe),并以硫酸亚铁为阳性对照,对低铁膳食补充Thr-Fe改善IDA大鼠铁营养状况及其对血液理化指标水平的改善效果展开研究,从而为Thr-Fe在改善和纠正IDA的应用中提供理论和依据。
1 材料与方法
1.1 材料与仪器
SPF级初断乳SD大鼠 雄性,36 只,3 周龄,体重(69.30±5.28) g,健康状况良好,符合实验所需的质量要求,许可证号:SCXK(湘)2013-0004,湖南斯莱克景达实验动物有限公司;苏氨酸铁 浅绿色粉末,亚铁含量为12.07%,南昌大学食品科学与技术国家重点实验室研制;七水合硫酸亚铁 分析纯,亚铁含量为19.88%,西陇化工股份有限公司;普通饲料 铁含量为260 mg/kg,成分:玉米粉58.5%,麦麸7.5%,豆粕23.5%,进口蒸汽红鱼粉3.0%,蔗糖3.0%,大豆油2.0%,乳脂粉2.0%,预混料3.5%,湖南斯莱克景达实验动物有限公司;低铁饲料 铁含量<10 mg/kg,成分:EDTA处理酪蛋白15%,大米粉70%,玉米油5%,AIN-76M混合矿物盐3.5%,AIN-76M混合维生素1%,氯化胆碱0.2%,明胶5%,DL-蛋氨酸0.3%,北京博泰宏达生物技术有限公司;原卟啉标准品 纯度≥ 95%,上海麦克林生化科技有限公司;大鼠血红蛋白酶联免疫分析试剂盒 上海抚生实业有限公司;大鼠总铁结合力ELISA试剂盒、大鼠转铁蛋白ELISA试剂盒、大鼠铁蛋白ELISA试剂盒 南京翼飞雪生物科技有限公司。
超低温冰箱 日本Sanyo公司;普通台式离心机 德国Eppendorf公司;台式低温高速离心机 德国Heraeus公司;OLYMPUS AU640全自动生化分析仪 日本奥林巴斯电气化学公司;涡旋振荡器 常州万合仪器制造有限公司;E-330多功能酶标仪 美国Thermo公司。
1.2 实验方法
1.2.1 SD大鼠IDA模型建立 实验采用不锈钢笼及塑料水罐避免铁元素的污染,大鼠自主饮水采食,控制室温22 ℃左右,每日给予12 h光照,室内换气次数约12 次/h。适应环境3 d后,选用健康初断乳SD大鼠30只,饲予低铁饲料及去离子水建立缺铁性贫血模型。自第3周开始,每隔5 d随机选取部分大鼠(20只),眼眶后静脉丛采血,测定Hb。若Hb<100 g/L,则认为该实验动物已发生缺铁性贫血。当随机选取的大鼠全部达到恢复实验要求(即Hb<100 g/L)时,认为建模成功,此时测定全部大鼠Hb并称重,记录体重。
1.2.2 SD大鼠IDA恢复实验 选取Hb<100 g/L的大鼠30只,根据Hb水平及体重将其随机分为Thr-Fe低、中、高剂量组、阳性对照组和低铁对照组,每组6只,均继续给予低铁饲料;另设空白对照组,6只,给予普通饲料。Thr-Fe低、中、高剂量组分别给8、16、32 mg/kg·bw 的Thr-Fe,阳性对照组给予32 mg/kg·bw硫酸亚铁,低铁对照组和空白对照组给予相应溶剂(新沸冷却超纯水,现用现配),容积为1.0 mL/100 g·bw,采用灌胃给药的方式,每天1次。受试样品给予时间为21 d,每周测定两次体重及Hb,并根据体重调整灌胃的容积。采集血液样品之前,实验动物需禁食12 h。日常采血选择眼眶后静脉丛采血,实验动物处死前选择摘眼球采血,采集到的血液样品置于EDTA抗凝管中,部分血液离心制备血清,4 ℃冰箱保存备用。
1.2.3 测定指标
1.2.3.1 实验动物一般情况 观察实验过程中SD大鼠的精神状态、活动能力、被毛等情况,称量各组大鼠体重。
1.2.3.2 血液学指标 使用大鼠血红蛋白酶联免疫分析试剂盒,采用双抗体夹心法测定IDA大鼠血液的Hb水平。利用全自动生化分析仪测定血红细胞(RBC)计数、白细胞(WBC)计数、红细胞比容(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、红细胞分布宽度(RDW)。
1.2.3.3 红细胞内游离原卟啉含量(FEP) 参照杨焕民等[14-15]关于仔猪红细胞内游离原卟啉微量测定法及正常值探讨的相关报道,采用荧光分光光度法测定FEP。
1.2.3.4 血清铁蛋白(SF)、转铁蛋白(TRF)、总铁结合力(TIBC) 使用大鼠铁蛋白ELISA试剂盒、大鼠转铁蛋白ELISA试剂盒、大鼠总铁结合力ELISA试剂盒,采用双抗体夹心法测定IDA大鼠血清样品中SF、TRF及TIBC水平。
1.3 数据处理
2 结果与分析
2.1 实验动物一般情况分析
IDA模型建立期间,模型组与空白对照组相比采食量下降,体重增加缓慢,活动能力降低,易脱毛,且模型组部分大鼠出现毛发成片脱落现象。恢复实验期间,Thr-Fe剂量组以及阳性对照组实验动物与空白对照组比较精神状态均出现一定程度的萎靡,毛发粗糙凌乱、无光泽,可能由于恢复实验期短,而实验动物皮毛状况的改善需要较长时间。
2.2 Thr-Fe对IDA大鼠体重的影响
IDA模型建立初始时间记为第0 d,恢复实验初试时间记为第1 d。实验期间动物体重变化见表1。
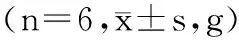
表1 IDA大鼠体重Table 1 Body weight of IDA
恢复实验过程中,各模型组间体重差异无统计学意义(p>0.05)。恢复实验结束时,低铁对照组大鼠体重较空白对照组差异极显著(p<0.01),Thr-Fe高剂量组较低铁对照组,差异显著(p<0.05),各模型组中Thr-Fe高剂量组增量最高,且与阳性对照组和低铁对照组相比,体重增量的差异极显著(p<0.01)。其他模型组间大鼠的体重增量无统计学差异(p>0.05)。实验结果表明IDA对实验动物体重有重要影响;较硫酸亚铁,高剂量Thr-Fe铁能明显改善IDA大鼠体重增长缓慢的症状,与刘卫东等[16]在断奶仔猪实验组饲粮中添加0.05%甘氨酸亚铁,实验组较对照组(无机铁)日增重提高9.1%的研究结果一致。由此推断,高剂量Thr-Fe作为补铁剂改善和纠正IDA时,可以促进患者体重增长且效果优于硫酸亚铁。
2.3 Thr-Fe对IDA大鼠血液学指标的影响
2.3.1 恢复实验期间Thr-Fe对IDA大鼠Hb水平的影响 实验动物在恢复实验期间Hb含量变化见表2。
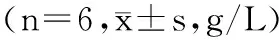
表2 恢复实验期间IDA大鼠血红蛋白含量Table 2 Hb content in IDA rats during recovery
铁制剂干预的IDA大鼠血液Hb随恢复实验的进行呈上升趋势,且随剂量的增加,Thr-Fe剂量组间相比,Hb含量也增高。恢复实验第15 d,Thr-Fe低、中、高剂量组和阳性对照组的Hb水平较低铁对照组分别增高了12.83%、29.15%、40.06%和27.73%(p<0.01),第21 d,则分别增高了22.30%、37.68%、56.88%和39.79%(p<0.01)。Thr-Fe高剂量组的Hb含量于恢复实验第21 d较空白对照组无统计学差异(p>0.05),较阳性对照组增高了13.16%(第15 d,p<0.05)和12.23%(第21 d,p<0.05)。结果表明,连续补充一定剂量Thr-Fe可提高大鼠血液Hb水平,改善血液状况,与丁科等[17]关于甘氨酸亚铁可明显增加IDA大鼠血液Hb含量且效果优于硫酸亚铁的研究结论一致。Thr-Fe对IDA大鼠血液Hb的改善作用与剂量呈正相关,此外Thr-Fe的应用性能优于硫酸亚铁。
2.3.2 Thr-Fe对IDA大鼠血常规检查指标的影响 血常规指标是大鼠喂养实验的一项重要内容[18],也是判断外源性受试物是否对动物血液组织造成影响的重要依据[19]。通过全自动生化分析仪测定各组大鼠血液中RBC、WBC、HCT、MCV、MCH、RDW指标,测定结果见表3。

表3 大鼠血常规测定结果Table 3 Results of the blood routine examination of the
各Thr-Fe剂量组IDA大鼠间以及与阳性对照组比较,血常规指标差异无统计学意义(p>0.05)。低铁对照组大鼠各指标较空白对照组差异极显著(p<0.01)。铁制剂干预各组的RBC、WBC、HCT、MCV、MCH较低铁对照组,差异均有统计学意义:Thr-Fe各剂量组和阳性对照组RBC、MCV、MCH升高极显著(p<0.01),Thr-Fe高剂量组和阳性对照组WBC升高极显著(p<0.01),Thr-Fe低、中剂量组升高显著(p<0.05)。铁制剂干预各组的RDW值较低铁对照组明显改善,分布宽度变窄。铁制剂干预的各组大鼠血常规指标较低铁对照组有明显纠正,RBC、WBC增加,MCV、HCT等值变大,RDW明显降低,接近于空白对照组,红细胞形态差异减小,缺铁症状得到改善。这与袁明贵等[20]关于甘氨酸铁络合物对杜长大仔猪血常规指标具有改善作用的研究结论一致。
2.4 Thr-Fe对IDA大鼠血液FEP水平的影响
恢复实验结束后,各组大鼠FEP含量测定结果见表4。

表4 IDA大鼠红细胞内游离原卟啉 含量测定结果Table 4 Results of FEP of IDA
低铁对照组大鼠FEP含量显著高于空白对照组(p<0.01),铁制剂干预各组FEP含量较低铁对照组差异极显著(p<0.01),Thr-Fe高剂量组和阳性对照组大鼠FEP含量分别降低了28.59%和28.03%,接近空白对照组。Thr-Fe各剂量组大鼠FEP水平与阳性对照组相比较均无统计学差异(p>0.05)。随剂量增加,Thr-Fe剂量组大鼠FEP含量降低,与剂量呈负相关。FEP含量是表征铁缺乏的可靠指标之一,从补充Thr-Fe和硫酸亚铁使细胞内游离FEP含量显著下降,可以推断IDA大鼠体内耗竭的功能铁得到部分恢复,促进了机体血红素的合成,改善了铁营养状况,缺铁性贫血造成的机体铁依赖性生理功能损伤得到缓解。
2.5 Thr-Fe对IDA大鼠SF、TRF、TIBC的影响
恢复实验后,各组大鼠血清SF、TRF、TIBC测定结果见表5。

表5 Thr-Fe对IDA 大鼠SF、TRF、TIBC的影响(n=6,x±s) Tab 5 Effects of Thr-Fe on the SF、TRF、TIBC levels IDA rats(n=6,x±s)
低铁对照组大鼠SF、TRF、TIBC较空白对照组差异显著(p<0.05)。较低铁对照组,Thr-Fe高剂量组和阳性对照组大鼠SF含量分别显著性升高26.94%(p<0.01)和22.85%(p<0.05)。Thr-Fe高剂量组TRF含量较低铁对照组降低了26.74%(p<0.01),接近空白对照组(p>0.05),各Thr-Fe处理组大鼠的血清TRF含量随剂量的增加呈降低趋势。较低铁对照组,各剂量组血清TIBC均有不同程度的降低,且随Thr-Fe剂量的增加呈降低趋势,其中Thr-Fe高剂量组TIBC较低铁对照组下降了21.63%(p<0.05),接近空白对照组。血清铁蛋白中铁主要以Fe3+的形式存在,通过Fe2+摄取或Fe3+释放来调节机体铁稳态[21],同时转铁蛋白参与铁在体内的转运和代谢,机体健康变化会导致转铁蛋白含量的变化[22]。通过铁元素的补充,SF合成增加,TRF合成减少,TIBC降低,较低铁剂量组均有较为显著的改善,特别是高剂量的Thr-Fe使IDA大鼠在短期内SF、TRF和TIBC水平达到正常范围,有效地促进了机体内铁的转运和贮存。
3 讨论
铁缺乏致使与铁有关的多种酶活降低,影响机体氧化还原等生理过程[23-24],对免疫、消化及内分泌等系统均产生较大负面影响[25],患者易出现焦虑、沮丧等情绪。模型建立及恢复实验过程中,受铁缺乏的影响,模型组大鼠较空白对照组表现出采食减少,体重增加缓慢,活动能力低,易脱毛,精神萎靡等现象,表明IDA对实验动物有一定影响。通过对各模型组分别饲喂Thr-Fe和硫酸亚铁,大鼠体重增加状况较低铁剂量组均有明显改善,这与王明镇等发现补充氨基酸螯合铁可有效增加断奶仔猪体重的结论一致[26]。这可能与随着铁元素的补充,大鼠体内铁营养状况改善,与铁有关的酶活逐渐恢复并发挥正常生化作用,从而大鼠紊乱的生理代谢活动得到纠正有关。
实验期间针对模型组大鼠饲喂低铁饲料,造成早期的营养性铁缺乏,进而影响血红素生成不足,未能与铁结合的FEP含量增高[27],Hb合成量减少,大鼠红细胞内血红蛋白含量不足,红细胞间差异变大,RDW值升高[28],MCH、MCV等值降低,此外,中性粒细胞杀菌能力下降,淋巴细胞功能受损[29],WBC一定程度降低。缺铁对细胞分裂增殖影响较小,故RBC减少程度不如Hb明显。恢复实验中,铁元素经小肠上皮细胞吸收和转运蛋白转运后,与红细胞内游离的原卟啉结合,FEP值降低,血红素合成量增加,以血红素为合成原料的Hb含量升高,大鼠血常规指标恢复到与王蕊[30]等报道的10~12 周龄SD大鼠血常规指标参考水平趋近一致。
血清铁蛋白复合物在一定程度上维持血红蛋白的稳态,当铁储备不足时,合成的铁蛋白降低,TIBC升高,转铁饱和度降低[31]。铁制剂的补充促进了大鼠体内血清铁蛋白复合物生成,储备铁含量增加,转铁蛋白含量和总铁结合力下降,结果与张文飞研究报道的甘氨酸亚铁能显著提高血清中铁饱和度和血液中铁含量一致[32]。
4 结论
由实验结果与讨论可知,不同剂量Thr-Fe对IDA大鼠各项指标的影响有一定差异,高剂量Th-Fe较中、低剂量对大鼠铁营养状况的改善作用更明显,实验结束时的各项指标更接近空白对照组;高剂量Thr-Fe组大鼠较阳性对照组铁营养状况改善较好,这可能与Thr-Fe较硫酸亚铁稳定性更强、吸收利用率更高有关。
综上所述,低铁膳食补充Thr-Fe可以改善IDA大鼠的铁营养状况,提高功能铁、贮存铁水平,促进机体内铁运转,另外对体重、血液品质具有一定改善作用,改善效果与补充剂量呈相关性,并且高剂量Thr-Fe作用效果优于硫酸亚铁。因此,Thr-Fe作为铁营养强化剂应用于改善和纠正IDA具有广泛的前景。
