青梅酵素的生物活性 及体外抑菌作用
2018-07-11马秀敏
王 辉,马秀敏,张 鹰
(仲恺农业工程学院轻工食品学院,广东广州 510550)
青梅,又称为果梅、酸梅,是梅子中的一种[1]。青梅营养丰富,含有多酚、黄酮、粗纤维、维生素、铁、锌、磷 以及丰富的氨基酸[2]。研究表明,青梅原汁具有促进血液中乳酸外排和清洁血液的作用[3];具有较强的抗氧化作用,可抑制脂质过氧化物对膜结构的损伤,保护肝脏[4];且具有较强的抑制微生物的作用[5]。但青梅低糖高酸,还有苦杏仁苷导致的难以忍受的苦涩味,不宜鲜食,是典型的加工型水果[6-7]。因此,青梅被加工成多种产品,包括盐渍类产品、蜜饯类制品、梅饮料制品、梅酒类制品、养生梅醋等。
酵素食品是指以一种或多种新鲜蔬菜、水果、菌菇、药食同源中草药等为原料,经多种有益菌发酵而成的功能性产品,含有丰富的酶、维生素、矿物质和次生代谢产物等营养成分[8],具有平衡机体作用、消炎抗菌、美白抗衰老、解酒等生理功能[9]。目前国内对酵素的研究处于起步阶段,研究报道相对较少[10]。
将青梅加工成青梅酵素,可以扩大对青梅的利用,丰富酵素产品。但目前,国内外未有对青梅酵素的研究报道。本文以青梅在自然状态下发酵制得的青梅酵素为研究对象,对其抗氧化能力、酶活力和抑菌活性进行研究,为评估青梅酵素功能和开发青梅酶素产品提供依据。
1 材料与方法
1.1 材料与仪器
青梅酵素 广东省广州市从化地区出产的大肉梅在自然条件下发酵半年制得;金黄色葡萄球菌(Staphylococcusaureus),大肠杆菌(Escherichiacoli),枯草芽孢杆菌(Bacillussubtilis) 仲恺农业工程学院轻工食品学院微生物实验室提供;牛肉膏蛋白胨培养基(牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,水1000 mL,pH7.0~7.2,121 ℃灭菌30 min);四水合钼酸铵、邻菲咯啉等 均为分析纯;橄榄油 市售。
THZ-82型水浴恒温振荡器 金坛市中大仪器厂;800B型低速台式离心机 上海安亭科学仪器厂;SHZ-D(Ⅲ)型生化培养箱 韶关市科力实验仪器有限公司;PYX-280S-A型超净工作台 苏州安泰空气技术有限公司;722N型可见分光光度计 上海精密科学仪器有限公司;BOI-DL型单道可调移液器 上海宝予德科学仪器有限公司。
1.2 实验方法
1.2.1 青梅酵素抗氧化活性测定
1.2.1.1 总抗氧化能力测定 采用钼酸铵法[11]。配制钼酸铵反应体系:分别取2.13 g Na3PO4、0.99 g钼酸铵、6.67 mL浓硫酸定溶于200 mL超纯水中,混合均匀。配制一定浓度梯度的待测溶液以及0~120 μg/mL的VC溶液。取3 mL钼酸铵反应试剂加入0.3 mL的待测酵素中,充分混合后置于95 ℃水浴加热90 min,冷却至室温,在波长为695 nm下测定其吸光值,用不加样液的空白试剂调零。被测酵素的总抗氧化能力以抗坏血酸当量进行表示。
1.2.1.2 对羟基自由基(·OH)清除作用测定 参考李杰等[12]的方法。取1 mL的0.75 mmol/L邻菲咯啉、3.8 mL磷酸盐缓冲溶液(pH=7.4,0.2 mol/L)以及1.5 mL的0.75 mmol/L硫酸亚铁混匀,然后加入1 mL样品液与1 mL 0.01% H2O2到该混合试剂当中,在37 ℃恒温反应60 min,与536 nm波长下测定吸光值,以VC代替样品作阳性对照。·OH清除率按下式计算。
式中:A1-样液的吸光值;A2-不加样液的吸光值,样液以蒸馏水代替;A3-不加H2O2和样液的吸光值,H2O2和样液以蒸馏水代替。
1.2.1.3 对DPPH自由基(DPPH·)清除能力测定 参照范金波等[13]的方法。称取DPPH20 mg,用无水乙醇定容至250 mL,制得200 mmol/L的DPPH工作液。用蒸馏水将酵素稀释成不同浓度。取1 mL样品液和3 mL DPPH工作液于试管中振荡摇匀。在室温下,静置反应30 min。在517 nm处测定吸光值。
式中:Ai-1 mL样品液与3 mLDPPH液的吸光值;Aj-1 mL样品液与3 mL无水乙醇的吸光值;Ac-1 mL无水乙醇与3 mL DPPH的吸光值。
1.2.1.4 还原力测定 以VC作为参照,取1 mL不同浓度的样品液和2.5 mL pH6.6,0.2 mol/L的磷酸盐缓冲液、2.5 mL浓度为1% K3Fe(CN)6振荡,混合均匀。在50 ℃反应20 min,立即加入2.5 mL 10%三氯乙酸终止反应。取2.5 mL上述反应液和2.5 mL超纯水、0.5 mL 0.1% FeCl3振荡混合,静置反应10 min,在700 nm处测其吸光值[14]。
1.2.2 青梅酵素酶活力测定 将青梅酵素在4000 r/min、6 ℃条件下离心10 min,取上清液。以体积比为7∶13加入饱和硫酸铵,于4 ℃条件下盐析2 h,取上清液,备用[15]。
1.2.2.1 青梅酵素中脂肪酶活力测定参考Benjakul S等[16]的方法。规定1 mL酶液,于40 ℃,pH7.5条件下,水解脂肪每分钟产生1微摩尔的脂肪酸即为一个脂肪酶国际单位,以U/mL表示。
配制2%青梅酵素,以0.025 mol/L,pH7.5磷酸缓冲溶液为溶剂。量取4%PVA溶液加入50 mL橄榄油,用匀浆机处理9 min(分3次进行,每次3 min,间隔5 min),即获得乳白色的PVA乳化液。分别加4 mLPVA乳化液和5 mL磷酸缓冲溶液于A、B锥形瓶中。在往A瓶加入15 mL95%乙醇。于40 ℃水浴5 min后各加入1 mL样品液混匀。在40 ℃水浴反应15 min,再往B瓶加入15 mL95%乙醇。用0.005 mol/L NaOH滴定,记录其消耗体积,计算脂肪酶的活力。公式如下:
式中:X-样品液的酶活力;B-滴定样品所需NaOH体积,mL;A-滴定空白组时所需NaOH体积,mL;c-NaOH的浓度,mol/L;0.05为NaOH浓度换算系数;50为0.05 mol/L NaOH溶液1.00 mL;相当于脂肪酸50 μmol;1/15为反应时间15 min,以1 min计;n为稀释倍数。
1.2.2.2 青梅酵素中SOD活力测定 运用邻苯三酚自氧化法测定。按照表1试管加入Tris-HCI缓冲液(内含EDTA)和超纯水,在25 ℃预热20 min,取出。加入邻苯三酚(已25 ℃预热20 min),立即摇匀并在波长为325 nm下每30 s测定吸光值,记为A0。
测定酵素的吸光值参照表1,但预热20 min后先加入0.5 mL超纯水配制的不同浓度的青梅酵素再加入邻苯三酚。超纯水的使用量相应减少0.5 mL。测定其吸光值,记为ASOD。公式如下:

表1 邻苯三酚测定自氧化速率加样表Table 1 Pyrogallic acid determin autoxidation rate Sample list


式中:V1-反应液总体积,mL;V2-测定样品体积,mL;ΔA0-邻苯三酚的自氧化速率;ΔASOD-样品OD值变化速率;n-稀释倍数。
1.2.2.3 青梅酵素中蛋白酶活力测定 标准曲线的制作:参照国标GB/T 23527-2009《蛋白酶制剂》制作标准曲线。按照表2操作加入试剂后,振荡摇匀,40 ℃水浴加热20 min于680 nm处测其吸光值,以不含酪氨酸的空白管为空白。以吸光值为y轴,L-酪氨酸的浓度为x轴,绘制标准曲线。
灌区内两个气象站计算得到的春玉米日需水量变化过程和高度一致。计算得到春玉米生育期内总需水量约为510 mm,该值与赵春林在充分供水条件下(灌水量261~304 mm)得到的春玉米耗水量505.5~506.2 mm一致[15]。在春玉米总需水量中,苗期、生长期、开花灌浆期和成熟期的需水量分别占总需水量的15%、38%、3%6和11%,各阶段的日需水量分别约为2.4 mm/d、3.9 mm/d、4.3 mm/d和2.3 mm/d,生育期日需水量为3.3 mm/d。可以看出,作物需水最关键的时期为开花灌浆期,其次为生长期,成熟期和苗期的日需水量较小。

表2 蛋白酶标准曲线的制作Table 2 The standard curve making of protease
蛋白酶活力测定:1 mL不同浓度的酵素(经40 ℃恒温水浴2 min)与1 mL 1%酪蛋白溶液(经40 ℃恒温水浴5 min)混合液于40 ℃水浴反应10 min后,加入2 mL 0.4 mol/L的三氯乙酸终止反应。取出混合液摇匀,静置10 min,用慢速定性滤纸过滤。取1 mL滤液,加入5 mL 0.4 mol/mL的碳酸钠溶液与1 mL福林试剂溶液,摇匀。40 ℃水浴20 min后,用分光光度计于680 nm波长测定吸光度。空白对照组的设置为在加入酪蛋白溶液前,加入0.4 mol/L的三氯乙酸2 mL使酶失活,其他步骤与上述相同。根据标准曲线计算样品蛋白酶活力。公式如下:
式中:X-样品的酶活力,U/mL;A-根据标准曲线计算出样品稀释液的酶活力,U/mL;4-反应试剂的总体积,mL;n-稀释倍数;10-反应时间为10 min,以1 min计。
1.2.3 青梅酵素体外抑菌活性测定
1.2.3.1 菌悬液的制备 在无菌条件下,分别将金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌接种于牛肉膏蛋白胨斜面培养基上,在37 ℃培养18 h,活化两次。取1环活化过的菌种接种于5 mL液体培养基中,于37 ℃培养18 h后,对菌悬液进行平板计数,使菌悬液的菌数量控制在1×108~2×108CFU/mL,备用[17]。
1.2.3.2 青梅酵素抑菌活性的测定 吸取100 μL待测菌悬液于牛肉膏蛋白胨培养基上,用涂布器将菌悬液涂开。用镊子将无菌牛津杯轻放在培养基上,分别吸取0.2 mL经过孔径为0.22 μm滤膜处理的酵素于牛津杯中,以无菌水为空白对照。将培养基平放于37 ℃恒温培养18 h。平行实验3次,测量抑菌圈直径,取平均值[18]。
1.3 数据分析
采用Excel 2010进行数据处理和绘图,SPSS 19.0进行方差分析,结果表示为平均值±标准差(n=3)。
2 结果与分析
2.1 青梅酵素的抗氧化性
2.1.1 总抗氧化性 利用抗氧化物质可以将Mo(Ⅵ)还原为Mo(Ⅴ),并且在酸性的条件下形成绿色Mo(Ⅴ)的磷酸盐,通过测定其吸光值来评价青梅酵素的抗氧化性。两者呈正相关。吸光值越大,总抗氧化性越强。由图1可知,当VC浓度为120 μg/mL时,溶液吸光值为0.512。当青梅酵素浓度为0.3%时,溶液吸光值为0.568。浓度为0.25%时,青梅酵素总抗氧化性与100 μg/mL的VC抗氧化性相当。青梅酵素浓度为0.25%时,总抗氧化性增加迅速。青梅酵素总抗氧化性强可能是因为青梅果实中含有黄酮、VC、活性酶等抗氧化物质,青梅酵素中也相应含有这些成分。
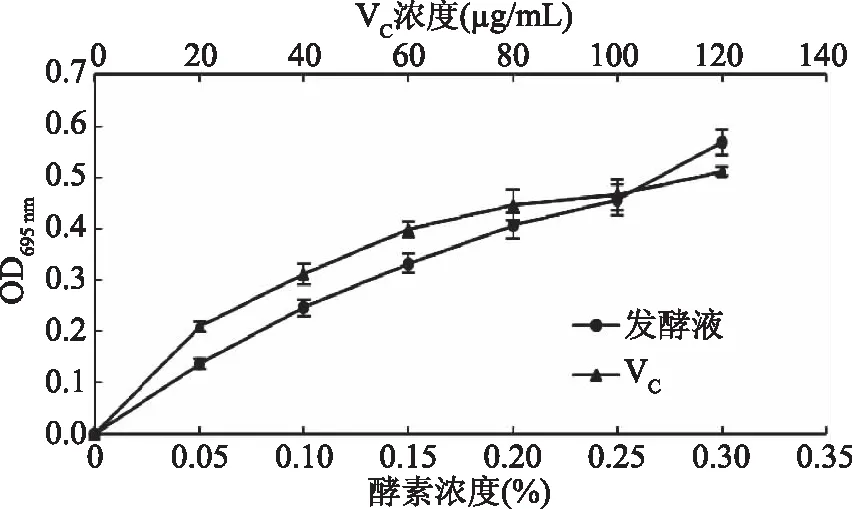
图1 不同浓度青梅酵素的总抗氧化性Fig.1 The total antioxidant capacity of greengage ferment at different concentrations
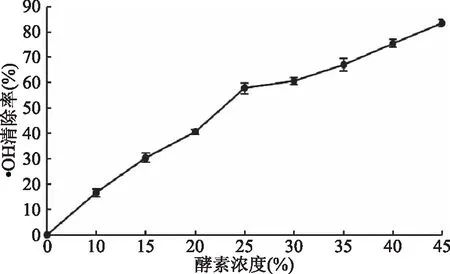
图2 不同浓度青梅酵素清除·OH的能力Fig.2 The ability to eliminate ·OH of greengage ferment at different concentrations
2.1.3 对DPPH·清除作用 目前,在测定果蔬制品抗氧化性时,还会采用DPPH法[12]。DPPH·中间是氮,电子数为奇数。其溶在无水乙醇中的溶液是一种很深的颜色—紫色。测定其吸光值的波长为517 nm。加入DPPH·清除剂与其单电子配对,能够降低吸光值。
由图3可知,青梅酵素对DPPH·具有较好的清除作用,且随着浓度的升高清除能力也增强。当青梅酵素的浓度为8%的时候,清除率达96.5%。董银卯[17]测定了10%浓度的火龙果酵素对DPPH·清除率为96%,二者相比,青梅酵素对DPPH·清除能力高于火龙果酵素。表明青梅酵素内含有较强的对DPPH·清除物质,可能是由于与青梅酵素内其他抗氧化物质共同作用的结果。
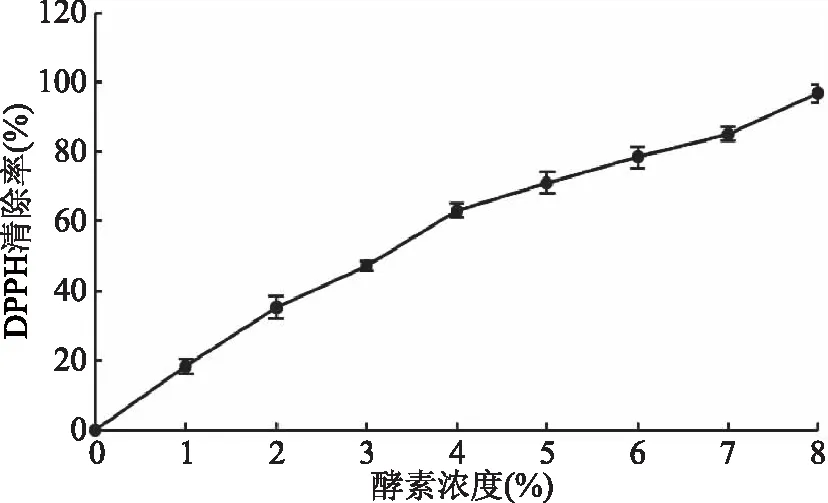
图3 不同浓度的青梅酵素清除DPPH·的能力Fig.3 The ability to eliminate DPPH· of greengage ferment at different concentrations
2.1.4 青梅酵素的还原力 测定青梅酵素还原力是评估其抗氧化性的一种方法。其还原力表现方法为测定吸光值的大小。
由图4可得,VC和酵素的还原力都表现出一定的浓度依赖效应,而且随着溶液浓度的升高,还原力也随着增强。酵素浓度在30%时,还原力有所降低。当VC浓度为120 μg/mL时,溶液吸光值为0.748。当青梅酵素浓度在25%的时候,吸光值为0.954。同时可知,浓度为15%的青梅酵素还原力相当于浓度为80 μg/mL的VC溶液。
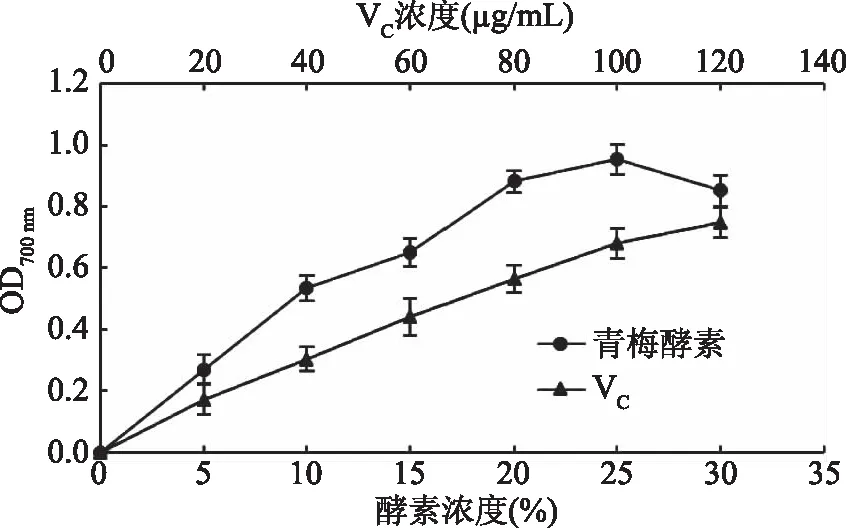
图4 不同浓度青梅酵素的还原力Fig.4 The reducing power of greengage ferment at different concentrations
2.2 青梅酵素的酶活力
2.2.1 青梅酵素的脂肪酶活力 以市售的橄榄油为底物,运用NaOH滴定法经计算得青梅酵素的脂肪酶活力是1.67 U/mL。由此可知,青梅酵素中存在脂肪酶活性,但活性较低。
2.2.2 青梅酵素的SOD活力 由图5所知,随着酵素浓度的增加,其抑制率和SOD活性也随之相应升高。在浓度为10%~20%时,SOD活性增加很快。当酵素的浓度为60%的时候,抑制率为100%。根据公式计算出,浓度60%时SOD的活性为57.89 U/mL。酵素浓度30%时,SOD活性最高,达到75.64 U/mL。随着浓度升高,酵素SOD活性有所降低,可能是因为酵素浓度高,部分SOD没有参与反应。与陈爽[15]、张梦梅[20]对液体酵素和市售酵素的SOD活性测定分别为10.758和41.7 U/mL相比,青梅酵素的SOD酶活力更高。
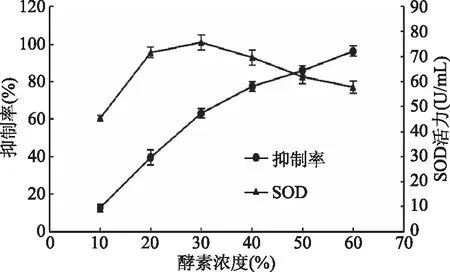
图5 青梅酵素的SOD活性Fig.5 The SOD enzyme activity of greengage ferment
2.2.3 青梅酵素的蛋白酶活力
2.2.3.1 标准曲线的制作 利用分光光度计测得标准酪氨酸在680 nm处的吸光值,绘制酪氨酸标准曲线,见图6。其中R2=0.9982,说明L-氨基酸与钨蓝和蓝色钼蓝的混合物具有很好的线性关系。可以利用该标准曲线测定酵素蛋白酶的活力。
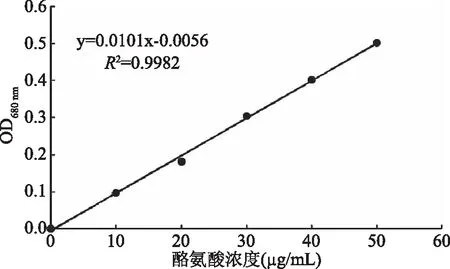
图6 酪氨酸的标准曲线Fig.6 The standard curve of tyrosine
2.2.3.2 蛋白酶活力 由图7可知,随着酵素浓度的增加,其蛋白酶活力也随之增强。当酵素浓度为15%的时候,其蛋白酶活力为15.84 U/mL。使用福林法测定蛋白酶活力能够降低酶活的损失,与陈爽[15]报道的12%浓度的水果酵素蛋白酶活力5.421 U/mL相比,蛋白酶活力要高。
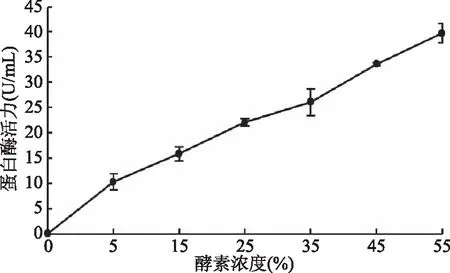
图7 青酶酵素的蛋白酶活性Fig.7 The protease activity of greengage ferment
2.3 青梅酵素的抑菌活性
由表3可知,青梅酵素对3种实验菌都有较强的抑制作用,均处于15~20 mm的高敏范围,同时抑菌圈直径差异显著(p<0.05)。陈虹[5]等所测定的青梅原汁对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌的抑菌圈直径分别为17.6、21.8、22.2 mm。与之相比,青梅经过发酵后对不同细菌的抑制作用发生了变化:青梅酵素对金黄色葡萄球菌的抑制作用有所增强,对枯草芽孢杆菌以及大肠杆菌的抑制作用减弱。

表3 青梅酵素的抑菌圈直径Table 3 Inhibitory zone diameter of greengage ferment
3 结论
青梅酵素的总抗氧化性较强,青梅酵素体积浓度为0.25%时,总抗氧化性与100 μg/mLVC溶液相当。清除DPPH·的能力强于清除·OH的能力:体积浓度为8%时,对DPPH·清除率达到96.5%;浓度为45%时,对·OH的清除率为83.2%。体积浓度为25%时,青梅酵素还原力最高,浓度为15%时,青梅酵素还原力相当于浓度为80 μg/mL的VC溶液。酵素体积浓度为30%时,超氧化物歧化酶(SOD)活力最高,为75.64 U/mL;体积浓度为15%时,蛋白酶活力为15.84 U/mL;脂肪酶活力较低,为1.67 U/mL。脂肪酶活力最低,表明青梅酵素消化脂肪的能力有限。青梅酵素对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌呈现较强的抑菌作用,抑菌圈直径分别为:(19.9±0.56)、(17.2±0.26)、(19.0±0.3) mm。
因此,青梅酵素作为一种天然的食品,具有较好的功能活性,可以满足人们对于天然功能性食品的需求,有进一步对其进行研究和开发实际的应用价值。
