烹饪过程中氯代溴代碘代类三卤甲烷生成的影响因素
2018-07-09李明阳
李明阳
(沈阳化工研究院设计工程有限公司,辽宁沈阳 110021)
氯因其对有害微生物有持久的灭活性而被广泛用于饮用水的消毒[1-2],但在消毒过程中会与水中的天然有机物、溴碘离子等发生反应生成多种消毒副产物[3-8]。自20世纪70年代 Rook 教授发现饮用水中消毒副产物三卤甲烷以来[9-10],至今已有700多种具有三致性的消毒副产物(isinfection by-products,DBPs)被检测出来[11-15]。
通常城市给水系统要求管网末端要存有一定的余氯量,因此当自来水被用于烹饪过程时,余氯就会与食物中的有机质比如脂肪、蛋白质、葡萄糖等发生反应生成消毒副产物[16-25]。目前已发现,当饮料或食物与氯化的饮用水接触反应时,会生成四种氯代三卤甲烷(trihalomethane,THMs)[17,26]。其中氯仿生成量最多,最易被检测出来,尤其是富含脂肪的食物。大约50%~70%的癌症风险来自于饮用水的摄入[19,27-28]。
西方的许多国家,尤其是美国,自来水通常是冰镇后饮用或直接饮用。而在亚洲的许多国家,尤其是中国,自来水通常经过煮沸后饮用或是用来沏茶和煮汤。因此,煮沸的自来水中的余氯与食物中的DBPs前驱物反应生成DBPs的量与温度在5~30 ℃生成量是不同的[25,29]。煮沸可以降低THMs的生成,但会增加卤乙酸(haloacetic acids,HAAs)和其他一些DBPs的生成。THMs的减少是由于加热过程中的挥发和分解作用,但分解反应也会同时生成其他一些DBPs[19-20]。
烹饪过程通常加入食盐,食盐中含有KIO3或KI,会影响DBPs的生成。研究发现,含有加碘食盐的水经过氯化在煮沸后或是在室温下长期储存会生成碘乙酸[24]。也有研究表明,在模拟的烹饪条件下会生成新的碘代和溴代消毒副产物[19]。目前有关烹饪过程中DBPs生成的研究还不是很全面,尤其是具有更大毒性的碘代类消毒副产物的研究更少[30-32]。我国乃至全球的烹饪过程都要加入含碘食盐[33],食盐中的碘会与自来水中的余氯、食物中的有机质在烹饪过程中反应生成碘代类消毒副产物。
本文通过模拟烹饪过程研究加热温度、食盐浓度以及余氯量对日常烹饪过程中碘代三卤甲烷(I-THMs)和氯代溴代三卤甲烷(Cl/Br-THMs)生成的影响,来评估日常饮食DBPs的暴露风险。
1 材料与方法
1.1 主要试剂及检测方法

表1 自来水水质背景值
I-THMs定量测定参考Cancho等[34]的方法,所用仪器为气相色谱仪GC-ECD(HP6890),毛细管柱为DB-1(30 m×0.25 mm×1.00 μm,胶联为100%聚二甲基硅氧烷)非极性毛细管柱;毛细管进样口温度为175 ℃,检测器温度为300 ℃。升温程序为从35 ℃开始保持9 min,然后以1 ℃/min 升至40 ℃,然后以6 ℃/min升至220 ℃保持10 min;采用不分流进样,载气为高纯氮气。
THMs(Cl/Br-THMs)定量测定参照美国标准方法[35],所用仪器为气相色谱仪 GC-ECD(HP6890),毛细管柱为DB-5[30 m×0.25 mm×0.25 μm,(5%-苯基)-甲基聚硅氧烷]非极性毛细管柱;毛细管进样口温度为200 ℃,检测器温度为350 ℃。升温程序为35 ℃开始保持12 min,然后以8 ℃/min 升至190 ℃,保持3 min;采用分流进样方式,分流比为10∶1,载气为高纯氮气。
1.2 模拟烹饪条件
1.2.1 加热温度的影响试验
试验模拟了四种烹饪条件,分别为自来水+食盐(300 μg/L以I 计)、自来水+KI(300 μg/L以 I 计)、自来水+食盐(300 μg/L以 I 计) +葡萄糖[17](10 mg/L)、自来水+KI(300 μg/L 以 I 计) +葡萄糖(10 mg/L)。密闭加热温度采用水浴锅分别控制在室温(25 ℃)、 35、 50、 65、80 ℃和100 ℃。葡萄糖浓度10 mg/L的选择是在做了葡萄糖浓度影响因素的试验之后选取的,葡萄糖浓度试验设置葡萄糖浓度为0、5、10、20、30、50、75、100 mg/L。发现10 mg/L就已生成明显的THMs。
1.2.2 食盐浓度的影响试验
试验模拟了四种烹饪条件,分别为自来水+食盐、自来水+KI、自来水+食盐+葡萄糖(10 mg/L)、自来水+KI+葡萄糖 (10 mg/L),同时在密闭室温(25 ℃)和密闭加热(100 ℃)两种情况下进行。食盐浓度和KI浓度(以I计)分别为0、 25、 75、 150、 200、 300 μg/L和 400 μg/L。
1.2.3 余氯量的影响试验
试验模拟了五种烹饪条件,分别为自来水、自来水+食盐(300 μg/L 以 I 计)、自来水+KI(300 μg/L以I计)、自来水+食盐(300 μg/L 以I计)+葡萄糖(10 mg/L)、自来水+KI(300 μg/L以 I 计)+葡萄糖(10 mg/L),同时在密闭室温(25 ℃)和密闭加
热(100 ℃) 两种情况下进行。余氯的浓度分别为0、 0.05、0.1、0.5、0.75 mg/L和 1.0 mg/L。
2 结果与讨论
2.1 加热温度对I-/Br-/Cl-THMs生成的影响
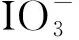
图1 加热温度对THMs生成总量的影响Fig.1 Effect of Heating Temperature on THMs Formation
对于I-THMs的生成种类,自来水+食盐和自来水+食盐+葡萄糖这两种试验条件下,只有CHCl2I生成,如图2(a)所示,当温度从25 ℃增加到100 ℃时,CHCl2I生成量从12 μg/L左右降低到1.0 μg/L左右。然而,自来水+KI和自来水+KI+葡萄糖这两种试验条件下,有CHCl2I、CHBrClI、CHBrI2、CHBr2I和CHI3五种I-THMs生成,如图2(b)所示,其中在较低温度下,CHCl2I是主要物质,但当温度升高至100 ℃时,其降低量约90%;相反,当温度从25 ℃增加到100 ℃时,CHBr2I和CHI3生成量增加,增加量约40%;CHBrClI在温度增加到50 ℃时才会生成。CHBrI2生成量随温度变化不是很明显。这说明在密闭加热过程中,I-THMs同时存在着分解和合成两种作用。其中,CHCl2I在受热过程中的分解作用占主导地位,且随着温度的增加分解作用越来越占优势;而CHBr2I和CHI3则相反,合成作用占主导地位,且随着温度的增加合成作用越来越占优势;CHBrClI只有在加热条件下才会合成。
对于Cl/Br-THMs的生成种类,四种模拟烹饪条件下,CHCl3、CHCl2Br、CHClBr2和CHBr3均有生成,以自来水+食盐+葡萄糖为例,如图2(c)所示,CHCl3、CHCl2Br、CHClBr2和CHBr3生成量均随着温度的升高先增加后降低,但峰值出现所对应的温度不同。其中CHCl3、CHCl2Br和CHClBr2峰值出现在65 ℃,而CHBr3峰值出现在80 ℃。由此可以看出,加热过程中,Cl/Br-THMs伴随着合成和分解两种反应,在较低温度范围内,合成作用占主导地位,生成量随温度的升高而增加;而继续升高温度,分解作用越来越强,逐渐占主导地位,因此生成量随温度升高而降低。
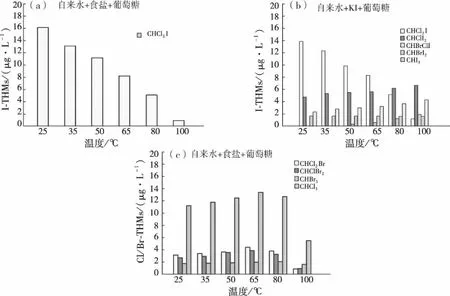
图2 加入含KIO3食盐和加入KI对THMs生成种类的影响Fig.2 Effect of Adding Table Salt Containing KIO3 and Adding KI on THMs Formation Species
2.2 食盐浓度对I-/Br-/Cl-THMs生成的影响
目前人们大多食用加碘食盐来预防碘缺乏,加碘食盐一般分为添加KI和添加KIO3两种,我国主要使用添加KIO3的食盐。本试验分别采用不同浓度的含KIO3食盐和KI(以I计)来对比研究食盐中碘离子浓度对I-/Br-/Cl-THMs生成的影响。试验模拟了四种烹饪条件,分别为自来水+食盐、自来水+KI、自来水+食盐+葡萄糖(10 mg/L)、自来水+KI+葡萄糖(10 mg/L),同时在密闭室温(25 ℃)和密闭加热(100 ℃)两种情况下进行。
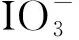
食盐浓度对I-THMs 生成有很大影响,同时摄入过多食盐会引起高血压、冠心病等疾病危害人体健康,所以烹饪过程中,要严格控制食盐的种类和加入量。
I-THMs生成物种类方面,如图4(a)所示,自来水+食盐、自来水+食盐+葡萄糖这两种模拟烹饪条件下,只有CHCl2I,其生成量随着食盐浓度(含碘量)的增加而增加。如图4(b)所示,自来水+KI、自来水+KI+葡萄糖这两种模拟烹饪条件下,在密闭室温25 ℃时,会生成 CHCl2I、CHBrI2、CHBr2I和CHI3四种 I-THMs;而在密闭加热100 ℃时,CHClI2和CHI3生成量增加,约为原来的2倍,CHCl2I和CHBrI2生成量减少,CHCl2I减少约80%,CHBrI2减少约10%,且会有新物质CHClBrI的生成。

图3 食盐浓度(含碘量)对THMs生成总量的影响Fig.3 Effect of Table Salt Concentration(Iodine Concentration) on THMs Formation

图4 加入含KIO3食盐和加入KI对THMs生成种类的影响Fig.4 Effect of Adding Table Salt Containing KIO3 and Adding KI on THMs Formation Species
Cl/Br-THMs生成物种类方面,四种模拟烹饪条件下,CHCl3、CHCl2Br、CHClBr2和CHBr3均有生成,以自来水+食盐+葡萄糖为例,在密闭室温25 ℃条件下,对于不同食盐浓度(含碘量),四种Cl/Br-THMs中,CHCl3都为主要物质。在密闭加热100 ℃条件下,由于分解作用占主导地位,CHCl3、CHCl2Br、CHClBr2和CHBr3均有所降低。
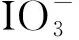
2.3 余氯量对I-/Br-/Cl-THMs生成的影响
为了抑制微生物的生长,许多国家强制要求自来水中保持一定的余氯量。例如,我国强制要求自来水中余氯量不得低于0.05 mg/L[39]。试验模拟了五种烹饪条件,分别为自来水、自来水+食盐、自来水+KI、自来水+食盐+葡萄糖、自来水+KI+葡萄糖,同时在密闭室温(25 ℃) 和密闭加热(100 ℃)两种情况下进行。
如图5所示,所有试验条件下,I-/Br-/Cl-THMs的生成量均随着余氯浓度的增加而增加。密闭室温25 ℃时,无论是加入含KIO3食盐还是加入KI的溶液,当余氯浓度从0.05 mg/L增加到1.0 mg/L时,I-THMs生成总量都增加接近30%。
但是,当温度升到100 ℃时,加入含KIO3食盐的溶液不再生成I-THMs,如图5(a)所示。对于Cl/Br-THMs,在两种温度条件下,当余氯浓度从0.05 mg/L增加到1.0 mg/L时,其生成量增加30%~70%,如图5(b)所示。
对于I-THMs的生成种类,如图6(a)所示,加入含KIO3食盐的溶液只会生成CHCl2I一种I-THMs,在密闭室温25 ℃时,其浓度随着余氯浓度的增加而增加,在密闭室温100 ℃时,不再生成;而加入KI的溶液,如图6(b)所示,在密闭室温25 ℃时,生成的I-THMs有CHCl2I、CHClI2和 CHI3三种;而在密闭加热100 ℃时,CHClI2和CHI3生成量增加,约为原来的2倍,CHCl2I不再生成,且会有新物质CHClBrI生成。
对于Cl/Br-THMs的生成种类,五种模拟烹饪条件下生成种类类似,以自来水+KI为例,如图6(c)所示,在密闭室温25 ℃和密闭加热100 ℃两种情况下,均会生成CHCl3、CHCl2Br、CHClBr2和CHBr3四种Cl/Br-THMs,其中CHCl3为主要物质,且只有CHCl3的生成量随着余氯浓度的增加有明显的增加,其他三种Cl/Br-THMs随余氯浓度的增加变化不明显。

图5 余氯对THMs生成总量的影响Fig.5 Effect of Residual Chlorine on THMs Formation
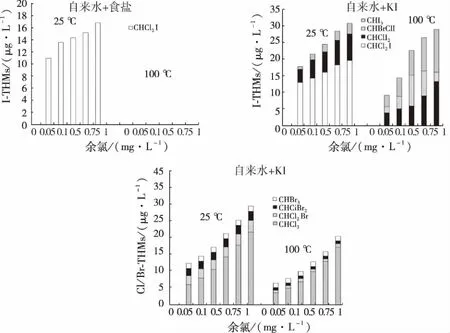
图6 加入含KIO3食盐和加入KI对THMs生成种类的影响Fig.6 Effect of Adding Table Salt Containing KIO3 and Adding KI on THMs Formation Species
3 结论
(1)烹饪过程中THMs的生成受加热温度的影响。密闭加热过程中,I-THMs不同种类随温度变化不同,但总量上随着温度的增加而减少。Cl/Br-THMs随着温度先增加后减少,峰值在65 ℃。建议烹饪过程尽量在敞开系统高温条件下进行,最大程度降低THMs的生成。
(2)烹饪过程中THMs的生成受食盐浓度和种类的影响。I-THMs随食盐浓度的增加而增加, Cl/Br-THMs随食盐浓度的增加而减少。我国主要采用含KIO3的食盐,而加拿大等国家采用含KI的食盐。相比之下,我国食盐比国外食盐在烹饪过程中产生的I-THMs的种类和量少。因此建议人们日常烹饪过程中选择含KIO3的食盐,并注意加入量。
(3)烹饪过程中THMs的生成受自来水中余氯量的影响。I-THMs、Cl/Br-THMs均随余氯的增加而增加,因此要严格把关用户端的余氯量。
(4)烹饪过程中THMs的生成受营养物质的影响。食物中通常含有淀粉、蛋白质、脂肪等多种营养物质,会对烹饪过程中消毒副产物的生成有一定影响。
[1]SEIDEL C J,MCGUIRE M J,SUMMERS R S,et al.Have utilities switched to chloramines[J].Journal American Water Works Association,2005,97(10): 87-97.
[2]MCGUIRE M J.Eight revolutions in the history of US drinking water disinfection[J].Journal American Water Works Association,2006,98(3):123-149.
[3]BICHSEL Y,VON GUNTEN U.Formation of iodo-trihalomethanes during disinfection and oxidation of iodide containing waters[J].Environmental Science & Technology,2000,34(13): 2784-2791.
[4]PLEWA M J,MUELLNER M G,RICHARDSON S D,et al.Occurrence,synthesis,and mammalian cell cytotoxicity and genotoxicity of haloacetamides: An emerging class of nitrogenous drinking water disinfection byproducts[J].Environmental Science & Technology,2008,42(3): 955-961.
[5]RICHARDSON S D,PLEWA M J,WAGNER E D,et al.Occurrence,genotoxicity,and carcinogenicity of regulated and emerging disinfection by-products in drinking water: A review and roadmap for research[J].Mutation Research,2007,636(1-3):178-242.
[6]YE T,XU B,LIN Y L,et al.Formation of iodinated disinfection by-products during oxidation of iodide-containing water with potassium permanganate[J].Journal of Hazardous Materials,2012,38(22):348-354.
[7]BOND T,KAMAL N H M,BONNISSEAU T,et al.Disinfection by-product formation from the chlorination and chloramination of amines[J].Journal of Hazardous Materials,2014,40(11):288-296.
[8]CHUANG Y H,TUNG H H.Formation of trichloronitromethane and dichloroacetonitrile in natural waters: Precursor characterization,kinetics and interpretation[J].Journal of Hazardous Materials,2015,41(3):218-226.
[9]ROOK J J.Formation of haloforms during chlorination of natural water[J].Water Treat.Exam,1974,23:234-243.
[10]BELLAR T A,LICHTENBERG J J,KRONER R C.The occurrence of organohalides in chlorinated drinking waters[J].Journal American Water Works Association,1974,66(12): 703-706.
[11]PLEWA M J,WAGNER E D.Mammalian cell cytotoxicity and genotoxicity of disinfection by-products[J].Water Research Foundation,2009.
[12]ARBUCKLE T E,HRUDEY S E,KRASNER S W,et al.Assessing exposure in epidemiologic studies to disinfection by-products in drinking water:Report from an international workshop[J].Environmental Health Perspectives,2002,110(s1):53-60.
[13]BOORMAN G A,DELLARCO V,DUNNICK J K,et al.Drinking water disinfection byproducts:Review and approach to toxicity evaluation[J].Environmental Health Perspectives,1999,107(s1): 207-217.
[14]RICHARDSON S D,FASANO F,ELLINGTON J J,et al.Occurrence and mammalian cell toxicity of iodinated disinfection byproducts in drinking water[J].Environmental Science & Technology,2008,42(22): 8330-8338.
[15]SMITH E M,PLEWA M J,LINDELL C L,et al.Comparison of byproduct formation in waters treated with chlorine and iodine:Relevance to point-of-use treatment[J].Environmental Science & Technology,2010,44(22): 8446-8452.
[16]HUANG A T,BATTERMAN S.Formation of trihalomethanes in beverages and foods[J].Epidemiology,2002,13(4):107.
[17]HUANG A T,BATTERMAN S.Formation of trihalomethanes in foods and beverages[J].Food Additives & Contaminants: Part A,2009,26(7): 947-957.
[18]KRASNER S W,WRIGHT J M.The effect of boiling water on disinfection by-product exposure[J].Water Research,2005,39(5): 855-864.
[19]PAN Y,ZHANG X,WAGNER E D,et al.Boiling of simulated tap water:Effect on polar brominated disinfection byproducts,halogen speciation,and cytotoxicity[J].Environmental Science & Technology,2014,48(1): 149-156.
[20]WEISEL C P,CHEN W J.Exposure to chlorination by-products from hot-water uses[J].Risk Analysis,1994,14(1): 101-106.
[21]WU W W,BENJAMIN M M,KORSHIN G V.Effects of thermal treatment on halogenated disinfection by-products in drinking water[J].Water Research,2001,35(15): 3545-3550.
[22]FUKAYAMA M Y,TAN H.WHEELER W B,et al.Reactions of aqueous chlorine and chlorine dioxide with model food compounds[J].Environmental Health Perspectives,1986,69(4): 267-274.
[23]KIRK J R,MITCHELL S K.Risks and benefits associated with chlorine in the food industry: Water chlorination[J].Environ.Chlor.Org.Compd,1980,273: 218-225.
[24]BECALSKI A,LAU B P Y,SCHRADER T J,et al.Formation of iodoacetic acids during cooking:Interaction of iodized table salt with chlorinated drinking water[J].Food Additives & Contaminants,2006,23 (10):957-962.
[25]LEUESQUE S,RODRIGUEZ M J,SERODES J,et al.Proulx,Effects of indoor drinking water handling on trihalomethanes and haloacetic acids[J].Water Research,2006,40(15): 2921-2930.
[26]RESCH P,GUTHY K.Chloroform in milk and dairy products.B: Transfer of chloroform from cleaning and disinfection agents to dairy products via CIP[J].Deutsche Lebensmittel-Rundschau,2000,96(1) : 9-16.
[27]LEE S C,GUO H S,LAM M J,et al.Multipathway risk assessment on disinfection by-products of drinking water in Hong Kong[J].Environmental Research,2004,94(1):47-56.
[28]CHOWDHURY S,RODRIGUEZ M J,SERODES J.Model development for predicting changes in DBP exposure concentrations during indoor handling of tap water[J].Science of the Total Environment,2010,408(20): 4733-4743.
[29]TAN H,SEN A C,WHEELER W B,et al.A kinetic-study of the reaction of aqueous chlorine and chlorine dioxide with amino-acids,peptides and proteins[J].Journal of Food Science,1987,52(6): 1706-1711.
[30]BATTERMAN S,HUANG A T,WANG S G,et al.Reduction of ingestion exposure to trihalomethanes due to volatilization[J].Environmental Science & Technology,2000,34(20): 4418-4424.
[31]ALLARD S,NOTTLE C E,CHAN A,et al.Ozonation of iodide-containing waters: Selective oxidation of iodide to iodate with simultaneous minimization of bromate and I-THMs[J].Water Research,2013,47(6): 1953-1960.
[32]Allard S,TAN J,JOLL C A,et al.A mechanistic study on the formation of Cl-/Br-/I-trihalomethanes during chlorination/chloramination combined with a theoretical cytotoxicity evaluation[J].Environmental Science & Technology,2015,49(18): 11105-11114.
[33]DE BENOIST B,MCLEAN E,ANDERSSON M,et al.Iodine deficiency in 2007: Global progress since 2003[J].Food Nutrition Bulletin,2008,29(3):195-202.
[34]CANCHO B,VENTURA F,GALCERAN M,et al.Determination,synthesis,and survey of iodinated trihalomethanes in water treatment processes[J].Water Research,2000,34(13): 3380-3390.
[35]Method 552.3:Determination of haloacetic acids and dalapon in drinking water by liquid-liquid microextraction,derivatization,and gas chromatography with electron capture detection: EPA 815-B-03-002.Revision 1.0[S].
[36]BICHSEL Y,VON GUNTEN U.Oxidation of iodide and hypoiodous acid in the disinfection of natural waters[J].Environmental Science & Technology,1999,33(22): 4040-4045.
[37]HE S,YAN M,KORSHIN G V.Spectroscopic examination of effects of iodide on the chloramination of natural organic matter[J].Water Research,2015,49(5):449-457.
[38]SHIMAMOTO Y S,TAKAHASHI Y,TERADA Y.Formation of organic iodine supplied as iodide in a soil-water system in Chiba,Japan[J].Environmental Science & Technology,2011,45(6): 2086-2092.
[39]Health standards for drinking water quality: GB 5749—2006[S].
