基于常规MRI图像的纹理分析鉴别:血管周细胞瘤/孤立性纤维瘤与血管瘤型脑膜瘤
2018-07-02董俊伊苗延巍刘双韩亮李晓欣刘杨颖秋宋清伟韦玉山刘爱连
董俊伊,苗延巍*,刘双,韩亮,李晓欣,刘杨颖秋,宋清伟,韦玉山,刘爱连
血管周细胞瘤(hemanyiopericytoma,HPC)在中枢神经系统较少见,约占脑肿瘤的1%[1-2]。HPC是来源于脑膜间质血管外皮细胞的一种恶性肿瘤,具有明显的侵袭性,术后不仅可以复发,而且可以向脑外转移[3]。而血管瘤型脑膜瘤(hemangioma meningioma,HM)起源于蛛网膜绒毛顶端的帽状细胞,以良性肿瘤居多,其多数预后良好,如切除彻底,可获永久性治愈[4-5]。HPC与HM在治疗及预后方面完全不同,所以对于两者的术前鉴别是非常必要的。有研究显示HPC在形态、大小、信号(囊变坏死,血管流空影)、与硬脑膜关系等方面与HM存在显著差异[5]。在常规情况下,磁共振成像(magnetic resonance imaging,MRI)是鉴别HPC与HM的首选方法,然而由于两者的发病部位以及MRI表现非常相似,因此如果仅依靠肉眼分析影像学征象的方法来鉴别两者,临床误诊率较高。而纹理分析是一种新的图像分析方法[6],已应用于头颈部、子宫、直肠等恶性肿瘤分级或评估预后[7-12]。另外,以往对肿瘤的定量大多采用选择局部感兴趣区(region of interest,ROI)法,但这种方法不能全面、准确地反映肿瘤整体的异质性,并且这种方法存在个人选择误差及样本误差[13-14]。基于肿瘤全域的ROI方法则涵盖了整个肿瘤,消除了潜在的抽样偏差,可以提供更全面的肿瘤异质性的信息[11,15-17]。目前尚无肿瘤全域基于常规MRI序列的纹理分析血管周细胞瘤及血管瘤型脑膜瘤的相关报道。因此,本研究拟探讨基于常规MRI图像,肿瘤全域的纹理分析在两者的鉴别诊断价值。
1 材料与方法
1.1 临床资料
回顾性收集自2010年1月至2017年3月在大连医科大学附属第一医院进行MRI扫描,并手术或活检病理证实的HPC及HM患者22例。入组标准:(1)术后组织学诊断依据《WHO 2016版中枢神经系统肿瘤分类》[18];(2) MRI扫描前未行手术、穿刺,也未行放化疗;检查前已签署知情同意书;(3)均使用GE Signa HDxt 3.0 T进行常规MRI序列T1WI、T2WI、T1WI增强扫描。5例患者因图像部分丢失或图像质量欠佳(n=2)及MRI扫描前已进行手术(n=3)被排除。最终共有17例患者入组,其中HPC 8例(男1例,女7例),年龄(66.0±22.3)岁;HM 9例(男4例,女5例),年龄(57.0±21.5)岁。
1.2 数据采集
本研究采用美国GE Signa HDxt 3.0 T MRI扫描仪,患者仰卧位,采用标准头线圈。MRI平扫序列包括:快速自旋回波(fast spin echo,FSE)T1WI矢状位及轴位、FSE T2WI 轴位。然后行T1WI增强扫描,依次采用三维结构像扫描(threedimensional brain volume,3D BRAVO)及自旋回波(spin echo,SE)序列T1WI轴位,增强扫描用钆贲替酸葡甲胺,经肘静脉注射,剂量0.1 mmol/kg,注射流速3.0 ml/s。具体扫描参数见表1。
1.3 图像处理
将T1WI、T2WI、T1WI增强图的DICOM格式数据拷贝至个人电脑,导入Omni-Kinetics软件得到相应的信号强度图进行后处理。结合T2WI及T1WI增强图确认肿瘤实质、水肿区,沿肿瘤水肿的边缘逐层手动描绘ROI,涵盖全部肿瘤实质部分及水肿区域,保证T1WI、T2WI、T1WI增强图的ROI范围一致。将所有层面的ROI累加为一个3D ROI (图1),软件将分别自动计算出相应强度直方图。记录肿瘤全域的纹理参数,包括最小值、最大值、平均值、标准差、相对偏差、体素数、偏度、峰度、一致性、百分位数、均方根值、值域、平均差、集群阴影、集群突出。
1.4 统计学处理
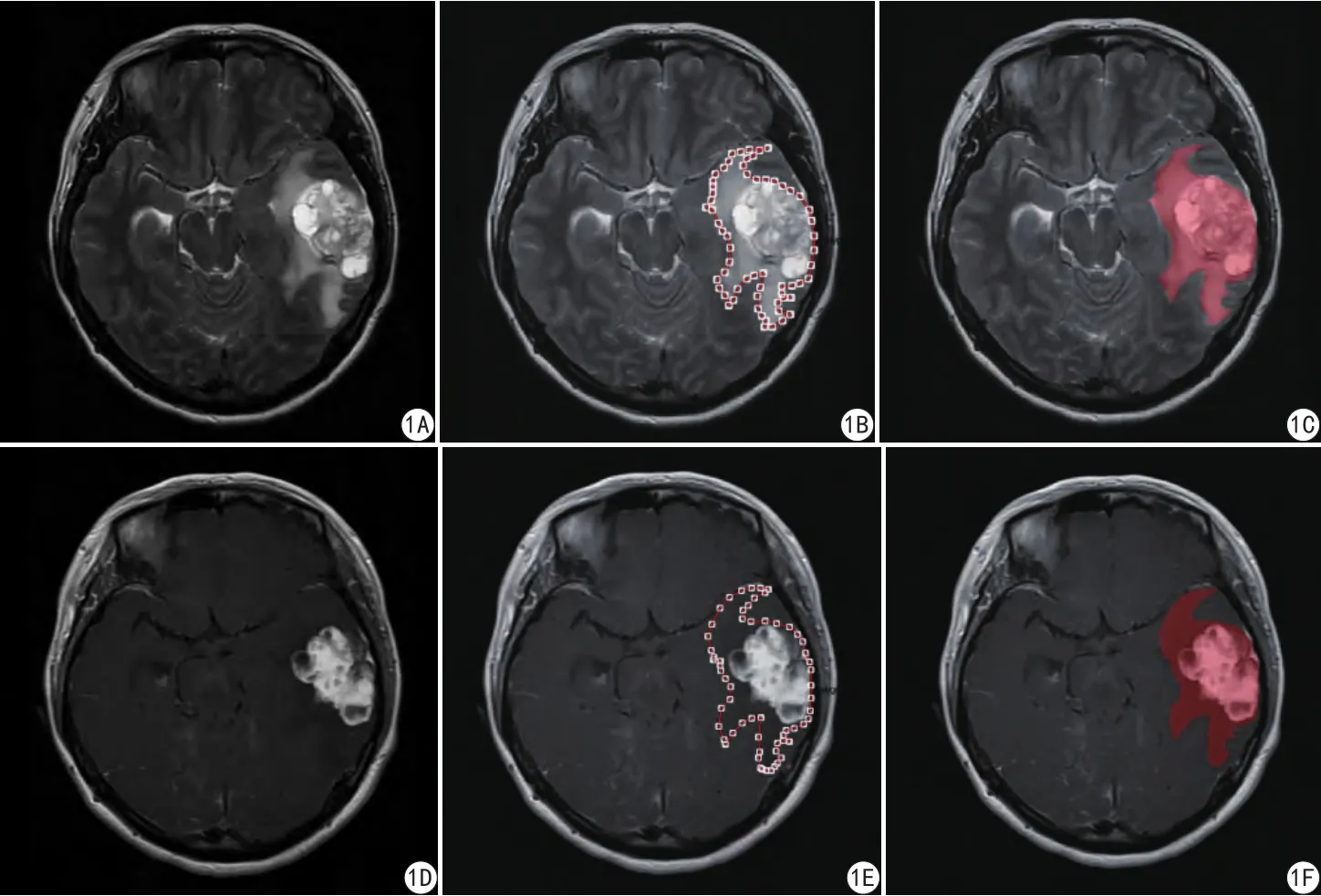
图1 A、D为肿瘤T2、增强T1原始图;B、E为利用Omni-Kinetics软件描绘出肿瘤T2、增强T1的ROI;C、F为各层面叠加计算出的肿瘤T2、增强T1的3D ROI图像(红色)Fig. 1 Image analysis work flow, the work flow for image analysis is presented. A, D were T2WI and enhanced T1WI images of the tumor; B, E were ROIs which further delineated based on the Omni-Kinetics software; C, F were the 3D ROI image(red) that further calculated at all levels.
应用统计软件包SPSS 17.0进行数据分析。将本研究中HPC与血管瘤型脑膜瘤的发病年龄、性别及影像特征进行统计学分析,其中计数资料组间比较采用Fisher确切概率法,计量资料组间比较采用两独立样本t检验;采用Mann-Whitney U检验进行肿瘤间对照分析。对于有统计学意义的纹理参数,利用受试者操作特性(receiver operating characteristic,ROC)曲线来确定各纹理参数对于鉴别HPC及HM诊断的效能。
2 结果
2.1 一般资料及影像学征象差异
本研究中HPC约87.5%(7/8)呈分叶状或不规则形,而HM约77.8%(7/9)呈类圆形或椭圆形,并且HPC与HM的形态学差异具有统计学意义(P<0.05)。本研究中囊变坏死在HPC较HM更多见;HPC与HM的瘤周水肿程度不同,HPC多为轻中度水肿(5/8),而HM以中重度水肿(7/9)为主,但两者囊变坏死以及瘤周水肿之间的差异无统计学意义。而且本研究中HPC与HM患者的年龄、性别,以及HPC与HM肿瘤的大小、T1WI信号、T2WI信号、血管流空影、与脑膜附着形式、脑膜尾征、瘤内出血、中线结构移位等因素差异均无统计学意义(P>0.05)。详见表2。

表1 扫描序列及参数Tab. 1 Scan sequence and parameters
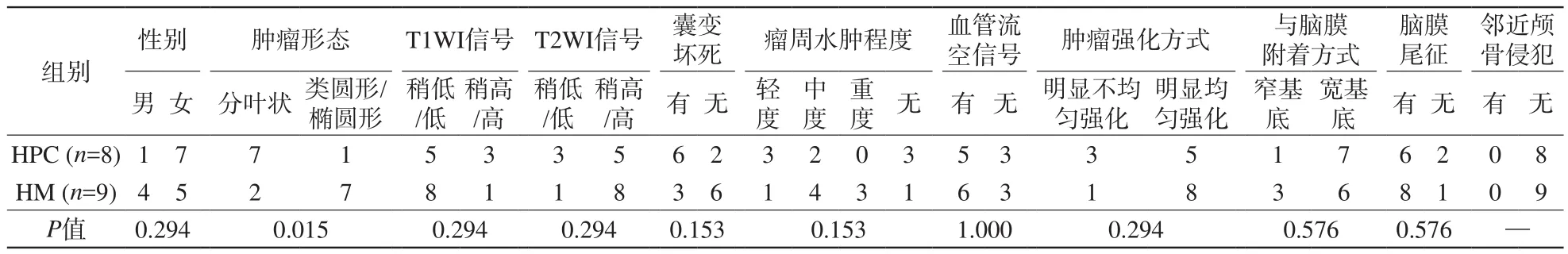
表2 HPC组与HM组的常规资料及影像表现对比Tab. 2 The comparative analysis of general data and different imaging signs in both HPC and HM

续表2 HPC组与HM组的常规资料及影像表现对比Tab.2 (Cont) The comparative analysis of general data and different imaging signs in both HPC and HM
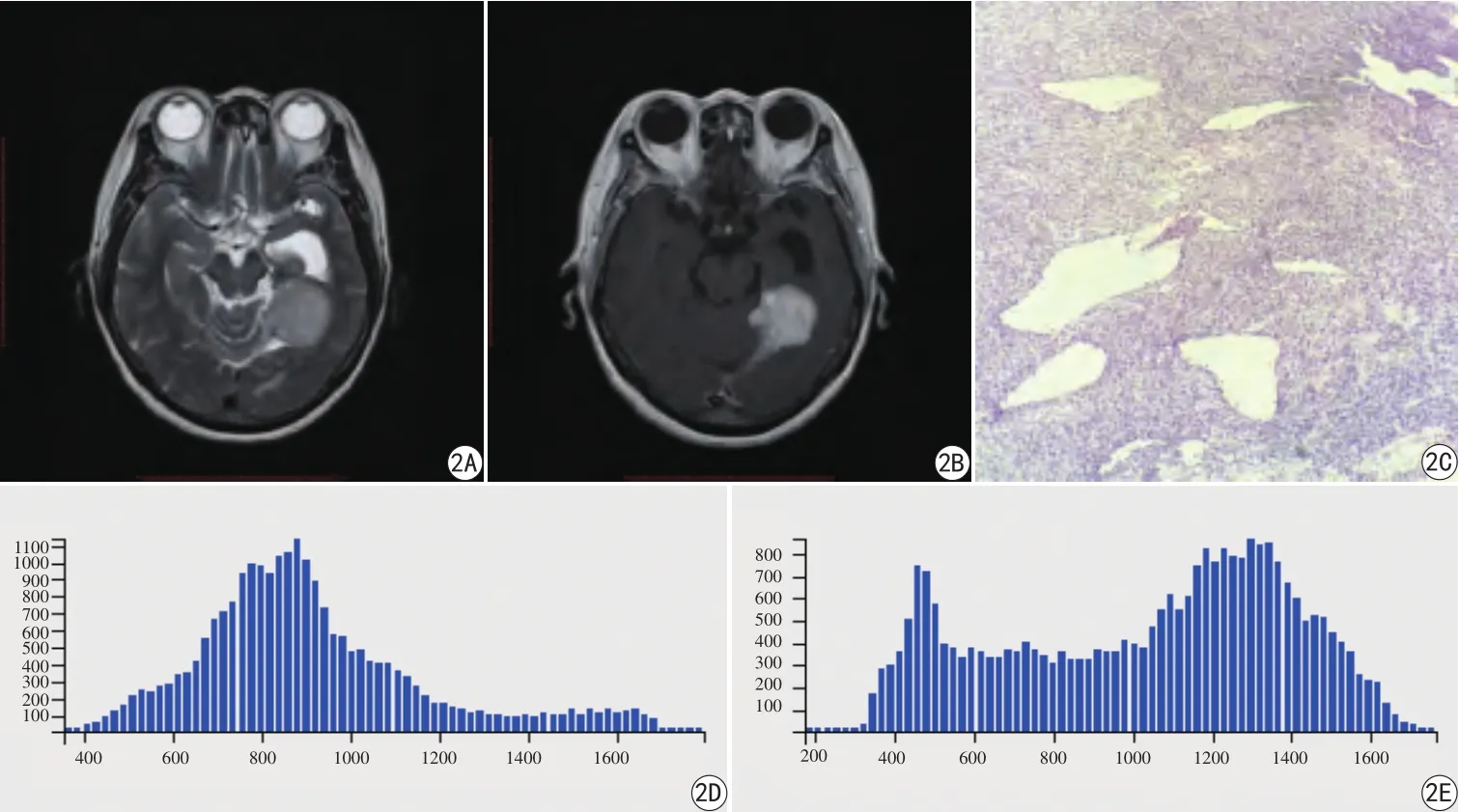
图2 女,62岁,左侧颞部血管周细胞瘤。A:T2WI示肿瘤信号混杂,周围可见片状水肿样信号影;B:T1增强示增强扫描肿瘤明显强化;C:病理图显示镜下可见大量梭形或多角形细胞,细胞核卵圆形,深染,偶见核分裂像,细胞排列致密,多围绕血管分布(HE× 100);D: T2WI信号值的直方图,示图像中心左偏;E:T1WI增强信号值的直方图。T2WI直方图偏度值及峰度值为0.96、3.83,T1WI增强直方图偏度值及峰度值为-0.32、1.91Fig. 2 Female, 62 years old, left temporal HPC. A: T2WI shows slight high signal intensity with the surrounding patchy edema area. B: The contrasted T1WI shows the homogenous enhancement of tumor; C: Pathology of HPC:microscopically, abundant branches or antlers-shaped thin-walled vessels in tumor stroma, the tumor cells exhibit a dense and diffuse growth pattern with ovoid nuclei (HE × 100); D: The T2WI signal value histogram shows the image center is left skewed, with skewness and kurtosis value of 0.96 and 3.83; E: The contrasted T1WI signal histogram shows widen double leak with skewness and kurtosis of -0.32 and 1.91.
2.2 纹理参数差异
在T1增强信号强度图像纹理参数中,HPC的平均差和偏度明显高于HM (P<0.05),而前者的最小值、平均值、均方根值、平均差、均一性、第5、10、25、50(中位数)、75、90百分位数明显低于后者(P<0.05)。见表3。
T2信号强度图像纹理参数中,HPC的偏度、集群阴影、集群突出明显高于HM(P<0.05),而前者的
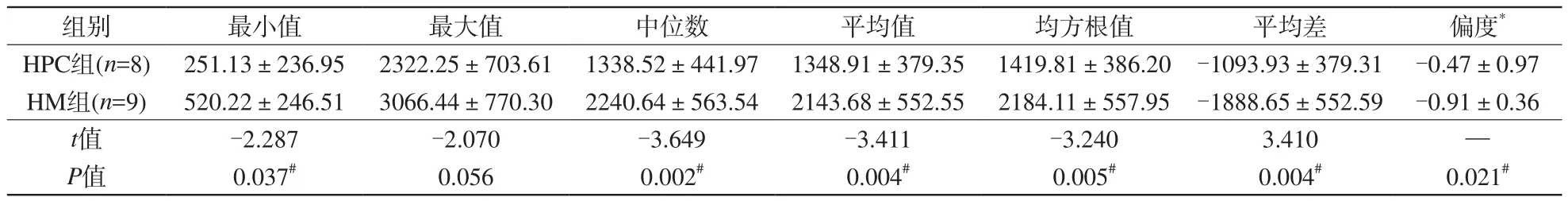
表3 血管周细胞瘤及血管瘤型脑膜瘤增强T1信号强度图像纹理参数差异Tab. 3 Difference of contrasted T1WI signal intensity texture parameters between HM and HPC

续表3 血管周细胞瘤及血管瘤型脑膜瘤增强T1信号强度图像纹理参数差异Tab. 3 (Cont) Difference of contrasted T1WI signal intensity texture parameters between HM and HPC
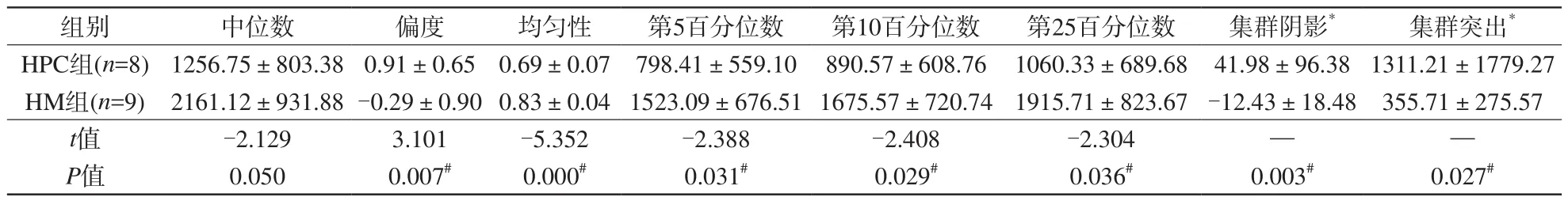
表4 血管周细胞瘤及血管瘤型脑膜瘤T2信号强度图像纹理参数差异Tab.4 Difference of T2WI signal intensity texture parameters between HM and HPC

图3 女,58岁,左侧颞部血管瘤型脑膜瘤。A:T2WI示肿瘤呈稍高信号,周围亦可见片状水肿样信号影;B:T1增强示增强扫描肿瘤明显均匀强化;C:病理图显示镜下可见丰富血管组织,管壁厚薄不一,血管间可见小团或散在增生的脑膜皮细胞(HE×100);D、E分别为其T2WI信号值及T1WI增强信号值的直方图,示图像中心均明显右偏。T2WI直方图偏度值及峰度值分别为-0.32、3.95,T1WI增强直方图偏度值及峰度值分别为-1.11、3.60Fig. 3 Female, 58 years old, left temporal HM. A: T2WI shows markedly high signal intensity with the surrounding patchy edema area; B: The contrasted T1WI shows homogenous enhancement of tumor; C: Pathology of HM: a large number of blood vessels with thick and thin wall scattering in tumor stroma, and between the blood vessels can see small groups or scattered proliferative meningitis cells (HE ×100); D: The T2WI signal value histogram show the center of the image is clearly right with skewness and kurtosis of -0.32 and 3.95; E: The contrasted T1WI signal histogram also show the center of the image is clearly right with skewness and kurtosis value were -1.11, 3.60.

表5 T1增强信号强度图像纹理参数鉴别血管周细胞瘤及血管瘤型脑膜瘤的效能Tab.5 ROC results for contrasted T1WI signal intensity texture parameters
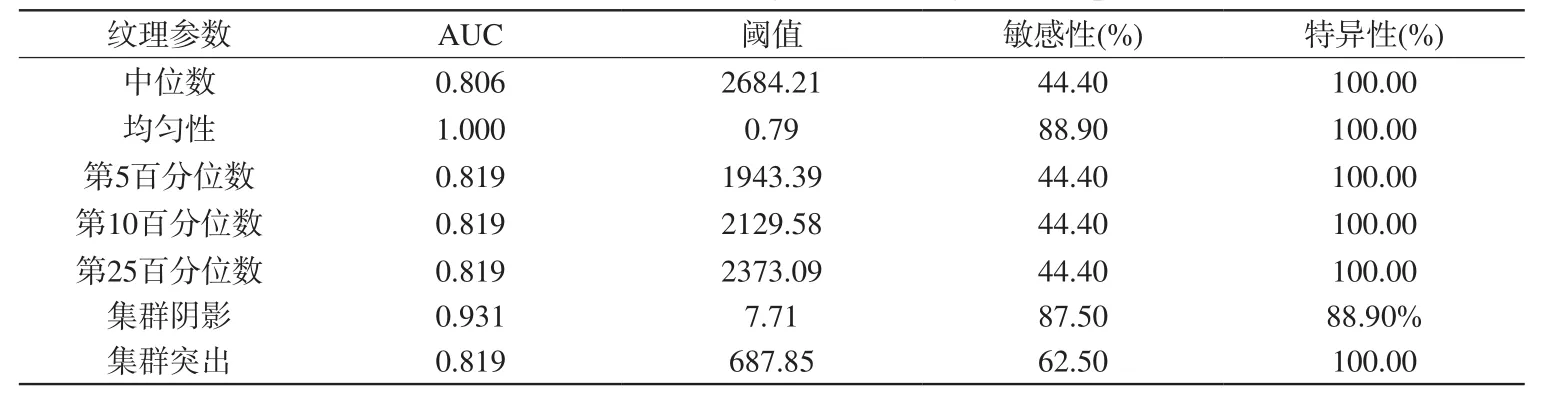
表6 T2信号强度图像纹理参数鉴别血管周细胞瘤及血管瘤型脑膜瘤的效能Tab.6 ROC results for T2WI signal intensity texture parameters
注:*代表符合非正态分布,用中位值±四分位间距表示;余符合正态分布,用均值±标准差表示。#代表P<0.05均一性、第5、10、25百分位数明显低于后者(P<0.05)。而两种肿瘤间T1信号强度图像各纹理参数值差异均无统计学意义(P>0.05)。见表4。
本研究中,HPC T2WI信号值直方图的图像中心明显左偏,T1WI增强信号值直方图的图像表现为高、低双峰,而高峰的主体偏右。HM T2WI信号值及T1WI增强信号值直方图的图像中心均表现出明显右偏(图2、3)。
2.3 两种肿瘤纹理参数的ROC曲线分析
R O C曲线分析显示,T1增强信号中,以第25百分位数1873.07为阈值鉴别HPC与HM的曲线下面积(area under the curve,AUC)最大,诊断能力最佳(AUC=0.917),敏感性及特异性分别为66.7%、100.0%,而中位值(第50百分位数)的诊断能力次之(AUC=0.903);T2信号中,以均一性0.79为阈值鉴别二者的诊断能力最佳(AUC=1.00),敏感性及特异性分别为88.9%、100%,而集群阴影诊断能力次之(AUC=0.931),见表5、6。
3 讨论
3.1 HPC与HM常规影像学、病理表现
本研究显示HPC与HM在形态学上差异具有统计学意义(P<0.05),即HPC多呈分叶状或不规则状,可能因为HPC各部位生长速度不一致,而且与侵袭性生长有关[19-20],而HM多为类圆形及椭圆形;由于HPC肿瘤生长速度过快,侵蚀肿瘤的部分滋养血管,肿瘤血供减少,从而导致HPC中囊变坏死较HM更常见[5],这与本研究结果一致。本研究中,HPC多表现为轻中度瘤周水肿,是由肿瘤迅速浸润临近脑组织导致,而HM多表现为中重度瘤周水肿,可能与血管源性水肿有关[5]。并且以往有研究显示HPC常具有丰富的血管流空现象,MRI信号多不均匀,无肿瘤内钙化和骨质增生、局部颅骨呈溶骨性破坏,而HM这些表现相对少见,所以其信号多较均匀;MRI增强示HPC和HM肿瘤实体均呈显著增强效应,但HPC肿瘤实质多为不均匀性强化,而HM肿瘤多为均匀显著强化[21]。有研究发现ADC值对于HPC及不同亚型脑膜瘤之间的鉴别有一定的价值,但其结果显示HPC的mADC及NADC值与HM差异无统计学意义[22]。在病理表现方面,HPC镜下(图3C)显示肿瘤细胞主要由密集的梭形细胞构成,血管大小不等,较有特异性的表现为包绕着肿瘤细胞,并环绕着毛细血管内皮细胞、向外放射状走行网状纤维[23],而HM镜下(图4C)显示肿瘤瘤组织为增生丰富的厚壁、薄壁血管,其间有散在分布的脑膜上皮细胞[19]。综上所述,HPC与HM在MRI表现以及病理表现上具有特征性鉴别点,但在大多数情况下,HPC与HM的常规MRI表现有较多相似之处,鉴别诊断极其困难,而且病理检查属于有创检查,不能作为鉴别诊断的首选。
3.2 纹理分析在HPC与HM鉴别中的应用
基于像素分布的纹理分析是通过计算整个组织内部信号值,并分别以MR信号值以及相同信号范围内像素值为X轴和Y轴,可用来测量ROI的平均信号值、像素数及像素数信号变化范围,提供定量的肿瘤异质性信息[24-27]。本研究表明,通过涵盖肿瘤实质和水肿区域的全域测量,两种肿瘤增强T1WI图像纹理参数中的最小值、平均值、均方根值、平均差、偏度、均一性、百分位数差异均存在统计学意义(P<0.05),除了平均差和偏度,其余HM各参数值均高于HPC。HM的峰度值高于HPC,表示HM图像的灰度分布更集中于平均灰度附近[28-29]。笔者认为这主要是由于HM内瘤细胞多均匀分布,结构致密,而HPC内细胞成分混杂所致,但差异并不显著。本研究中的HPC与HM的偏度值均偏向于负值,其绝对值HPC低于HM。笔者认为发生此现象的原因主要是由于HPC存在较多坏死、囊变,使得曲线分布向左偏移;而HM实质成分较均匀,偏度较大,曲线右偏。而各值区的增强T1WI参数差异均有统计学意义(P<0.05),有理由推断上述各参数对于两者之间的鉴别诊断均有意义,而且第25百分位数、第50百分位数(或中位数)具有较好的诊断效能,可能会是相对较为可靠的鉴别诊断参数。
均一性反映的是肿瘤ROI内的异质性程度,数值越小,表明ROI内灰阶强度值分布越不均匀,或者说数值范围大小越大,异质性程度越大[30]。本研究中增强T1WI、T2WI信号的均一性差异存在统计学意义(P<0.05),HM的均一性均高于HPC,说明后者异质性程度较前者更明显,瘤内存在更多的出血、囊变或坏死。在本研究中,T2WI信号图像纹理参数中HM的第10百分位数、第25百分位数均显著高于HPC,说明低值区的T2WI信号强度对于两者之间的诊断更有意义。集群阴影与集群突出均为衡量灰度共生矩阵偏度和一致性的指标,两者的值越高,说明不对称性更大,本研究显示HPC中上述两参数均显著高于HM,与HPC的恶性肿瘤异质性明显相吻合。本研究结果显示,以均一性鉴别HPC与HM诊断效能最佳,当阈值为0.79时,ROC曲线AUC为1.00,敏感性及特异性分别为88.9%、100%,这有望作为鉴别二者的一个良好的影像学指标。
3.3 不足之处
本研究也存在局限性。首先,本研究是回顾性研究,无法在外科手术切除前或切除中获得更多信息。其次,由于HPC与HM均属于少见肿瘤,因此研究样本量相对较小,可能会对结果造成一些影响,例如本研究出现AUC为1的情况,这极有可能是由于病例数过小所导致的,因此笔者将继续收集和总结病例资料,为进一步提高HPC与HM的精确诊断率积累资料。
参考文献 [References]
[1]Yu GY, Liu XB. Study on the incidence of warthin tumor in parotid gland. J Oral Maxil Surg, 1997, 7(2): 88-91.俞光岩, 柳晓冰. 腮腺沃辛瘤发病情况分析. 口腔颌面外科杂志,1997, 7(2): 88-91.
[2]Wang JH, Tan YH, Zhang G. Clinical analysis of 52 cases of cystadenolymphoma (Warthin' s tumor)in parotid gland. Acta Acad Med Mil Tert, 2004, 26(1): 4.王建华, 谭颖徽, 张纲. 腮腺腺淋巴瘤52例临床分析. 第三军医大学学报, 2004, 26(1): 4.
[3]Zhang J, Du GH. Clinical analysis of 106 cases of central nervous system hemangiopericytoma. Chin J Neurosurg, 2010, 26(10): 935-937.张颉, 杜固宏. 中枢神经系统血管外皮细胞瘤106例临床分析. 中华神经外科杂志, 2010, 26(10): 935-937.
[4]Liu ML, Han T, Liu L, et al. MRI features and pathological analysis of hemangiopericytoma occurred in the central nervous system. J Chin Comput Med Imag, 2007, 13(6): 389-396.刘梅丽, 韩彤, 刘力, 等. 中枢神经系统血管外皮细胞瘤的MRI表现与病理分析. 中国医学计算机成像杂志, 2007, 13(6): 389-396.
[5]Chen R, Peng DC, Hu ZL, et al. Differences in MRI findings between intracranial hemangiopericytoma and angiomatous meningioma.Chin J Magn Reson Imaging, 2016, 7(3): 173-179.陈荣, 彭德昌, 胡祖力, 等. 颅内血管周细胞瘤与血管瘤型脑膜瘤的磁共振成像征象对比分析. 磁共振成像, 2016, 7(3): 173-179.
[6]Shahabaz, Somwanshi DK, Yadav AK, et al. Medical images texture analysis: A review. International Conference on Computer,Communications and Electronics. IEEE, 2017: 436-441.
[7]Tozer DJ, Jäger HR, Danchaivijitr N, et al. Apparent diffusion coeffcient histograms may predict low-grade glioma subtype. NMR Biomed, 2007, 20(1): 49-57.
[8]Ahn SJ, Choi SH, Kim YJ, et al. Histogram analysis of apparent diffusion coefficient map of standard and high B-value diffusion MR imaging in head and neck squamous cell carcinoma: a correlation study with histological grade. Acad Radiol, 2012, 19(10): 1233-1240.
[9]Suo ST, Chen XX, Fan Y, et al. Histogram analysis of apparent diffusion coefficient at 3.0 T in urinary bladder lesions: correlation with pathologic findings. Acad Radiol, 2014, 21(8): 1027-1034.
[10]Ma X, Zhao X, Ouyang H, et al. Quantified ADC histogram analysis:a new method for differentiating mass-forming focal pancreatitis from pancreatic cancer. Acta Radiol, 2014, 55(7): 785-792.
[11]Woo S, Cho JY, Kim SY, et al. Histogram analysis of apparent diffusion coefficient map of diffusion-weighted MRI in endometrial cancer: a preliminary correlation study with histological grade. Acta Radiol, 2014, 55(10): 1270-1277.
[12]Cho SH, Kim GC, Jang YJ, et al. Locally advanced rectal cancer:post-chemoradiotherapy ADC histogram analysis for predicting a complete response. Acta Radiol, 2015, 56(9): 1042-1050.
[13]Kang Y, Choi SH, Kim YJ, et al. Gliomas: histogram analysis of apparent diffusion coefficient maps with standard or high-b-value diffusion-weighted MR imaging-correlation with tumor grade.Radiology, 2011, 261(3): 882.
[14]Just N. Improving tumour heterogeneity MRI assessment with histograms. Br J Cancer, 2014, 111(12): 2205-2213.
[15]Ahn SJ, Choi SH, Kim YJ, et al. Histogram analysis of apparent diffusion coefficient map of standard and high B-value diffusion MR imaging in head and neck squamous cell carcinoma: a correlation study with histological grade. Acad Radiol, 2012, 19(10): 1233.
[16]Jin RY, Hong CS, Joon PS, et al. Glioma: application of whole-tumor texture analysis of diffusion-weighted imaging for the evaluation of tumor heterogeneity. PLoS One, 2014, 9(9): e108335.
[17]Zhang YD, Wang Q, Wu CJ, et al. The histogram analysis of diffusion-weighted intravoxel incoherent motion (IVIM) imaging for differentiating the gleason grade of prostate cancer. Eur Radiol, 2015,25(4): 994.
[18]Louis DN, Perry A, Refenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system :a summary. Acta Neuropathol, 2016, 131(6): 803-820.
[19]Bai LC, Zhou JL, Xu R, et al. MRI features of intracranial anaplastic hemangiopericytoma. J Pract Radiol, 2012, 28(8): 1186-1188.白亮彩, 周俊林, 徐瑞, 等. 颅内间变型血管周细胞瘤的MR特征.实用放射学杂志, 2012, 28(8): 1186-1188.
[20]Wei XH, Zhou JL, Li WP, et al. Correlation between cystic necrosis of cranio-hemangiopericytoma and the expression of P73. J Chin Clin Med Imaging, 2010, 21(1): 9-12.魏晓辉, 周俊林, 黎卫平, 等. 颅内血管外皮细胞瘤囊变坏死与P73表达相关性的研究. 中国临床医学影像杂志, 2010, 21(1): 9-12.
[21]Zhou JL, Zhao JH, He N, et al. Comparison of MRI sign and pathological findings in intracranial hemangiopericytomas and angiomatous type meningioma. J Chin Clin Med Imaging, 2006,17(12): 669-678.周俊林, 赵建洪, 何宁, 等. 颅内血管外皮细胞瘤与血管瘤型脑膜瘤的MRI与病理对照. 中国临床医学影像杂志, 2006, 17(12): 669-672.
[22]Li Q, Zhou BJ, He HJ, et al. Application of ADC values in differentiating hemangiopericytomas from meningiomas. J Chin Comput Med Imag, 2015, 21(5): 419-425.李桥, 周碧婧, 何慧瑾, 等. ADC值在鉴别血管外皮细胞瘤与脑膜瘤中的应用. 中国医学计算机成像杂志, 2015, 21(5): 419-425.
[23]Tang F, Liu H. MRI manifestations of intracranial hemangiopericytoma:comparison study with pathological findings. J Clin Radiol, 2014,33(9): 1438-1441.唐菲, 刘辉. 颅内血管周细胞瘤的MRI表现与病理对照分析. 临床放射学杂志, 2014, 33(9): 1438-1441.
[24]Shang Z, Li M. Combined feature extraction and selection in texture analysis. International Symposium on Computational Intelligence and Design. IEEE, 2017: 398-401.
[25]Zhang S, Li YL, Huang S. Post contrast-enhanced T1WI histogram analysis for differentiating glioblastom from solitary brain metastasis.Chin J Med Imaging, 2017, 25(2): 89-92.张胜, 李玉林, 黄送. 增强T1WI直方图在胶质母细胞瘤和脑单发转移瘤鉴别诊断中的应用. 中国医学影像学杂志, 2017, 25(2): 89-92.
[26]Xu XQ, Hu H, Su GY, et al. Utility of histogram analysis of ADC maps for differentiating orbital tumors. Diagn Interv Radiol, 2016,22(2): 161.
[27]Liu H, Wang XY, Long XY. Research progress and clinical application of tumor heterogeneity based on CT texture analysis. Int J Med Radiol, 2016, 29(5): 543-548.刘慧, 王小宜, 龙学颖. 基于CT图像纹理分析肿瘤异质性的研究进展及应用. 国际医学放射学杂志, 2016, 29(5): 543-548.
[28]Wesseling P, Ruiter DJ, Burger PC. Angiogenesis in brain tumors;pathobiological and clinical aspects. J Neurooncol, 1997,32(3): 253-265.
[29]Bakry A, Elfadil M, Osama F. Characterizations of brain glioma in MRI using image texture analysis. LAP LAMBERT Academic Publishing, 2017.
[30]Lubner MG, Smith AD, Sandrasegaran K, et al. CT texture analysis:definitions, applications, biologic correlates, and challenges.Radiographics, 2017, 37(5): 1483-1503.
