缺氧微环境调控Twist促进人肝癌细胞株SMMC-7721的上皮间质转化
2018-06-29成都医学院基础医学院四川成都60500成都医学院第一附属医院四川成都60500
,, , ,,, (.成都医学院基础医学院, 四川 成都 60500;.成都医学院第一附属医院,四川 成都 60500)
原发性肝细胞癌(hepatocellular carcinoma,HCC)发病率位居我国恶性肿瘤前列,而肝炎-肝硬化-肝癌这一序贯步骤的发生使得肝癌的发病基础极其广泛。由于肝癌在发病初期临床症状不明显,易被忽视,就诊时多已到晚期,已发生癌旁和远处器官的侵袭转移。晚期肝癌的治疗和预后很差,且肝癌术后极易发生转移和再复发[1]。因此,肝癌远处侵袭转移的具体机制研究一直是肝癌领域研究热点。恶性肿瘤的发生和发展依赖于其特定的微环境,而肿瘤局部的缺血缺氧是构成微环境的一部分[2]。缺氧微环境在多种恶性肿瘤的远处侵袭和迁移中扮演重要角色,但是其如何发挥作用目前鲜有报道。上皮间质转化(epithelial-mesenchymal transition,EMT)指恶性肿瘤上皮细胞在体内外多种刺激因素的长期作用下,通过启动特定程序来使上皮表型细胞逐渐转化为具有间质表型的细胞的复杂过程[3-4]。EMT程序的异常激活与多种恶性肿瘤的发生发展紧密关联。研究表明,EMT过程受多个转录因子的调控,其中Twist作为EMT 启动的关键调控因子,也参与了多种恶性肿瘤的侵袭转移[5-6]。本研究旨在体外模拟缺氧条件下Twist基因的表达变化及其对人肝癌SMMC-7721细胞EMT过程的调控机制。
1 资料与方法
1.1 材料
人肝癌SMMC-7721细胞株购自深圳赛恩斯细胞科技有限公司;TRIzol RNA 提取试剂购自日本宝生物;本研究所用PCR引物的设计与合成均委托天津拜恩斯瑞生物科技公司完成;多克隆兔抗人HIF-1α、E-cadherin、Vimentin、Twist1和β-actin抗体购自美国Santa Cruz公司,辣根酶标记羊抗小鼠或抗兔IgG购自上海瑞伊和源生物科技公司;中分子量Protein marker 购自Thermo Fisher公司;ECL超敏型化学发光试剂盒购自上海百谷歌生物科技公司;胎牛血清购自GIBCO 公司;DMEM-H培养基购自美国GIBCO公司; 0.45 mm PVDF膜购自美国Millipore公司;6孔板、25 cm2塑料培养瓶以及24孔Transwell小室(孔径8 μm)均购自海狸生物科技有限公司;Transwell小室侵袭实验所用细胞级基质胶(Matrigel)购自湖南佳浩能生物科技公司;Co170R-230-0200三气细胞培养箱(用于模拟缺氧细胞培养环境)购自德国Eppendorf公司;倒置相差显微镜购自日本Olympus公司。
1.2 细胞培养
人肝癌细胞株SMMC-7721细胞使用含10%胎牛血清、1%青链霉素混合液的DMEM-H培养基进行培养,放置于5%CO2浓度37 ℃恒温细胞培养箱中。培养48 h之后,当细胞铺满培养瓶采用0.25%胰蛋白酶消化传代,随后取状态较好且处于对数生长期的细胞进行后续实验。细胞分别在常氧和低氧条件下培养24 h,随后进行相关实验检测。为了研究Twist基因的作用,我们进一步分为低氧组、低氧下转染si NC组以及低氧下转染Twist组。
1.3 siRNA的设计、合成和目的基因的转染
Twist siRNA干扰片段由广州锐博生物有限公司设计合成,设计3条针对Twist基因的特异siRNA,其序列如下:siRNA1靶序列:5’-CCTCTGCATTCTGATAGAA-3’,siRNA2靶序列:5’-AAGAGGTGGATATGTCTGG-3’,siRNA3靶序列:5’-GCTGAAACATGCAGTTGTA-3’;及1条无义干扰序列siN05815122147-1-5作为阴性对照组。转染siRNA实验分为空白对照组(细胞中除培养液外不加任何试剂)、阴性对照组(细胞中加入细胞培养液、NC-siRNA、转染试剂)和干扰组(细胞中加入细胞培养液、siRNA Twist转染试剂)。转染前1 d,将对数生长期的细胞按2×105个/孔的细胞密度接种6孔板中,待细胞融合度达40%~50%时,按照转染试剂盒说明书进行基因转染实验。37 ℃、5%CO2条件下继续培养24 h 或48 h 后于荧光显微镜下观察转染阳性细胞数,计算细胞转染率。细胞转染率(%)=转染阳性细胞数/细胞总数×100%。
1.4 逆转录聚合酶链式反应(RT-PCR)
β-actin引物序列:上游5’-TCAGGCGTCTGTAGAGGCTT-3’,下游5’-ATGCACATCCTTCGATAAGACTG-3’;HIF-1α引物序列:上游5’-AGCTTCCAGACACGCTATCAT-3’,下游5’-CGGTACAACGAGCTGTTTCTAC-3’E-cadherin 引物序列:上游5’-ATTTTTCCCTCGACACCCGAT-3’,下游5’-TCCCAGGCGTAGACCAAGA-3’;Vimentin引物序列:上游5’-AGTCCACTGAGTACCGGAGAC-3’,下游5’-CATTTCACGCATCTGGCGTTC-3’。PCR 反应条件:94 ℃预变性2 min,94 ℃变性20 s,56 ℃退火1 min,72 ℃延伸30 s。
1.5 Western blot检测
将已处理好的SMMC-7721细胞系用PBS洗涤3次,随后加入RIPA裂解液并用细胞刮刀刮下放入1.5 mL EP管中冰上裂解30 min。随后于12 000 r/min离心10 min并将蛋白上清液冻存于-20 ℃。使用5x蛋白上样缓冲液混匀蛋白上清后于95 ℃中加热10 min,待其充分变性。上机跑电泳,随后转膜并置于5%脱脂牛奶中封闭1 h。封闭结束后使用TBST洗膜3次,每次5 min,随后将膜置于多克隆兔抗人的β-catenin(浓度1∶1 000)和多克隆兔抗人β-actin(浓度1∶3 000)中4 ℃孵育过夜。次日,洗膜3次,每次5 min,置于辣根酶标记羊抗兔IgG中室温孵育2 h。TBST洗膜3次,每次5 min,采用ECL化学发光法金鼎显影。应用Quantity One软件分析条带灰度值并作统计分析。
1.6 肿瘤细胞侵袭实验
将Matrigel胶 (Matrigel原液与无血清培养基之比为1∶3铺在小室上面,置于37 ℃培养箱中待用。将SMMC-7721细胞系在无血清DMEM培养基中饥饿处理4 h后,将其消化、重悬。上室加入无血清细胞悬液200 μL(细胞量4×105/mL),下室加入含20%FBS的DMEM高糖细胞培养基,每孔600 μL,培养箱中培养48 h。处理完成后取出小室,用PBS洗涤3次,并用湿棉签轻柔擦除上室面的细胞,随后置于4%多聚甲醛中固定20 min。取出室温下风干3~5 min,随后置于结晶紫染料中染色15 min。最后用PBS洗涤3次,并置于倒置显微镜下观察穿过微孔膜的细胞数量,并进行统计分析。
1.7 统计学方法
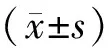
2 结果
2.1 低氧条件下肝癌SMMC-7721细胞形态学改变
在常氧环境下,肝癌SMMC-7721细胞呈典型上皮细胞样形态,各个细胞之间排列紧密,相互连接。在低氧环境下刺激24 h之后,低氧组中细胞极性消失,由连接紧密的扁平状上皮形态逐渐变成连接松散的长梭形狭长形态细胞,细胞排列分散,呈现游走状态(图1)。
2.2 低氧微环境诱导肝癌SMMC-7721细胞EMT发生
肝癌SMMC-7721细胞在常氧条件和低氧条件下培养24 h之后,RT-PCR及Western blot结果显示,与常氧培养组相比,低氧处理组中SMMC-7721细胞的上皮表型蛋白E-cadherin的mRNA和蛋白表达水平显著降低,而间质表型蛋白Vimentin的mRNA和蛋白表达水平显著升高,同时伴有低氧诱导因子HIF-1α的显著上调(图2、3)。

a:常氧环境下SMMC-7721细胞形态;b:低氧环境下SMMC-7721细胞形态
图1低氧微环境诱导SMMC-7721细胞EMT(×400)
2.3 低氧微环境增强肝癌SMMC-7721细胞的体外侵袭能力
经过常氧和低氧环境下分别处理24 h后,与常氧组相比,低氧处理组SMMC-7721细胞的侵袭能力显著增强(图4)。
2.4 沉默Twist1表达抑制低氧诱导的EMT
通过使用Twist1靶向沉默siRNA来抑制其表达,进一步检测Twist1在低氧诱导的EMT中的作用。RT-PCR和Western blot结果表明,靶向沉默Twist后,低氧微环境诱导的EMT过程被显著逆转,伴随着E-cadherin mRNA和蛋白表达水平的表达增高和Vimentin mRNA和蛋白表达水平表达下降(图5、6)。
2.5 沉默Twist1表达减弱低氧诱导的体外侵袭能力
在Transwell小室侵袭实验中,发现在使用Twist1靶向沉默siRNA阻断其表达后,低氧培养的SMMC-7721细胞的侵袭能力被显著削弱(图7)。

a:HIF-1α mRNA表达;b:E-cadherin mRNA表达;c:Vimentin mRNA表达 #:P<0.01图2 RT-PCR结果定量分析

a:Western blot检测HIF-1α、E-cadherin、Vimentin蛋白表达;b、c、d:Western blot结果定量分析 #:P<0.01图3 Western blot检测HIF-1α、E-cadherin、Vimentin蛋白表达

a:常氧组;b:低氧组;c:侵袭能力统计分析柱状图 #:P<0.01图4 低氧微环境增强肝癌SMMC-7221细胞侵袭能力(结晶紫染色 ×200)

a:Twist mRNA相对表达水平;b:E-cadherin mRNA相对表达水平;c:Vimentin mRNA相对表达水平 *:P<0.05; #:P<0.01图5 RT-PCR定量分析Twist、E-cadherin、Vimentin mRNA表达

a:Western blot检测Twist、E-cadherin、Vimentin蛋白表达;b、c、d:Western blot结果定量分析 *:P<0.05; #:P<0.01图6 Western blot检测Twist、E-cadherin、Vimentin蛋白表达

a:低氧组;b:低氧+si NC组;c:低氧+si Twist组;d:Transwell侵袭实验检测细胞侵袭能力定量分析 #:P<0.01图7 Transwell侵袭实验检测细胞侵袭能力(结晶紫染色 ×200)
3 讨论
恶性肿瘤最主要的特征是浸润和远处侵袭转移,既往研究表明约90%的癌症患者死于恶性肿瘤的转移。肝细胞癌作为一种快速生长的恶性肿瘤,血供极其丰富,早期便有高度的血管侵犯和转移能力,导致60%~80%的患者诊断时即为肝癌晚期,且根治性切除机会极少,从而丧失了治疗机会[7]。实体瘤在生长过程中由于肿瘤细胞的快速增殖,而局部新生血管形成相对滞后,使得局部肿瘤组织的血液供应不足,导致肿瘤细胞处于缺血缺氧微环境[8-9]。低氧作为肿瘤微环境的基本特征,同时也参与恶性肿瘤的侵袭转移、增殖、凋亡等生物学行为的调控[10-12]。作为最常见的实体瘤,原发性肝癌的生长异常迅速,使得局部肿瘤细胞处于缺氧微环境中,尤以巨块型肝癌最常见。既往研究表明,原发性肝癌组织中低氧诱导因子(HIF-1α)表达水平显著升高,并与临床预后呈负相关[13-14]。此外,原发性肝癌组织中处于慢性缺氧环境下的肿瘤细胞具有更强的侵袭转移能力,而EMT过程的启动可能在其中起着关键作用[15-16]。
EMT是一个高度保守的过程,其通过特定程序使具有黏附形态的上皮细胞极性消失、失去细胞间紧密连接,并突破基底膜成为侵袭能力更强的间质细胞。EMT过程不仅参与胚胎形态的形成、多种组织器官的发育以及慢性退行性纤维化变,而且在恶性肿瘤的侵袭转移过程中也扮演重要角色[17]。EMT的发生常伴随着上皮细胞表型标志物E-cadherin的下调,间质细胞表型标志物Vimentin的上调[18]。研究证实,多种因素能够诱导EMT的发生,而低氧微环境是重要的EMT诱导因素之一[19]。局部缺血缺氧微环境能引起卵巢癌[20]、前列腺癌[21]等多种肿瘤细胞发生EMT特征的转变,提高其侵袭转移能力。
Twist是一类新发现的癌基因,主要参与细胞分化和胚胎的发育过程,也是EMT 过程中的关键调控因子[22-23]。研究证实,Twist与临床上多种恶性肿瘤的发生发展紧密联系,包括乳腺癌[24]、前列腺癌[25]、胃癌[26]以及肝癌[27]等,这些研究均显示Twist在这些肿瘤组织中呈现高表达。另有研究表明,在肿瘤缺氧条件下存在Twist基因的异常激活,其通过调控下游靶基因对一系列诸如细胞凋亡、增殖、凋亡、侵袭等生物学事件进行干预,最终影响多种肿瘤的发生发展[28-29]。但是在低氧微环境下Twist基因在肝细胞癌EMT中的中的作用及其调控机制目前鲜有报道。
本实验中,我们首先将SMMC-7721细胞分别在常氧和低氧环境下培养,并采用RT-PCR和Western blot技术验证了体外低氧微环境是否能够诱导SMMC-7721 细胞EMT的发生。结果表明,与常氧对照组相比,在低氧环境下培养24 h后的,SMMC-7721 细胞的形态由最初的多边形向成纤维样细胞形态改变,呈长梭形、纺锤状。同时并伴随着上皮表型蛋白E-cadherin表达的下降和间质表型蛋白Vimentin表达的升高。Transwell结果也证实低氧刺激后发生EMT的SMMC-7721 细胞具有更强的侵袭潜能。接下来我们进一步对EMT的关键调控基因Twist进行检测,结果显示,低氧环境下培养24 h后SMMC-7721 细胞中Twist基因显著激活,提示其可能参与低氧环境下SMMC-7721 细胞EMT过程。为了明确Twist基因在其中的作用机制,我们通过特异性Twist si-RNA来靶向沉默阻断其表达,并进一步检测其对细胞EMT启动和侵袭能力影响。研究发现,在靶向沉默Twist基因之后,低氧介导的SMMC-7721 细胞EMT过程和侵袭现象被逆转,表明Twist基因在这一过程中起着关键作用。基于以上研究,我们推测低氧微环境通过激活Twist基因来调控SMMC-7721 细胞EMT过程和体外侵袭转移,最终促进肝癌的远处转移和复发。
综上所述,本研究初步证实在肝癌SMMC-7721 细胞中低氧微环境能够通过激活Twist基因来诱导EMT的发生和肿瘤细胞的侵袭转移。因此,深入研究Twist基因在肝癌EMT过程中的作用及其调节机制,通过靶向阻断Twist基因,从而逆转EMT过程并抑制肿瘤细胞侵袭转移,这将为肝细胞癌的侵袭转移的预防和特异性治疗提供新的思路和理论依据。
[参考文献]
[1] Schlachterman A,Craft WWJr.,Hilgenfeldt E,et al.Current and future treatments for hepatocellular carcinoma[J].World J gastroenterolo,2015,21(28):8478-8491.doi:10.3748/wjg.v21.i28.8478.
[2] Manoochehri Khoshinani H,Afshar S,Najafi R.Hypoxia:A double-edged sword in cancer therapy[J].Cancer Invest,2016,34(10):536-545.doi:10.1080/07357907.2016.1245317.
[3] Chen T,You Y,Jiang H,et al.Epithelial-mesenchymal transition(EMT):a biological process in the development,stem cell differentiation and tumorigenesis[J].J cell physiol,2017,12(13):341-322.doi:10.1002/jcp.25797.
[4] Smith BN,Bhowmick NA.Role of EMT in metastasis and therapy resistance[J].J Clin Med,2016,5(2):12-17.doi:10.3390/jcm5020017.
[5] Yang J,Hou Y,Zhou M,et al.Twist induces epithelial-mesenchymal transition and cell motility in breast cancer via ITGB1-FAK/ILK signaling axis and its associated downstream network[J].Int J Biochem Cell Biol,2016,71:62-71.doi:10.1016/j.biocel.2015.12.004.
[6] Yao C,Li P,Song H,et al.CXCL12/CXCR4 axis upregulates twist to induce EMT in human glioblastoma[J].Mol Neurobiol,2016,53(6):3948-3953.doi:10.1007/s12035-015-9340-x.
[7] Hu B,An HM,Wang SS,et al.Preventive and therapeutic effects of chinese herbal compounds against hepatocellular carcinoma[J].Molecules,2016,21(2):142.doi:10.3390/molecules21020142.
[8] Chiche J,Ricci JE,Pouyssegur J.Tumor hypoxia and metabolism-towards novel anticancer approaches[J].Ann Endocrinol,2013,74(2):111-114.doi 10.1016/j.ando.2013.02.004.
[9] Voss M J,Niggemann B,Zanker K S,et al.Tumour reactions to hypoxia[J].Curr Mol Med,2010,10(4):381-386.doi:10.2174/156652410791317020.
[10] Zhang Y,Liu Q,Wang F,et al.Melatonin antagonizes hypoxia-mediated glioblastoma cell migration and invasion via inhibition of HIF-1alpha[J].J Pineal Res,2013,55(2):121-130.doi:10.1111/jpi.12052.
[11] Wang L,Wu B,Zhang Y,et al.Hypoxia promotes the proliferation of MC3T3-E1 cells via the hypoxia-inducible factor-1alpha signaling pathway[J].Mol Med Rep,2015,12(4):5267-5273.doi:10.3892/mmr.2015.4034.
[12] Wang X,Li J,Wu D,et al.Hypoxia promotes apoptosis of neuronal cells through hypoxia-inducible factor-1alpha-microRNA-204-B-cell lymphoma-2 pathway[J].Exp l Biol Med,2016,241(2):177-183.doi:10.1177/1535370215600548.
[13] Luo D,Wang Z,Wu J,et al.The role of hypoxia inducible factor-1 in hepatocellular carcinoma[J].Bio Med Res Int,2014,4(1):427-431.doi:10.1155/2014/409272.
[14] Yao DF,Jiang H,Yao M,et al.Quantitative analysis of hepatic hypoxia-inducible factor-1alpha and its abnormal gene expression during the formation of hepatocellular carcinoma[J].HBPD Int,2009,8(4):407-413.
[15] Meng FD,Wei JC,Qu K,et al.FoxM1 overexpression promotes epithelial-mesenchymal transition and metastasis of hepatocellular carcinoma[J].World J gastroenterol,2015,21(1):196-213.doi:10.3748/wjg.v21.i1.196.
[16] Mima K,Hayashi H,Imai K,et al.High CD44s expression is associated with the EMT expression profile and intrahepatic dissemination of hepatocellular carcinoma after local ablation therapy[J].J Hepato Bil Pan Sci,2013,20(4):429-434.doi:10.1007/s00534-012-0580-0.
[17] Yoshida GJ.Emerging role of epithelial-mesenchymal transition in hepatic cancer[J].J Exp Clin Cancers Res,2016,35(1):141.doi:10.1186/s13046-016-0419-7.
[18] Davis FM,Stewart TA,Thompson EW,et al.Targeting EMT in cancer:opportunities for pharmacological intervention[J].Trends Pharmacol Sci,2014,35(9):479-488.doi:10.1016/j.tips.2014.06.006.
[19] Jiang J,Tang YL,Liang XH.EMT:a new vision of hypoxia promoting cancer progression[J].Cancer Biol Ther,2011,11(8):714-723.doi:10.4161/cbt.11.8.15274.
[20] Du J,Sun B,Zhao X,et al.Hypoxia promotes vasculogenic mimicry formation by inducing epithelial-mesenchymal transition in ovarian carcinoma[J].Gynecol Oncol,2014,133(3):575-583.doi:10.1016/j.ygyno.2014.02.034.
[21] Li W,Dong Y,Zhang B,et al.PEBP4 silencing inhibits hypoxia-induced epithelial-to-mesenchymal transition in prostate cancer cells[J].Biomed pharmacother,2016,81:1-6.doi:10.1016/j.biopha.2016.03.030.
[22] Khan MA,Chen HC,Zhang D,et al.Twist:a molecular target in cancer therapeutics[J].Tumor Biol,2013,34(5):2497-2506.doi:10.1007/s13277-013-1002-x.
[23] Wushou A,Hou J,Zhao YJ,et al.Twist-1 up-regulation in carcinoma correlates to poor survival[J].Int J mol Sci,2014,15(12):21621-21630.doi:10.3390/ijms151221621.
[24] Grzegrzolka J,Biala M,Wojtyra P,et al.Expression of EMT markers SLUG and TWIST in breast cancer[J].Anticancer Res,2015,35(7):3961-3968.
[25] Gajula RP,Chettiar ST,Williams RD,et al.The twist box domain is required for Twist1-induced prostate cancer metastasis [J].Mol Cancer Res,2013,11(11):1387-1400.doi:10.1158/1541-7786.MCR-13-0218-T
[26] Liu AN,Zhu ZH,Chang SJ,et al.Twist expression associated with the epithelial-mesenchymal transition in gastric cancer [J].Mol Cell Biochem,2012,367(1-2):195-203.doi:10.1007/s11010-012-1333-8
[27] Matsuo N,Shiraha H,Fujikawa T,et al.Twist expression promotes migration and invasion in hepatocellular carcinoma [J].Mol Cell Biochem,2009,18,9:240.doi:10.1186/1471-2407-9-240
[28] Glackin CA.Targeting the Twist and Wnt signaling pathways in metastatic breast cancer [J].Maturitas,2014,79(1):48-51.doi:10.1016/j.maturitas.2014.06.015.
[29] Tseng JC,Chen HF,Wu KJ.A twist tale of cancer metastasis and tumor angiogenesis [J].Histol histopathol,2015,30(11):1283-1294.doi:10.14670/HH-11-638.
