乳酸钙处理对发芽大豆植酸降解和主要营养物质含量的影响
2018-06-26惠倩汝顾振新杨润强
惠倩汝,王 冕,周 婷,王 沛,顾振新,杨润强*
(南京农业大学食品科学技术学院,南京 江苏 210095)
植酸又名肌醇六磷酸,广泛存在于谷、豆类植物籽粒中,是植物磷元素的储备库[1]。植酸的化学结构中,含有6 个电负性极强的磷酸基团,具有很强的螯合能力,易与一些金属离子如Ca2+、Mg2+、Zn2+和Fe2+等形成植酸盐,与蛋白质结合形成蛋白小体,从而影响人体对矿质离子和蛋白质的吸收。因此,植酸被认为是一种抗营养因子[2]。
发芽被认为是一种低成本、有效降解植酸的技术,同时也可以增强芽苗的营养价值[3]。据El-Adawy[4]报道,发芽相较于水煮、高压蒸煮与微波蒸煮,对植酸降解最有效。乳酸钙是一种天然的有机酸钙盐,具有极高的生物利用率、可溶性及稳定性,是有效的外源钙元素补充剂,且不会影响溶液的感官[5]。同时,钙元素对植物的生长发育至关重要。目前,已有许多植物籽粒发芽过程中加入外源钙富集功能性成分的报道。Wang Xinkun等[6]报道了6 mmol/L氯化钙溶液有效提高了大豆芽菜的产量、促进了植酸的降解,同时富集了功能性成分。在豆类籽粒发芽过程中,植酸在植酸酶的作用下降解脱去磷酸基团,既降低了植酸的抗营养作用,也保持了植酸的有益作用,如抗氧化活性等[7]。有报道称,发芽绿豆中植酸的降解与其子叶中植酸酶活性的升高有密切关系[8]。同时,所形成的低级磷酸肌醇也是重要的信号物质,参与植物体内多种信号通路的传递[9],可起到抵御结肠癌、动脉硬化、神经系统疾病及冠心病等功能[10]。大豆是我国常见的粮食作物,其芽菜生产周期短,是广受国民喜爱的一种蔬菜。然而,大豆植酸含量较高,会影响矿质元素和其他营养物质的吸收。外施乳酸钙处理可降解大豆芽菜中的植酸,并富集低级磷酸肌醇[11]。但是,对于乳酸钙处理降解植酸的过程中,大豆芽菜矿物质和主要营养物质含量的变化还鲜见报道。因此,对乳酸钙处理大豆芽菜营养价值的认识并不全面。
本研究以大豆为试材,研究大豆芽菜的铁、锌元素含量、生理生化特性、蛋白质、氨基酸、可溶性糖等营养成分含量变化等,明确乳酸钙对大豆芽菜营养品质的影响,为高品质大豆芽菜生产提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆(Glycine max L.,品种:云鹤)籽粒购于江苏省农业科学院,并置于-20 ℃冰柜保藏待用。千粒质量为(161.6±0.8)g。
乳酸钙 美国Sigma-Aldrich公司;AG1-X4树脂(100~200 目) 德国Alfa Aesar公司;牛血清白蛋白上海蓝季科技发展有限公司;亮氨酸、考马斯亮蓝G-250、茚三酮 国药集团上海化学试剂有限公司。
1.2 仪器与设备
BX801发芽机 贝欣五金电器厂;755B型分光光度计上海精密科学仪器有限公司;TGL-16GR冷冻离心机、TDL-40B离心机 上海安亭科学仪器厂;PYX-DHS-BS型隔水电热恒温培养箱 上海跃进医疗器械厂;L8900AAA-400型氨基酸自动分析仪 日本日立公司;2300全自动凯氏定氮仪 瑞典福斯公司;Optima 2100 DV型电感耦合等离子体发射光谱仪 珀金埃尔默公司。
1.3 方法
1.3.1 样品处理
每种处理优选200 颗大小一致且无腐烂、霉变的大豆籽粒。种子表面用去离子水洗去浮沉与污渍,后置于体积分数1%的次氯酸钠溶液浸泡除菌消毒15 min。用去离子水漂洗至少5 次至pH值为中性,洗净的籽粒在去离子水中于30 ℃浸泡6 h。泡好的籽粒移入自动发芽机中,温度30 ℃,相对湿度85%,黑暗培养4 d。
用乳酸钙溶液在大豆籽粒发芽过程中进行喷淋处理。乳酸钙溶液每小时喷淋1 次,每次2 min。用去离子水喷淋设置为对照。每24 h更换一次培养液。大豆芽菜分别在发芽0、2 d和4 d取样,取样后进行用去离子水漂洗,确保样品表面没有喷淋液残留。样品每5 株随机分装一袋,冻干后,分别磨粉,置于-20 ℃冰柜保藏待用。
乳酸钙浓度优化:设置浓度为0.01、0.03、0.09、0.27、0.30、0.90、1.50、2.10、2.70 mmol/L。取发芽4 d大豆芽苗测定植酸含量,确定最佳降解植酸的乳酸钙浓度。
1.3.2 各指标的测定
植酸含量测定参照Hui Qianru等[11]的方法。5 株粉末样品用30 mL 100 g/L的Na2SO4(溶剂为体积分数1.2%的HCl溶液)30 ℃提取2 h。9 000×g离心20 min后取上清液过阴离子交换树脂,取5 mL滤液加4 mL显色液(由质量分数0.03%的FeCl3溶液及0.3%的磺基水杨酸配制),静置10 min,在波长500 nm处测定吸光度。实验结果以sprout计。
总钙含量:采用电感耦合等离子体发射光谱测定,参照Hui Qianru等[12]的方法测定。样品与优级纯硝酸按1∶25(g/mL)混合,进行微波消解。消解后稀释至有效浓度用电感耦合等离子体发射光谱测定。实验结果以sprout计。
总锌、铁含量:参照总钙含量测定方法。实验结果以sprout计。总铁、锌含量与植酸含量的关系以其物质的量比表示,参照Karkle等[13]的方法计算。
可溶性糖含量:采用硫酸苯酚法测定[14]。总蛋白质含量:采用凯氏定氮法测定[14]。可溶性蛋白质含量:采用考马斯亮蓝G-250法测定[14]。游离氨基酸含量:采用茚三酮溶液显色法测定[14]。氨基酸组成分析:采用氨基酸自动分析仪测定氨基酸含量[15]。以上实验结果以sprout计。
1.4 数据统计与分析
实验设3 次生物学重复,数据以 ±s表示。采用SAS 9.2软件Duncan’s多重比较法进行显著性分析,显著性水平为P值小于0.05。
2 结果与分析
2.1 乳酸钙浓度筛选
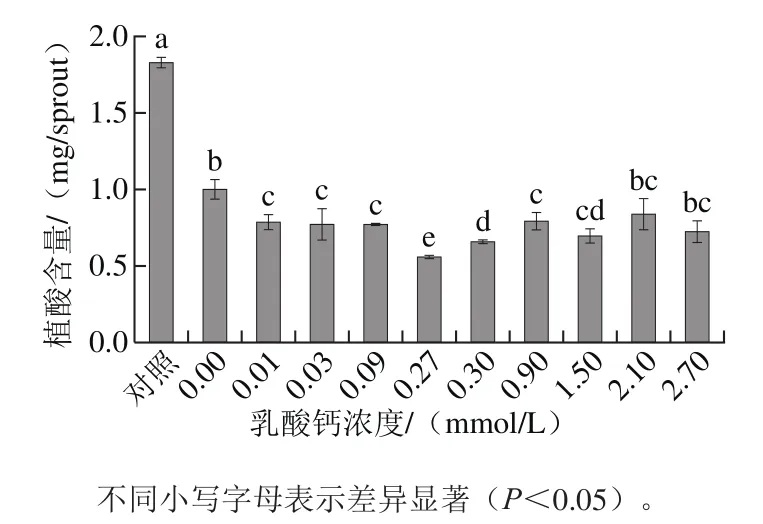
图1 不同浓度乳酸钙对发芽4 d大豆芽菜植酸含量的影响Fig.1 Effects of different calcium lactate concentrations on phytic acid content of 4 day-old soybean sprouts
如图1所示,设发芽0 d大豆为对照,外源乳酸钙对发芽4 d大豆芽菜的植酸具有显著的降解作用。其中0.27 mmol/L的乳酸钙溶液处理条件下植酸含量最低,比去离子水喷淋低44.22%,比未发芽的大豆低69.77%。表明发芽和乳酸钙喷淋对植酸的降解具有显著的叠加效果。因此,选0.27 mmol/L的乳酸钙溶液用于大豆发芽期间喷淋处理。
2.2 总钙含量测定结果
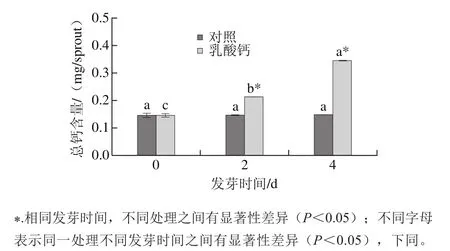
图2 乳酸钙处理条件下大豆芽菜总钙含量的变化Fig.2 Changes in total calcium content with calcium lactate treatment
随着发芽时间的延长,外源钙在大豆芽菜中不断积累,总钙含量也因此不断升高。由图2可知,乳酸钙处理条件下,大豆芽菜在发芽4 d时的总钙含量是0 d的1.36 倍,而对照组随着发芽时间的延长,总钙含量并无显著性变化。表明大豆籽粒在发芽过程中,可以吸收外源乳酸钙,且总钙含量随着发芽时间延长不断增加。
2.3 总锌、铁含量及植酸与其物质的量比值测定结果
植酸易与金属离子锌铁螯合形成植酸盐的形式积累。由图3可知,相同发芽时间条件下,乳酸钙处理的芽菜总锌、总铁含量并无显著变化。但是,随发芽时间的延长,植酸-锌和植酸-铁物质的量比值显著降低。在发芽第4天时,植酸-锌和植酸-铁物质的量比值较对照分别降低58.20%和58.75%,而发芽第2天时,乳酸钙处理与对照无显著差异。
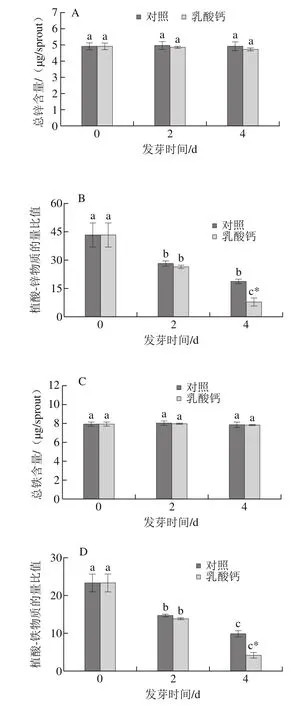
图3 乳酸钙处理条件下大豆芽菜总锌含量(A)、植酸-锌物质的量比值(B)、总铁含量(C)及植酸-铁物质的量比值(D)的变化Fig.3 Changes in total zinc content (A), molar ratio of PA to Zn (B),total iron content (C) and molar ratio of PA to Fe (D) with calcium lactate treatment
2.4 可溶性糖含量测定结果
由图4可知,随着发芽时间的延长,可溶性糖含量显著下降。其中,在乳酸钙处理条件下,可溶性糖含量显著低于对照。在发芽4 d时,乳酸钙处理的大豆芽菜可溶性糖比0 d低45.66%,表明乳酸钙处理条件下的大豆芽菜对可溶性糖利用更多。
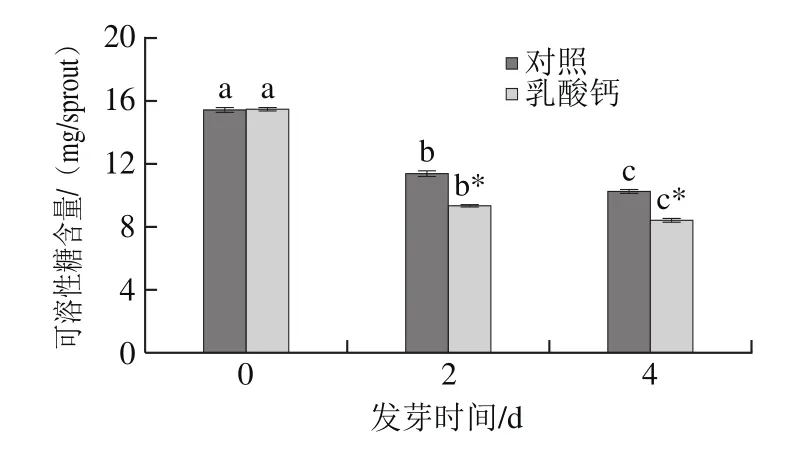
图4 乳酸钙处理条件下大豆芽菜可溶性糖含量的变化Fig.4 Changes in soluble sugar content with calcium lactate treatment
2.5 总蛋白质含量测定结果
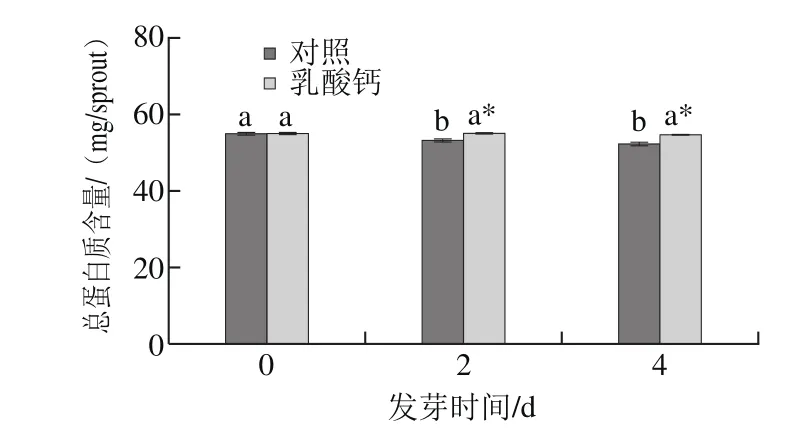
图5 乳酸钙处理条件下大豆芽菜总蛋白质含量的变化Fig.5 Changes in total protein content with calcium lactate treatment
蛋白质是大豆籽粒中最重要的营养物质,约占大豆鲜质量的40%左右。如图5所示,发芽2 d,对照组中总蛋白质含量显著下降,然而乳酸钙处理对总蛋白质含量却无显著影响。发芽至第4天,对照组的总蛋白含量与乳酸钙处理组的总蛋白含量相比显著下降。表明乳酸钙处理不仅不会造成总蛋白质的流失,而且可以保存蛋白质。
2.6 可溶性蛋白含量测定结果
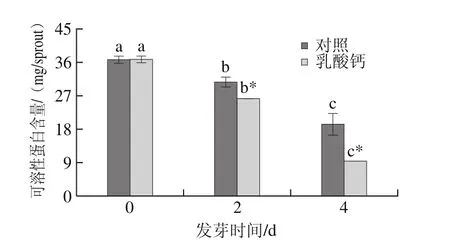
图6 乳酸钙处理条件下大豆芽菜可溶性蛋白含量的变化Fig.6 Changes in soluble protein content with calcium lactate treatment
如图6所示,发芽过程中,对照及乳酸钙处理均可显著降低可溶性蛋白的含量,但在相同发芽时间条件下,乳酸钙处理大豆芽菜的可溶性蛋白含量显著低于对照。发芽4 d,乳酸钙处理的可溶性蛋白含量比0 d降低74.56%。
2.7 游离氨基酸含量测定结果
随着发芽时间的延长,游离氨基酸含量显著增加。其中,发芽4 d时,乳酸钙处理的大豆芽菜中游离氨基酸含量比对照增加了30.35%;与0 d相比增加到5.6 倍。这可能与可溶性蛋白的水解有关。
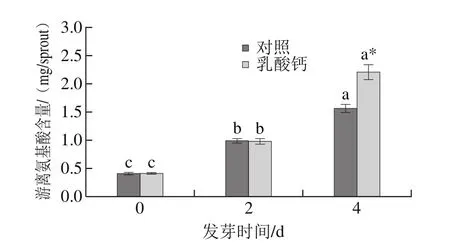
图7 乳酸钙处理条件下大豆芽菜游离氨基酸含量的变化Fig.7 Changes in free amino acids with calcium lactate treatment
2.8 氨基酸组成变化
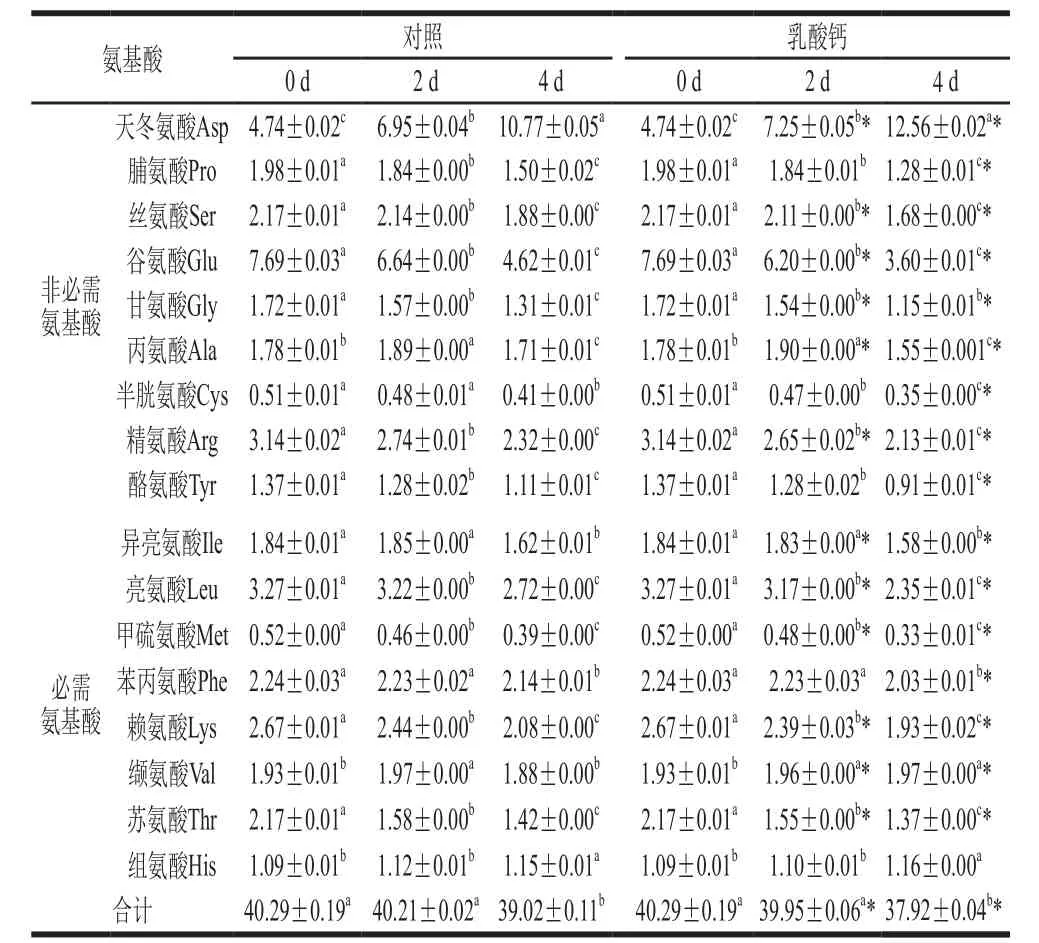
表1 乳酸钙处理条件下氨基酸组成的变化Table1 Changes in amino acid composition with calcium lactate treatment%
探究在乳酸钙处理条件下发芽4 d大豆芽菜的17 种氨基酸组成的变化,如表1所示。其中包括8 种必需氨基酸和9 种非必需氨基酸。发芽0 d 时,谷氨酸含量最高,发芽4 d后,其含量比对照和乳酸钙处理分别下降了39.92%和53.19%。但发芽4 d后,天冬氨酸成为含量最高的氨基酸,与未发芽大豆相比,对照和乳酸钙处理中天冬氨酸含量分别增加了1.27 倍和1.65 倍。在发芽过程中,乳酸钙处理与对照均只有天冬氨酸和组氨酸含量随着发芽时间的延长而增加;丙氨酸含量在发芽第2天达到最高,随后下降;其余氨基酸含量都呈下降趋势。但缬氨酸含量在对照中先升高后下降,而在乳酸钙处理条件下一直上升,因此在4 d与对照相比增加4.79%。乳酸钙处理条件下,除了天冬氨酸、缬氨酸和组氨酸,其余氨基酸含量均在发芽4 d时显著低于对照。
3 讨 论
钙是植物的必需元素之一,对其生长发育有着重要的作用[16]。本研究在大豆籽粒发芽过程中施用0.27 mmol/L乳酸钙处理,有效地降解了植酸(图1),同时探明了几种基本营养成分含量的变化。由于乳酸钙良好的溶解性、稳定性以及生物利用率,其被认为是一种优质的钙元素补充剂。在农业生产与食品加工中,无机钙盐如氯化钙被广泛应用,但其用量大浓度高,生物利用率低,难以满足生产需要。Wang Xinkun[6]和Yin Yongqi[17]等均施用6 mmol/L的氯化钙降解植酸来提高大豆芽菜品质、缓解盐胁迫等。但0.27 mmol/L乳酸钙具有更好的植酸降解效果,能更好地提高大豆芽菜品质。其原因可能是:第一,钙元素是植物细胞的结构组成元素,钙元素的补充促进大豆生长;第二,钙参与能量三磷酸腺苷(adenosinetriphosphate,ATP)的合成,而ATP的合成需要大量的磷元素,因此促进了植酸降解[9];第三,钙是细胞内的第二信使,是植物体内多种酶类和辅酶的活化因子,可以通过影响酶的活性来调节多种生理过程[18]。同时,乳酸的作用也不容忽视。据报道,乳酸可以有效激活大麦的植酸酶活性,降低大麦中的植酸含量,从而促进其体内低级磷酸肌醇的形成[19]。因此,乳酸钙的补充适用于植物籽粒在发芽过程中植酸的降解。
在种子萌发过程中,外施乳酸钙被植物大量吸收(图2),大豆芽菜生长状态佳,而芽菜旺盛的生长状态必然和呼吸速率的增强以及子叶中营养物质大量的消耗相关。此时,植酸降解相关酶被激活[20],植酸降解及其磷代谢等也均受到Ca2+的调控,因此在乳酸钙处理条件下植酸随着发芽时间的延长而大量降解[9]。随之生成低级磷酸肌醇、无机磷、肌醇、二价金属离子以及蛋白等物质,以供给植株生长所需[21]。总铁、总锌含量在发芽过程中基本保持不变,但植酸降解释放了铁、锌元素从而降低了大豆的抗营养作用。在几种易被植酸螯合的矿质元素中,锌与植酸形成的植酸锌是最稳定的,因此锌元素的生物利用率也是受植酸影响最大的[22]。铁、锌与植酸的物质的量之比可有效反映铁、锌的吸收情况。据报道,植酸-锌物质的量比值超过10~15会抑制锌的吸收;而植酸-铁物质的量比值超过14会造成铁缺乏[23-24]。发芽0 d的大豆籽粒的锌、铁元素利用率极差,但在乳酸钙处理条件下,发芽4 d的大豆芽菜植酸-锌与植酸-铁物质的量比值均有了很大变化,锌、铁元素的吸收也达到了最佳效果,并且显著优于对照组(图3B、D)。
碳水化合物约占大豆籽粒干质量的35%左右,多为蔗糖、棉子糖、水苏糖等可溶性糖及纤维素类[25]。其中可溶性糖是大豆中非结构性碳水化合物的重要组成部分,包括绝大部分单糖和寡糖。而非结构性碳水化合物也是大豆籽粒中重要的能量来源。其含量随着发芽过程逐渐下降(图4),且与植株发育程度和生长环境有关。据报道,淀粉作为另一种重要的非结构性碳水化合物,在大豆发芽过程中含量也在不断下降[26]。蔗糖、淀粉被大量利用,提供发芽过程中所需的能量。
植酸与蛋白质也易结合形成植酸-蛋白质复合体,蛋白质结构发生改变而产生聚沉作用,导致其溶解度降低,同时被蛋白酶水解的程度也下降[27]。在大豆籽粒中,蛋白质是其中最重要的营养物质并占有较大比例。随着籽粒休眠被打破,蛋白酶被激活,籽粒中贮藏的蛋白质被水解成多肽、氨基酸及酰胺。因此,在发芽过程中可溶性蛋白含量不断下降(图6),游离氨基酸含量逐渐增加(图7),而外施乳酸钙处理组变化更为明显,可溶性蛋白消耗更多,游离氨基酸生成也更多。总蛋白含量在乳酸钙处理发芽过程中基本没有变化,因为无外源添加的情况下氮元素在植物体内仅被转化利用,并不影响总含量。
大豆中含有人体所必需的各类氨基酸,其中8 种必需氨基酸的含量与肉制品相似。因此,大豆氨基酸组成平衡,其营养价值高于其他谷豆类植物性食品[28]。氨基酸组成的变化可以从某种程度上反映出蛋白质的转化情况。本研究共检测17 种氨基酸的变化,其中有9 种非必需氨基酸以及8 种必需氨基酸。大豆籽粒在未发芽时,谷氨酸含量最高。谷氨酸是一种酸性氨基酸,广泛存在于谷豆类蛋白质中,是蛋白质代谢的重要中间产物之一。随着发芽时间的延长,谷氨酸含量逐渐下降,其中乳酸钙处理的大豆芽菜中下降更为明显(表1)。可能原因是,在大豆萌发过程中游离谷氨酸的不断释放,为谷氨酸脱羧酶(glutamate decarboxylase,GAD)提供了充足的底物。GAD是γ-氨基丁酸(γ-aminobutyric acid,GABA)生成的关键酶,伴随着发芽的进行,GABA也在芽菜体内不断积累[6]。GAD活性受到Ca2+调控,而植酸降解释放的Ca2+与外源吸收的Ca2+不断增加,也因此大大提高GAD活性[29]。据报道,发芽与施钙会促进大豆芽菜中酚类物质的积累[6]。苯丙氨酸是植物体内酚类物质包括大豆异黄酮的前体[30],在乳酸钙处理发芽过程中,苯丙氨酸含量也可能因此而不断下降。与谷氨酸、苯丙氨酸不同的是,天冬氨酸含量显著升高,而施加乳酸钙的处理组升高更为明显(表1)。天冬氨酸是一种非必需氨基酸,也是数种氨基酸合成的前体,包括必需氨基酸甲硫氨酸、苏氨酸、异亮氨酸、赖氨酸等。因此,在籽粒发芽过程中天冬氨酸要不断积累,供给大豆生长发育之用。钙的施用,提高了生化反应速率,也加速了天冬氨酸的合成。另外,天冬氨酸也具有和Ca2+结合的能力,大豆芽菜吸收了大量Ca2+后,更多的天冬氨酸生成,可以更好地在芽体内贮藏、分流多余钙源。组氨酸是另一种伴随发芽过程含量上升的氨基酸,发芽4 d,乳酸钙处理组和对照组组氨酸均显著高于未发芽大豆的含量(表1)。组氨酸是婴儿的必需氨基酸,因此富含钙的芽类食品也可作为婴儿辅食进行进一步开发。
在大豆发芽过程中施用0.27 mmol/L乳酸钙处理可以显著降解大豆籽粒体内的植酸,并且提高锌、铁元素的生物利用率,利于人体吸收。此外,基本营养物质蛋白质、碳水化合物等代谢速率也加快,总蛋白质与氨基酸总量基本保持稳定,氨基酸组成发生了较大变化,使氨基酸组成更为合理,提高了大豆的营养品质。
[1] BRINCH-PEDERSEN H, MADSEN C K, HOLME I B, et al.Increased understanding of the cereal phytase complement for better mineral bio-availability and resource management[J]. Journal of Cereal Science, 2014, 59(3)∶ 373-381. DOI∶10.1016/j.jcs.2013.10.003.
[2] SANZ-PENELLA J M, LAPARRA J M, SANZ Y, et al. Bread supplemented with amaranth (Amaranthus cruentus)∶ effect of phytates on in vitro iron absorption[J]. Plant Foods for Human Nutrition, 2012,67(1)∶ 50-56. DOI∶10.1007/s11130-011-0269-6.
[3] AGUILERA Y, DÍAZ M F, JIMÉNEZ T, et al. Changes in nonnutritional factors and antioxidant activity during germination of nonconventional legumes[J]. Journal of Agricultural and Food Chemistry, 2013, 61(34)∶ 8120-8125. DOI∶10.1021/jf4022652.
[4] EL-ADAWY T A. Nutritional composition and antinutritional factors of chickpeas (Cicer arietinum L.) undergoing different cooking methods and germination[J]. Plant Foods for Human Nutrition, 2002,57(1)∶ 83-97. DOI∶10.1023/A∶1013189620528.
[5] PATHOMRUNGSIYOUNGGUL P, GRANDISON A S, LEWIS M J. Effect of calcium carbonate, calcium citrate, tricalcium phosphate,calcium gluconate and calcium lactate on some physicochemical properties of soymilk[J]. International Journal of Food Science &Technology, 2010, 45(11)∶ 2234-2240. DOI∶10.1111/j.1365-2621.2010.02399.x.
[6] WANG X K, YANG R Q, JIN X L, et al. Effect of supplemental Ca2+on yield and quality characteristics of soybean sprouts[J]. Scientia Horticulturae, 2016, 198∶ 352-362. DOI∶10.1016/j.scienta.2015.11.022.
[7] 江洪, 马续红, 吴谋成. 磷酸肌醇酯的生理活性及其研究进展[J]. 食品科技, 2007, 32(8)∶ 265-268. DOI∶10.3969/j.issn.1005-9989.2007.08.074.
[8] MANDAL N C, BISWAS B B. Metabolism of inositol phosphates 1.Phytase synthesis during germination in cotyledons of mung beans,Phaseolus aureus[J]. Plant Physiology, 1970, 45(1)∶ 4-7. DOI∶10.1104/pp.45.1.4.
[9] 靳晓琳, 王新坤, 杨润强, 等. 高等植物体中植酸合成、代谢及其生理作用[J]. 植物生理学报, 2014, 50(6)∶ 711-716. DOI∶10.13592/j.cnki.ppj.2014.0048.
[10] REALE A, MANNINA L, TREMONTE P, et al. Phytate degradation by lactic acid bacteria and yeasts during the wholemeal dough fermentation∶ a31P NMR study[J]. Journal of Agricultural and Food Chemistry, 2004, 52(20)∶ 6300-6305. DOI∶10.1021/jf049551p.
[11] HUI Q R, YANG R Q, SHEN C, et al. Mechanism of calcium lactate facilitating phytic acid degradation in soybean during germination[J].Journal of Agricultural and Food Chemistry, 2016, 64(27)∶ 5564-5573.DOI∶10.1021/acs.jafc.6b01598.
[12] HUI Q R, WANG M, WANG P, et al. Gibberellic acid promoting phytic acid degradation in germinating soybean under calcium lactatetreatment[J]. Journal of the Science of Food and Agriculture, 2017,98(2)∶ 644-651. DOI∶10.1002/jsfa.8509.
[13] KARKLE E N L, BELEIA A. Effect of soaking and cooking on phytate concentration, minerals, and texture of food-type soybeans[J].Food Science and Technology (Campinas), 2010, 30(4)∶ 1056-1060.DOI∶10.1590/S0101-20612010000400034.
[14] 李合生. 植物生理生化实验原理和技术[M]. 北京∶ 高等教育出版社,2000∶ 61-201.
[15] LISIEWSKA Z, SŁUPSKI J, SKOCZEŃ-SŁUPSKA R, et al.Content of amino acids and the quality of protein in brussels sprouts, both raw and prepared for consumption[J]. International Journal of Refrigeration, 2009, 32(2)∶ 272-278. DOI∶10.1016/j.ijrefrig.2008.05.011.
[16] BATISTIČ O, KUDLA J. Analysis of calcium signaling pathways in plants[J]. Biochimica et Biophysica Acta, 2012, 1820(8)∶ 1283-1293.DOI∶10.1016/j.bbagen.2011.10.012.
[17] YIN Y Q, YANG R Q, HAN Y B, et al. Comparative proteomic and physiological analyses reveal the protective effect of exogenous calcium on the germinating soybean response to salt stress[J]. Journal of Proteomics, 2015, 113∶ 110-126. DOI∶10.1016/j.jprot.2014.09.023.
[18] METZLER-ZEBELI B U, DECKARDT K, SCHOLLENBERGER M,et al. Lactic acid and thermal treatments trigger the hydrolysis of myoinositol hexakisphosphate and modify the abundance of lower myoinositol phosphates in barley (Hordeum vulgare L.)[J]. PLoS ONE,2014, 9(6)∶ e101166. DOI∶10.1371/journal.pone.0101166.
[19] BERRIDGE M J. Inositol trisphosphate and calcium signalling[J].Nature, 1993, 361∶ 927-933.
[20] GIBBINS L, NORRIS F. Phytase and acid phosphatase in the dwarf bean, Phaseolus vulgaris[J]. Biochemical Journal, 1963, 86(1)∶ 67-71.
[21] 罗羽洧, 解卫华, 马娟, 等. 不同发芽条件对蚕豆植酸酶活性的影响[J]. 中国粮油学报, 2012, 27(10)∶ 32-36. DOI∶10.3969/j.issn.1003-0174.2012.10.007.
[22] WEAVER C M, KANNAN S. Food phytates[M]. Boca Raton∶ CRC Press, 2002∶ 211-223.
[23] LESTIENNE I, MOUQUET-RIVIER C, ICARD-VERNIÈRE C, et al. The effects of soaking of whole, dehulled and ground millet and soybean seeds on phytate degradation and Phy/Fe and Phy/Zn molar ratios[J]. International Journal of Food Science & Technology, 2005,40(4)∶ 391-399. DOI∶10.1111/j.1365-2621.2004.00941.x.
[24] ADEYEYE E, AROGUNDADE L, AKINTAYO E, et al. Calcium, zinc and phytate interrelationships in some foods of major consumption in Nigeria[J]. Food Chemistry, 2000, 71(4)∶ 435-441. DOI∶10.1016/S0308-8146(00)00159-X.
[25] MEDIC J, ATKINSON C, HURBURGH J R C R. Current knowledge in soybean composition[J]. Journal of the American Oil Chemists’Society, 2014, 91(3)∶ 363-384. DOI∶10.1007/s11746-013-2407-9.
[26] SALDIVAR X, WANG Y J, CHEN P, et al. Changes in chemical composition during soybean seed development[J]. Food Chemistry,2011, 124(4)∶ 1369-1375. DOI∶10.1016/j.foodchem.2010.07.091.
[27] 王新坤, 仲磊, 杨润强, 等. 植物籽粒中植酸及其降解方法与产物研究进展[J]. 食品科学, 2014, 35(3)∶ 301-306. DOI∶10.7506/spkx1002-6630-201403059.
[28] 韩立德, 盖钧镒, 张文明. 大豆营养成分研究现状[J]. 种子, 2003(5)∶58-60. DOI∶10.3969/j.issn.1001-4705.2003.05.023.
[29] 尹永祺. NaCl及其联合Ca2+处理下发芽大豆生理变化与GABA富集调控机理[D]. 南京∶ 南京农业大学, 2014.
[30] BALASUNDRAM N, SUNDRAM K, SAMMAN S. Phenolic compounds in plants and agri-industrial by-products∶ antioxidant activity, occurrence, and potential uses[J]. Food Chemistry, 2006,99(1)∶ 191-203. DOI∶10.1016/j.foodchem.2005.07.042.
