利用功能基因PCR芯片探讨过表达Slit2基因与老年小鼠淀粉样蛋白产生沉积的关系
2018-06-26李舸李航刘书华李韵峰关雅伦李雪娇黄韧张钰
李舸,李航,刘书华,李韵峰,关雅伦,李雪娇,黄韧,张钰
(广东省实验动物重点实验室 广东省实验动物监测所,广州 510663)
阿尔茨海默症(Alzheimer’s disease, AD)是常见的中枢神经退行性疾病,主要临床表现为认知和记忆功能不断恶化、日常生活能力进行性减退,并伴有各种精神症状和行为障碍[1-2],已成为严重威胁老年人健康的主要疾病之一。目前,对于AD发病机制,普遍的观点认为β淀粉样蛋白(amyloid-β,Aβ)过度聚集形成老年斑和tau蛋白过度磷酸化聚集形成神经纤维缠结是引起AD的主要原因[3]。因此,在过去的几十年中,根据AD病人Aβ和tau突变编码序列特征,利用基因工程技术,构建了大量针对上述两种基因突变所致的小鼠AD动物模型,并广泛应用于AD发病机制研究和治疗药物筛选评价[4],近年来,随着研究的深入,细胞衰老[5]、炎症[6]、血管损伤[7]等因素也被认为在Aβ产生和清除中起到了关键作用,因此,针对这些因素构建新的AD动物模型,对于阐明AD致病机理和新药研发具有重要意义。
早期研究发现,分泌型糖蛋白Slit2在发育的中枢神经系统中广泛表达,其通过与下游的4个Robo受体结合指导神经轴突排列[8],此外,Slit2在细胞迁移,肿瘤血管形成和炎症发生也发挥了重要的功能[9]。近年来的报道指出,Slit2在中枢神经系统生理和病理过程中扮演了重要的角色,生理条件下,Slit2具有较强地抑制神经炎症的功能[10],但在病理条件下,过表达Slit2可能通过破坏血管结构引起血脑屏障通透增强[11-12]。前期的研究显示,过表达Slit2基因小鼠显示AD样的行为认知异常,但Tg-Slit2小鼠的异常表型是否与Aβ的产生有关还不清楚。
因此,在本研究中,我们对比研究了老年Tg-Slit2小鼠和AD小鼠Tg-2576在Aβ沉积中的差异,并利用功能基因PCR芯片技术,针对上述两种小鼠脑组织中AD相关基因表达进行检测分析和对比研究,初步探讨Slit2基因与AD疾病的相关性。
1 材料与方法
1.1 材料
1.1.1实验动物
6周龄SPF级雄性Tg-Slit2小鼠(C57BL/6背景)和Tg-2576小鼠(C57BL/6背景)各10只(体重18~20 g)由广东药科大学王丽京教授惠赠,6周龄SPF级雄性C57BL/6小鼠(体重18~20 g)购自广东省医学实验动物中心【SCXK(粤)2013-0002】。所有小鼠饲养至14月龄,饲养期间动物自由采食饮水,12 h循环灯光,恒定湿度,室温(23±2)℃。动物饲养和实验在广东省实验动物监测所设施内进行【SYXK(粤)2016-0122】。本研究所涉及的动物实验获得广东省实验动物监测所(AAALAC认证机构)动物实验动物使用与管理委员会(IACUC)批准(IACUC编号2014027)。
1.1.2仪器与试剂
Purified anti-β-Amyloid,1-40 Antibody(SIG-39140,Biolegend,美国),Purified anti-β-Amyloid,1-42(SIG-39142,Biolegend,美国),Antibody SP Mouse HRP Kit(康为世纪,中国),Trizol试剂(Invitrogen,美国),氯仿、异丙醇、无水乙醇、二甲苯(上海化学试剂有限公司,中国),DEPC水(生工生物工程有限公司,中国),AmbionTMDNase I(RNase-free)试剂盒(Thermo Fisher Scientific,美国),AmbionTMRNase Inhibitor(Thermo Fisher Scientific,美国),RNeasy® MinEluteTM纯化试剂盒(Qiagen,德国),溴化乙锭(华美生物工程公司,中国),琼脂糖(生工生物工程有限公司,中国),SuperScript. III Reverse Transcriptase(Invitrogen,美国),2X SuperArray PCR master mix (Qiagen,德国), Mouse Alzheimer’s Disease RT2ProfilerTMPCR Array(Qiagen,德国)。
冷冻离心机(Thermo Fisher Scientific,美国),恒温水浴锅(上海皓庄仪器有限公司,中国),凝胶电泳系统(Bio-Rad,美国),凝胶成像仪(Bio-Rad,美国),Nanodrop紫外分光光度计(Thermo Fisher Scientific,美国),ABI-7500型实时荧光定量PCR系统(Applied Biosystems,美国)。
1.2 方法
1.2.1小鼠脑组织样品Aβ1-40和Aβ1-42免疫组化染色
14月龄的雄性Tg-Slit2、Tg2576和C57BL/6小鼠颈椎脱臼安乐死后,取右半脑4%多聚甲醛固定过夜,组织经梯度酒精脱水、二甲苯透明、浸蜡后,包埋成石蜡组织块。组织块修块后4 μm切片,经45℃温水展片后,贴于明胶玻片上放入烘箱中烘烤过夜用于后期染色。
组织切片经过二甲苯脱蜡、梯度酒精复水、抗原修复后,按照SP Mouse HRP Kit试剂盒说明书,滴加山羊血清封闭,加入1∶200稀释的purified anti-β-amyloid1-40 antibody孵育过夜,经PBS充分漂洗后,滴加生物素标记的羊抗鼠二抗工作液室温孵育30 min,经PBS漂洗后,加入HRP标记的链霉亲和素室温孵育30 min,经PBS再次漂洗后,加入DAB显色工作液,并在显微镜下观察显色。显色完成后,将组织切片放入自来水中终止显色,之后组织切片经苏木素复染、脱水透明,封片后在显微镜下进行镜检。
1.2.2小鼠脑组织样品总RNA提取及纯化
14月龄的雄性Tg-Slit2、Tg2576和C57BL/6小鼠颈椎脱臼安乐死后,取左半脑加入2 mL的Trizol试剂并充分匀浆,加入0.4 mL氯仿震荡混匀后,离心吸取水相加入0.5 mL异丙醇混匀后再次离心后,弃上清加入75%乙醇清洗RNA沉淀,干燥后加入适量DEPC水溶解RNA。
取适量RNA,按照AmbionTMDNase I (RNase-free) 试剂盒操作说明,去除样品中的基因组DNA,并按照RNeasy® MinEluteTM纯化试剂盒操作说明,对RNA样品进行进一步的过柱纯化。
1.2.3脑组织总RNA样品质量检测
利用Nanodrop紫外分光光度计测量RNA浓度,并获得OD260和OD280值初步确定样品的纯度。将少量RNA样品在70℃热变性后,经过变性琼脂糖凝胶电泳,在紫外透射光下,观察28S和18S核糖体RNA的条带情况进一步分析样品的纯度。
1.2.4cDNA合成
按照SuperScript. III Reverse Transcriptase试剂盒操作说明,将适量的总RNA,oligo(dT)和dNTPs按比例充分混合,65℃水浴后,加入反转录酶混合混匀在50℃温育后,于70℃温育灭活反转录酶,之后将cDNA置于-20℃保存。
1.2.5功能基因PCR芯片分析
按照SuperArray PCR master mix 使用说明,将稀释的cDNA与PCR预混液按比例混合,打开RT2ProfilerTMPCR Array Mouse Alzheimer’s Disease(表1)上的覆盖膜,加20 μL混合液到PCR Array对应的每个孔中,按照以下步骤设置实时定量PCR程序:1)聚合酶激活/变性(95℃,10 min);2)扩增40个循环(95℃,15 s; 60℃,1 min;收集荧光);3)溶解曲线分析。
1.3 数据分析
利用2-ΔΔCt法计算基因表达相对差异,并通过SPSS 16.0软件进行统计分析。实验数据采用Student’st-test进行统计学分析。
2 结果
2.1 脑组织Aβ1-40和Aβ1-42免疫组化分析
利用免疫组化染色,我们分别对14月龄的老年雄性C57BL/6小鼠、Tg-Slit2小鼠和Tg-2576小鼠脑皮层中的Aβ1-40 h和Aβ1-42进行了免疫组织染色(图1),结果显示,C57BL/6小鼠(图1 A,Aβ1-40;图1D,Aβ1-42)和Tg-Slit2小鼠(图1B,Aβ1-40;图1E,Aβ1-42)脑皮层中未见Aβ1-40和Aβ1-42的阳性染色,而Tg-2576小鼠脑皮层中出现大量Aβ1-40(图1C)和Aβ1-42(图1F)阳性染色,并表现出典型的Aβ1-40(图1C,黑色箭头)和Aβ1-42(图1F,黑色箭头)沉积。
2.2 用于功能芯片分析的脑组织总RNA样品质量分析
利用紫外分光光度计对每个待测样品的总RNA样品的浓度和纯度进行了分析,结果显示,所有样品的RNA浓度均在300 ng/μL左右(表2),样品在260 nm和280 nm处的吸收光密度值(optical density,OD)比值表明,所有样品的比值均在1.9~2.0之间(表2),基本排除样品中可能存在的DNA和蛋白污染情况。利用变性琼脂糖凝胶电泳,对所有待测样品RNA的完整性和纯度进行了检测显示,所有样品的28S和18S核糖体RNA条带清晰完整,样品的RNA完整性较好,在28S核糖体RNA条带上方并未出现其他杂带(图2),表明RNA制备过程中未出现DNA污染。
2.3 Mouse Alzheimer’s Disease RT2 ProfilerTM PCR Array PCR芯片扩增曲线分析
样品的总RNA反转录为cDNA进行功能基因PCR芯片分析后,对每一个样品PCR后的扩增曲线进行分析,结果显示,所有样品的扩增效率较为一致,不同基因Ct值的扩增曲线表现为平行位移,扩增曲线斜率差异较小,90%以上的基因Ct值在20~30之间(图3)。功能基因PCR芯片检测结果可以用于基因差异化表达分析。
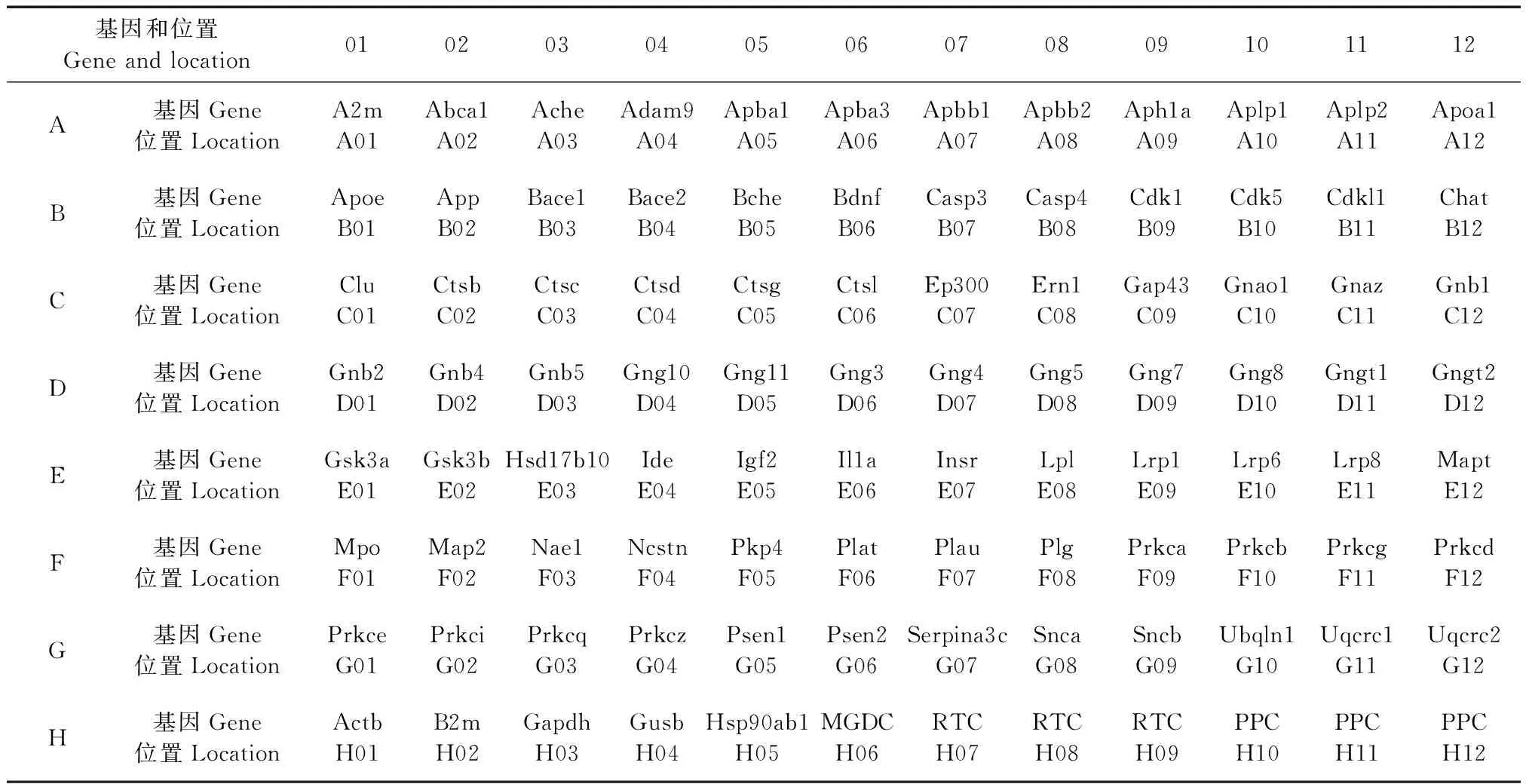
表1 Mouse Alzheimer’s Disease RT2 ProfilerTM PCR Array 芯片阵列布局Tab.1 The array layout for the Mouse Alzheimer’s Disease RT2 ProfilerTM PCR Array
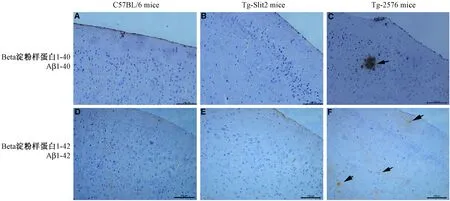
注:黑色箭头为Aβ沉积。Bar=100 μm。图1 老年小鼠脑皮层组织Beta淀粉样蛋白Aβ1-40和Aβ1-42免疫组织化学染色(×200)Note. The accumulation of Aβ is indicated by black arrow. Bar=100 μm.Fig.1 Immunohistochemical analysis for Aβ1-40 and Aβ1-42 in the brain cortex of aging mice(×200)
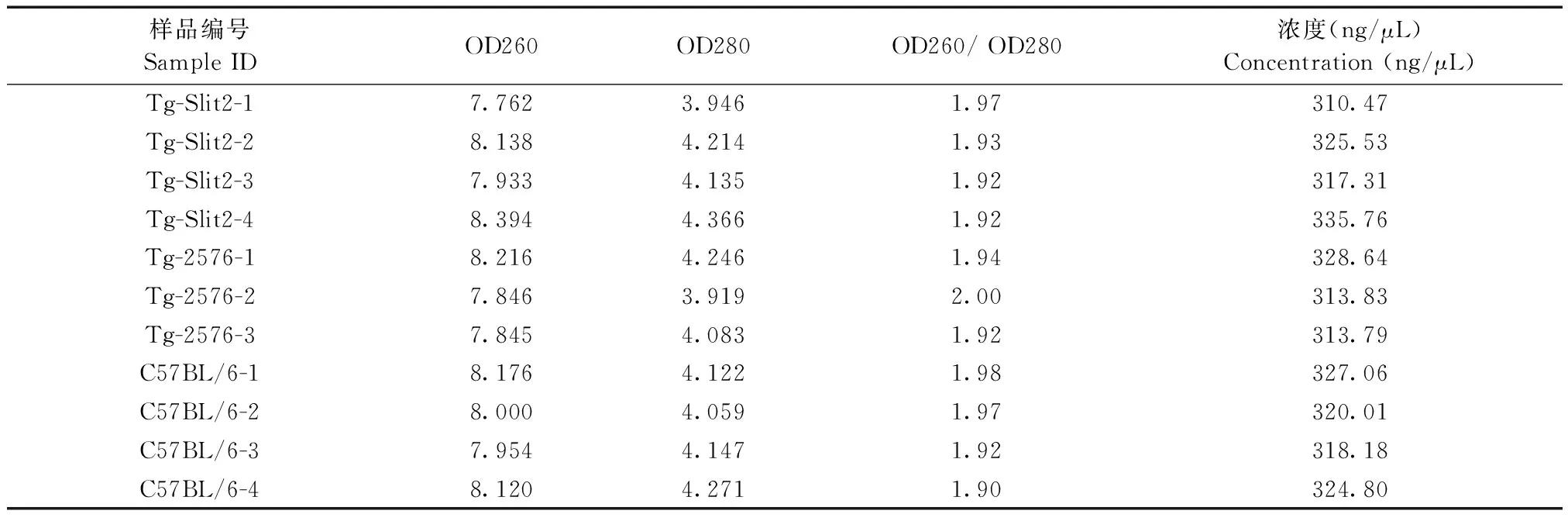
样品编号Sample IDOD260OD280OD260/ OD280浓度(ng/μL)Concentration (ng/μL)Tg-Slit2-17.7623.9461.97310.47Tg-Slit2-28.1384.2141.93325.53Tg-Slit2-37.9334.1351.92317.31Tg-Slit2-48.3944.3661.92335.76Tg-2576-18.2164.2461.94328.64Tg-2576-27.8463.9192.00313.83Tg-2576-37.8454.0831.92313.79C57BL/6-18.1764.1221.98327.06C57BL/6-28.0004.0591.97320.01C57BL/6-37.9544.1471.92318.18C57BL/6-48.1204.2711.90324.80
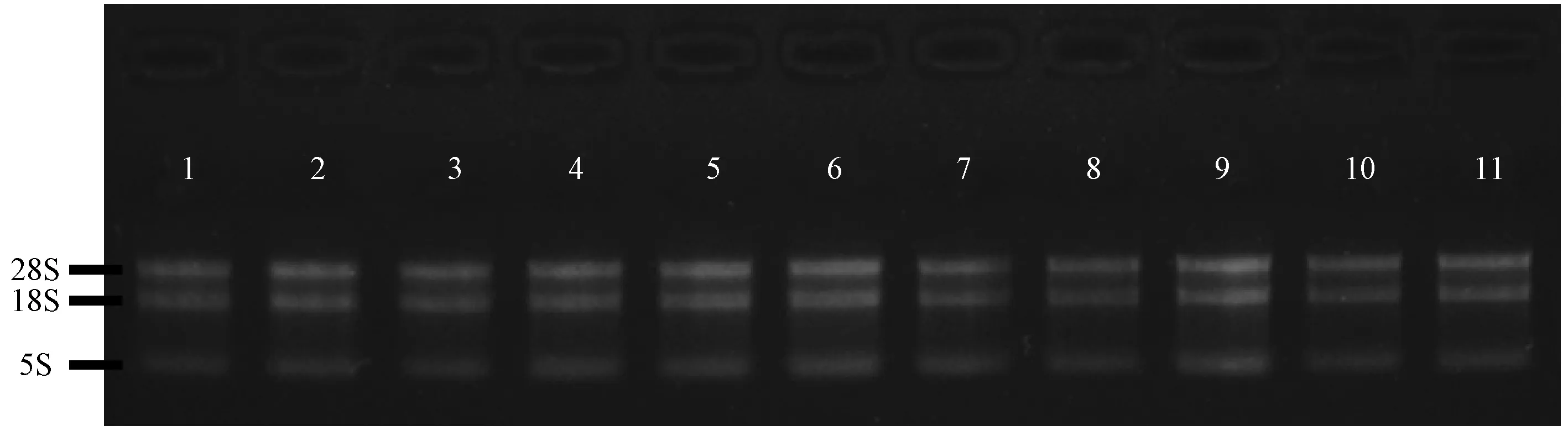
注:条带1,Tg-Slit2-1;条带2,Tg-Slit2-2;条带3,Tg-Slit2-3;条带4,Tg-Slit2-4;条带5,Tg-2576-1;条带6,Tg-2576-2;条带7,Tg-2576-3;条带8,C57BL/6-1;条带9,C57BL/6-2;条带10,C57BL/6-3;条带11,C57BL/6-4。图2 变性凝胶电泳分析脑组织总RNA样品纯度Note. Lane 1, Tg-Slit2-1. Lane 2, Tg-Slit2-2. Lane 3, Tg-Slit2-3. Lane 4, Tg-Slit2-4. Lane 5, Tg-2576-1. Lane 6, Tg-2576-2. Lane 7, Tg-2576-3. Lane 8, C57BL/6-1. Lane 9, C57BL/6-2. Lane 10, C57BL/6-3. 条带11, C57BL/6-4.Fig.2 Purity analysis for total RNA in the brain tissues by denaturing gel electrophoresis
图3 Mouse Alzheimer’s Disease RT2 ProfilerTM PCR Array的PCR芯片扩增曲线Fig.3 Amplification curves for RT2 ProfilerTM PCR Array Mouse Alzheimer’s Disease PCR array
2.4 Mouse Alzheimer’s Disease RT2 ProfilerTM PCR Array PCR芯片检测结果
利用 Mouse Alzheimer’s Disease RT2ProfilerTMPCR Array PCR芯片结合双ΔΔCt法,我们分别对14月龄的老年雄性Tg-Slit2小鼠和Tg-2576小鼠脑组织中AD相关基因与同年龄C57BL/6小鼠进行了相对表达量分析,结果表明,在总共检测的84个基因中,Tg-Slit2小鼠相对于C57BL/6小鼠有43个基因表达上调,37个基因表达下调,4个基因表达不变,而Tg-2576小鼠则有38个基因表达上调,43个基因表达下调,3个基因表达不变(图4)。进一步的统计学分析显示,Tg-Slit2上调的43个基因中有16个基因显著上调,下调的37个基因中有8个显著下调,而Tg-2576小鼠上调的38个基因中有14个基因显著上调,下调的43个基因中有17个显著下调(图5)。
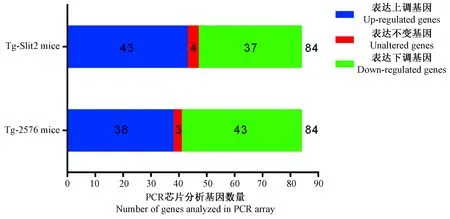
图4 Mouse Alzheimer’s Disease RT2 ProfilerTM PCR Array的PCR芯片总体结果Fig.4 The overall results for RT2 ProfilerTM PCR Array Mouse Alzheimer’s Disease PCR array
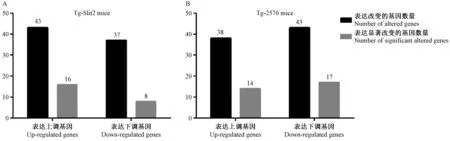
图5 RT2 ProfilerTM PCR Array Mouse Alzheimer’s Disease PCR芯片差异表达基因分析Fig.5 Analysis of differential expression genes for Mouse Alzheimer’s Disease RT2 ProfilerTM PCR Array
2.5 Aβ产生和清除相关基因表达分析
依据Mouse Alzheimer’s Disease RT2ProfilerTMPCR Array PCR功能芯片的基因分类说明,我们对老年Tg-Slit2小鼠和Tg-2576小鼠中与Aβ产生相关的基因进行筛选分析后发现,在编码组成剪切淀粉样前体蛋白APP的跨膜蛋白复合物γ-分泌酶的三个亚基的基因中,催化亚基Psen2基因在Tg-2576小鼠脑中表达相对于同年龄的C57BL/6小鼠呈现出显著上调,Aph1a和Ncstn差异无显著性,而Tg-Slit2小鼠除了起稳定γ-分泌酶的Aph1a基因表达显著上调外,其催化亚基Psen2和Ncstn与C57BL/6小鼠差异无显著性(表3)。
另一方面,我们进一步分析与Aβ清除相关的低密度脂蛋白受体相关蛋白(Lrp)基因表达后发现,Lrp6和Lrp8在老年Tg-2576小鼠脑中表达相对于C57BL/6小鼠显著下降,而Tg-Slit2小鼠与C57BL/6小鼠相比差异无显著性(表3)。
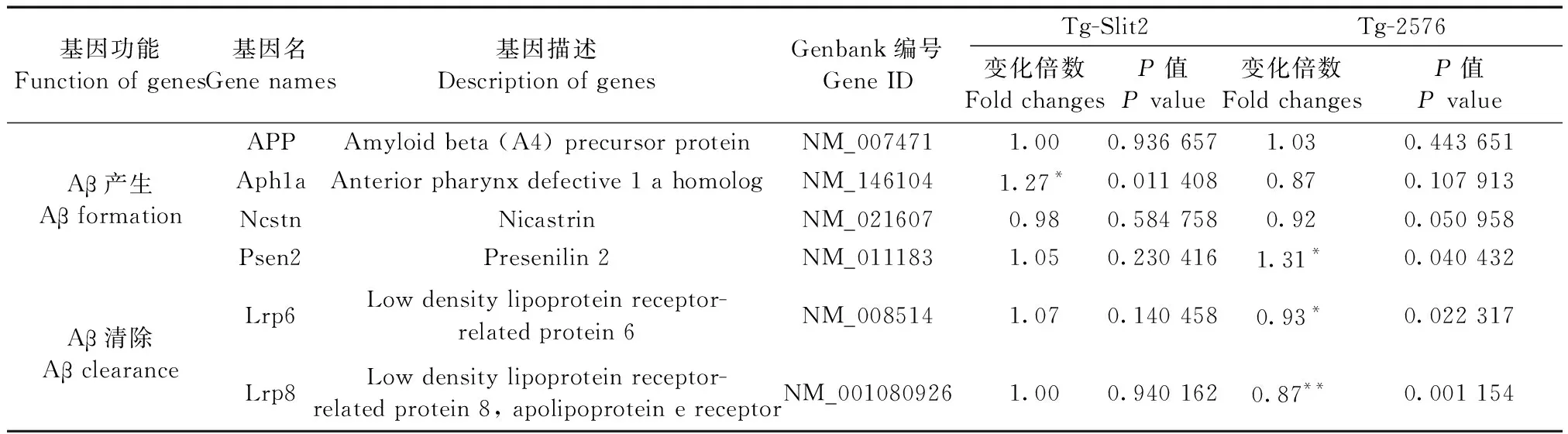
表3 Aβ产生和清除相关基因表达Tab.3 Expression of genes related to Aβ generation and clearance
注:与C57BL/6小鼠比较,*P< 0.05;**P< 0.01。
Note.*P< 0.05;**P< 0.01, compared with C57BL/6 mice.
3 讨论
在本研究中,我们利用特异性的Aβ1-40抗体对老年C57BL/6小鼠、Tg-Slit2小鼠和Tg-2576小鼠脑组织中Aβ1-40和Aβ1-42进行免疫组化染色发现,相比于Tg-2576小鼠,老年Tg-Slit2小鼠和C57BL/6小鼠脑皮层组织中并未出现明显的Aβ1-40和Aβ1-42沉积,进一步利用功能基因PCR芯片对Aβ产生和清除相关基因差异化表达分析发现,三种小鼠内源性淀粉样前体蛋白APP基因表达并无差异,而Tg-Slit2小鼠在编码组成剪切淀粉样前体蛋白APP的跨膜蛋白复合物γ-分泌酶的催化亚基基因Psen2表达较Tg-2576显著下降,而与Aβ清除相关的低密度脂蛋白受体相关蛋白Lrp6和Lrp8表达显著上调。
Aβ是淀粉样前体蛋白APP经过蛋白酶水解后的产物,Aβ的异常聚集是导致AD发生的重要原因之一。γ-分泌酶是APP水解过程中的关键限速酶[13],APP前体蛋白的γ位点经过γ-分泌酶切割后,释放APP胞内结构域,并生成由39-43个氨基酸残基组成的Aβ肽段,其中以Aβ1-40和1-42最为常见,这些肽段一旦形成,极易形成聚集和沉淀,最终引起AD病变[14]。尽管我们在免疫组化中发现,老年Tg-2576小鼠脑组织中形成典型的Aβ沉积,而Tg-Slit2小鼠和C57BL/6小鼠未出现阳性表达,但在功能芯片检测结果中,三种小鼠的Aβ前体APP的相对表达量却未出现差异。分析Aβ形成原因,我们认为Tg-2576小鼠主要通过基因修饰技术转入人“Swedish”AD家族的APP突变基因(第670个氨基酸由赖氨酸突变为天冬酰胺第671个氨基酸由甲硫氨酸突变为亮氨酸)导致Aβ的过度产生,最终导致小鼠产生一系列的AD样病变,包括老年斑的形成、突触可塑性的异常、胶质细胞激活、氧化应激增加等[15]。作为非APP过表达转基因小鼠,Tg-Slit2小鼠和C57BL/6小鼠的Aβ来源只能由内源性的鼠源APP表达产生,而根据功能芯片检测说明,我们发现芯片主要特异性地针对鼠源的APP基因序列进行检测,因此,我们认为无论是Tg-2576小鼠还是Tg-Slit2小鼠,在本研究中,这两个基因的转入并未对鼠源APP的表达产生影响,同时,该结果也与在免疫组化中未发现Tg-Slit2小鼠和C57BL/6出现Aβ沉积相一致。
作为Aβ形成的关键限速酶,γ-分泌酶是一个由四个亚基构成的跨膜蛋白复合体,包括催化活性中心presenilin(Psen),底物识别蛋白nicastrin(Ncstn),稳定蛋白Anterior pharynx defective 1 homolog(Aph1)和presenilin enhancer(PEN2)[16]。最近的研究表明,过表达Psen2能够导致Tg2576小鼠在3-4个月即出现记忆功能损伤,损伤的提前发生与Psen2催化Aβ产生过早沉积相关[17],而关于Aph1的研究发现,表达Aph1α影响APP水解后的Aβ肽段大小,但与Aβ产生的总量不相关[18]。在本研究中,我们发现在功能基因PCR芯片检测的与APP水解相关的γ-分泌酶三个亚基中,尽管Tg-Slit2小鼠出现Aph1α基因的表达显著上调,但与Aβ产生密切相关Psen2基因表达并未出现与Tg-2576小鼠相似的显著上调的表型,这一表型也与我们在Aβ免疫组化染色结果相一致。
另一方面,对于脑内Aβ的清除,低密度脂蛋白受体相关蛋白在这一过程中扮演了重要的角色,脑内的Aβ与ApoE结合后,通过脑血管内皮细胞上的LRP转运至外周血液,同时血液中游离的Aβ与可溶性的LRP结合,降低血液中的Aβ浓度,促进Aβ的外周降解[19]。研究表明,LRP的突变后导致Aβ在Tg2576小鼠脑组织中发生过早沉积,此外,Aβ沉积所产生的毒性作用将诱导加速LRP在该小鼠脑血管内皮中的降解[20]。此外,LRP6缺陷导致小鼠神经突触功能异常,进一步在转基因小鼠AD模型和临床AD病人研究发现,LRP6功能缺失与Aβ沉积产生的神经毒性密切相关[21]。对于LRP8,该基因缺陷将导致小鼠记忆功能受损,同时,过度激活的γ-分泌酶参与并促进LRP8蛋白的水解[22]。因此,在本研究中,老年Tg-Slit2小鼠并未出现Tg-2576小鼠典型的Aβ沉积可能与其LRP功能维持密切相关。
综上所述,在本研究中,我们利用功能基因PCR芯片对比研究了Tg-Slit2小鼠与Tg-2576小鼠AD相关基因表达差异,从Aβ产生和清除方面,14月龄过表达Slit2小鼠未产生Aβ的沉积,Aβ相关基因也未显示出与Tg2576小鼠相似的改变,过表达Slit2是否与AD相关关还需要进一步研究。
