EV71不同临床株的新生小鼠毒力研究
2018-06-26李怡沅陈恒苗瑞雪李伟然程悦万朝敏朱渝
李怡沅,陈恒,苗瑞雪,李伟然,程悦,万朝敏,朱渝*
(1. 四川大学华西第二医院儿科,出生缺陷与相关幼儿疾病教育部重点实验室, 成都 610041; 2. 成都市疾病预防控制中心,成都 610041; 3. 四川大学公共卫生学院,成都 610041)
手足口病好发于婴幼儿及儿童,轻症表现为手、足、口腔等皮肤黏膜的斑疹、疱疹和/或疱疹性咽峡炎,可自愈,重症可引起神经系统病变,出现无菌性脑膜炎、脑干脑炎、小脑脑炎、急性迟缓性麻痹等。手足口病主要病原为EV71和CoxA16,其中EV71可引起严重的神经并发症,甚至死亡[1]。自 1969年美国加利福尼亚州首次发现EV71病毒以来,全球范围内均有流行,且近年亚太地区的发病率有增加趋势[2];在2009年中国大流行期间,手足口病患者多达百余万例,其中死亡病例达三百多例[3]。手足口病成为我国儿童的重要疾病负担之一。
由于重症手足口病的严重不良预后,相关学者对此展开了的大量研究,但是目前关于EV71引发重症的发病机制尚未明确。我们的研究采用成都市地区不同临床结局的EV71病毒分离株,在小鼠动物模型上进一步探索其毒力情况,为重症手足口的发生机制提供新的资料。
1 材料与方法
1.1 材料
1.1.1实验动物
18~21日龄的SPF级BALB/c临产孕鼠32只,购自四川省简阳达硕科技有限公司【SYXK(川)2014-189】,每只孕鼠产乳鼠6~10只,出生体重1.2~1.8 g, 饲养于四川大学华西动物服务站【SCXK(川)2013-026】,母鼠标准饲料喂养,乳鼠每窝单笼母乳喂养。本研究通过四川大学华西第二医院伦理委员会审批(201219)。
1.1.2病毒株及培养
EV71病毒分离株由成都市疾控中心提供。临床标本采集自2011~2014年成都市疑似手足口病患儿的咽拭子,经实验室确诊为EV71感染,其临床结局分别为轻症(2014-29)、重症(2011-100)及死亡(2012-227)。标本以Vero细胞进行病毒分离,观察细胞病变并以荧光PCR确定, 2014-29 1×1010TCID50/mL,2011-100 1.78×108TCID50/mL,2012-227 5.88×109TCID50/mL。
1.1.3实验试剂与仪器
RNAprep Pure Tissue Kit RNA(DP431),Diagnostic Kit for Enterovirus 71 RNA,DU730 Nucleic Acid / Protein Analyzer(Beckman,美国),CFX96 Real-Time PCR Detection System (Bio-Rad,美国),Centrifuge 5417R (Eppendorf, 德国)。
1.2 方法
1.2.1动物接种
实验分4组,每组8只孕鼠,乳鼠1日龄时腹腔接种。1~3组为实验组,分别接种29号、100号和227号病毒液0.1 mL,4组为对照组接种生理盐水0.1 mL,感染当天记为0 d。每组的小鼠4笼用于观察临床症状,4笼用于解剖采集标本。
1.2.2临床症状
观察组的乳鼠,接种前及接种后每日记录其体重、生存情况及临床症状评分,观察周期为14 d。临床评分标准为0分:健康;1分:皮疹、毛发竖起、皱皮或/和驼背;2分:活动减少、四肢乏力;3分:肢体颤抖;4分:肢体瘫痪;5分:呼吸急促、窘迫;6分:濒死或死亡。临床症状评分采用盲法,由两位实验员独立完成。
1.2.3组织取材
用于解剖的四组乳鼠,于接种后第1、3、5、7和9天,麻醉后取其脑、肺、肝、脾、肠和肌肉组织,每只取材2份,1份 -80℃储存,检测病毒载量;1份用于苏木素尹红(HE)病理切片。每个时间点每组取材来源于3只乳鼠。
1.2.4病理切片
组织经4%的多聚甲醛浸泡,石蜡包埋,经苏木素尹红染色,光学显微镜下观察病理改变,病理读片由专业的病理医师完成。
1.2.5RNA提取及病毒载量检测
将储存的组织置于冰面上缓慢解冻,称取10~20 mg液氮研磨成匀浆,按RNA提取试剂盒步骤完成提取,核酸蛋白分析仪检测RNA浓度和纯度。逆转录实时荧光定量PCR法检测组织中病毒载量。样品判断方法:检测样品 Ct 值≤38,且曲线有明显的扩增曲线,为EV71阳性;无扩增曲线或Ct值>38,为EV71阴性。根据标准品的浓度,稀释后获取浓度标准曲线。
1.3 统计学方法
采用Excel进行数据的录入及整理,SPSS 17.0进行数据分析,GraphPad Prism 5.0进行绘图。采用非参数检验进行统计学分析,生存率比较采用log-rank test,P< 0.05认为有统计学意义,多个样本的两两比较采用Bonferoni法。
2 结果
2.1 临床症状
2.1.1体重
接种前4组体重差异无显著性(P=0.441 > 0.05)。根据体重增长曲线,接种后1~5 d,4个组体重增长趋势相近,第5天时各组体重差异无显著性(P=0.255 > 0.05);第6~8天,实验组开始出现体重增长缓慢,轻症株组(29号)最缓慢,死亡株组(227号)较重症株组(100号)快;第9天开始,轻症株组和重症株组的体重出现快速增长,而死亡株组体重增长较前放缓。分析14 d观察期内各组的平均体重,4组间体重差异有显著性(P=0.000 < 0.05),重症株组、死亡株组与对照组的体重差异无显著性(P=0.037 > 0.05/6,P=0.276 > 0.05/6);轻症株组与重症株组、死亡株组的体重差异有显著性(P=0.002 < 0.05/6,P=0.000 < 0.05/6),即轻症株组体重增长较另外3个组慢(见图1)。
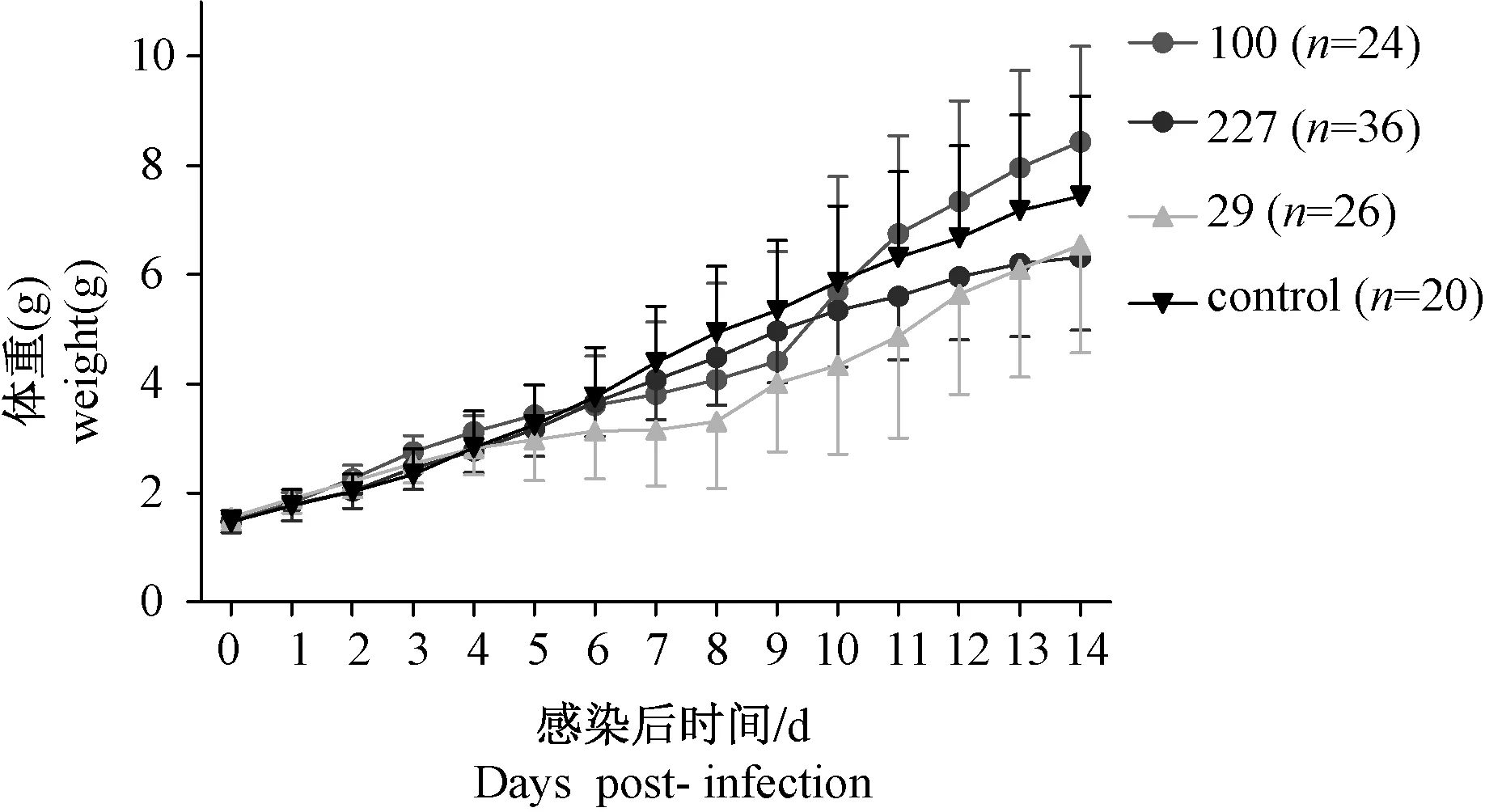
图1 平均体重增长曲线Fig.1 The curves of average weight growth
2.1.2临床症状评分
对照组评分波动在1~3分间,第10天后评分下降接近0,实验组,第2天出现症状评分的高值后下降,在第5天后3个组的症状又开始加重,在第8~10天时出现症状的高峰,后逐渐恢复。4组间临床症状评分差异有显著性(P=0.000 < 0.05),其中3个实验组与对照组的差异有显著性(P=0.000,P=0.000,P=0.000),重症株组与轻症株组差异无显著性(P=0.693),死亡株组分别与重症株组、轻症株组的差异有显著性(P=0.000,P=0.000),即重症株与轻症株接种小鼠后,症状严重程度无差异,且两组的临床症状较死亡株组的重(见图2)。
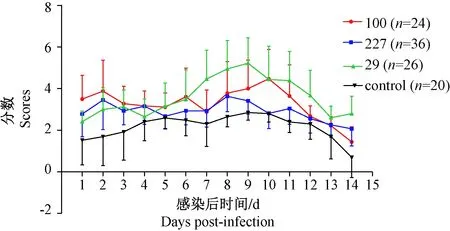
图2 临床症状评分图Fig.2 Score values of clinical performance of the mice
2.1.3生存率
死亡株组小鼠在接种后第1、2天出现死亡,其中第2天重症组亦有死亡,接种第6天后,轻症和重症株组陆续出现死亡,轻症、重症和死亡株组的生存率分别为77.2%,81.7%和97.8%。4组生存率差异有显著性(P< 0.0001),3个实验组与对照组生存率差异有显著性(P< 0.0001),重症株组与轻症株组差异有显著性(P=0.0010 < 0.05),死亡株组与重症株组、轻症株组差异有显著性(P=0.001 < 0.05,P=0.0004 < 0.05),即死亡株组生存率最高,轻症株组的生存率最低(见图3)。
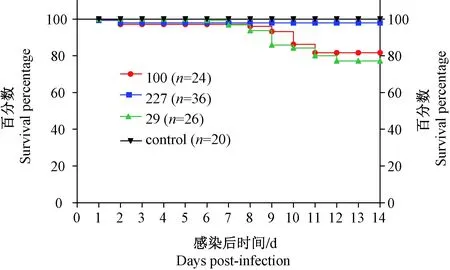
图3 生存率曲线Fig.3 Survival curves of the mice
2.2 HE病理结果
肺组织 轻症株组肺出血较重症株组和死亡株组重:轻症株组感染后肺泡腔内大量红细胞,肺泡上皮部分坏死脱落,第3天出现肺实变(图4),第5天肺内大量血浆蛋白渗出;重症株组感染后第1天肺出血最严重,肺泡腔内大量红细胞,肺泡上皮部分坏死脱落;死亡株组肺泡腔内少量-中量红细胞,肺泡上皮部分坏死脱落(图5)。
肝病变轻症株组和重症组较死亡组重,以第1天病变明显:轻症株组与重症株组肝细胞弥漫中-重度水肿,并可见多核巨细胞增生,伴中量炎细胞浸润;死亡株组肝细胞弥漫中度水肿,并可见多核巨细胞增生,伴少-中量炎细胞浸润(图7)。
脑、肌肉、脾、肠3组感染后各时间段脑组织、肌肉、脾和肠组织定性差异无显著性。脑组织出现脑神经纤维排列紊乱,以及微小液化性坏死灶后出现筛网状改变,神经元凝固凋亡,小胶质细胞增生(图6)。肌肉组织第7天表现为明显的肌肉炎症:肌纤维卷曲、部分溶解,束膜溶解破裂,细胞核排列紊乱,肌间可见较多炎细胞浸润;肠和脾的病变程度较轻,脾内见多核巨细胞,部分色素沉着;肠黏膜间见少量红细胞和炎细胞浸润(图7)。
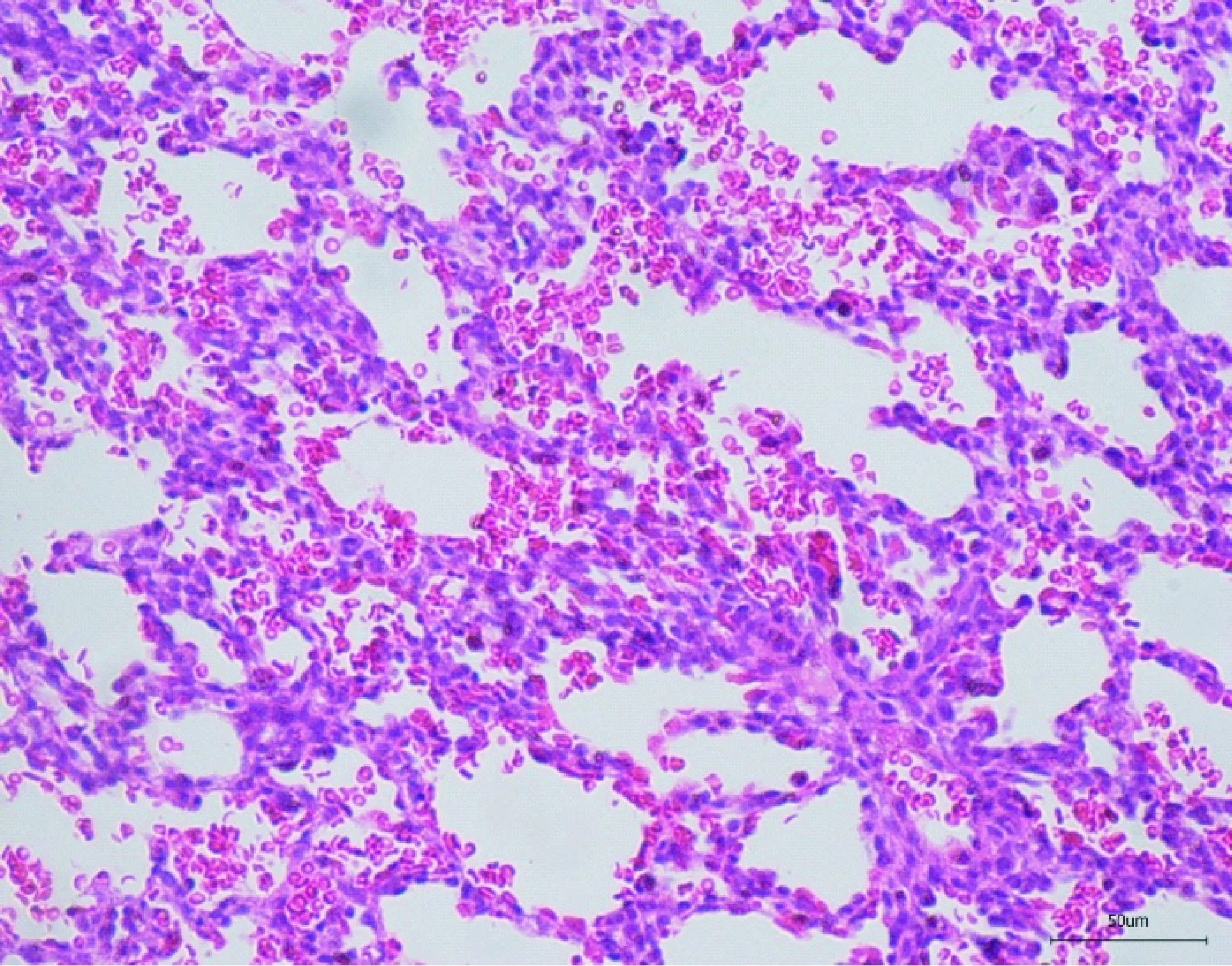
图4 轻症毒株肺上皮细胞坏死脱落及肺实变(HE染色,×200)Fig.4 Shedding of necrotic pulmonary epithelial cells and lung consolidation of mild strain (HE staining, ×200)
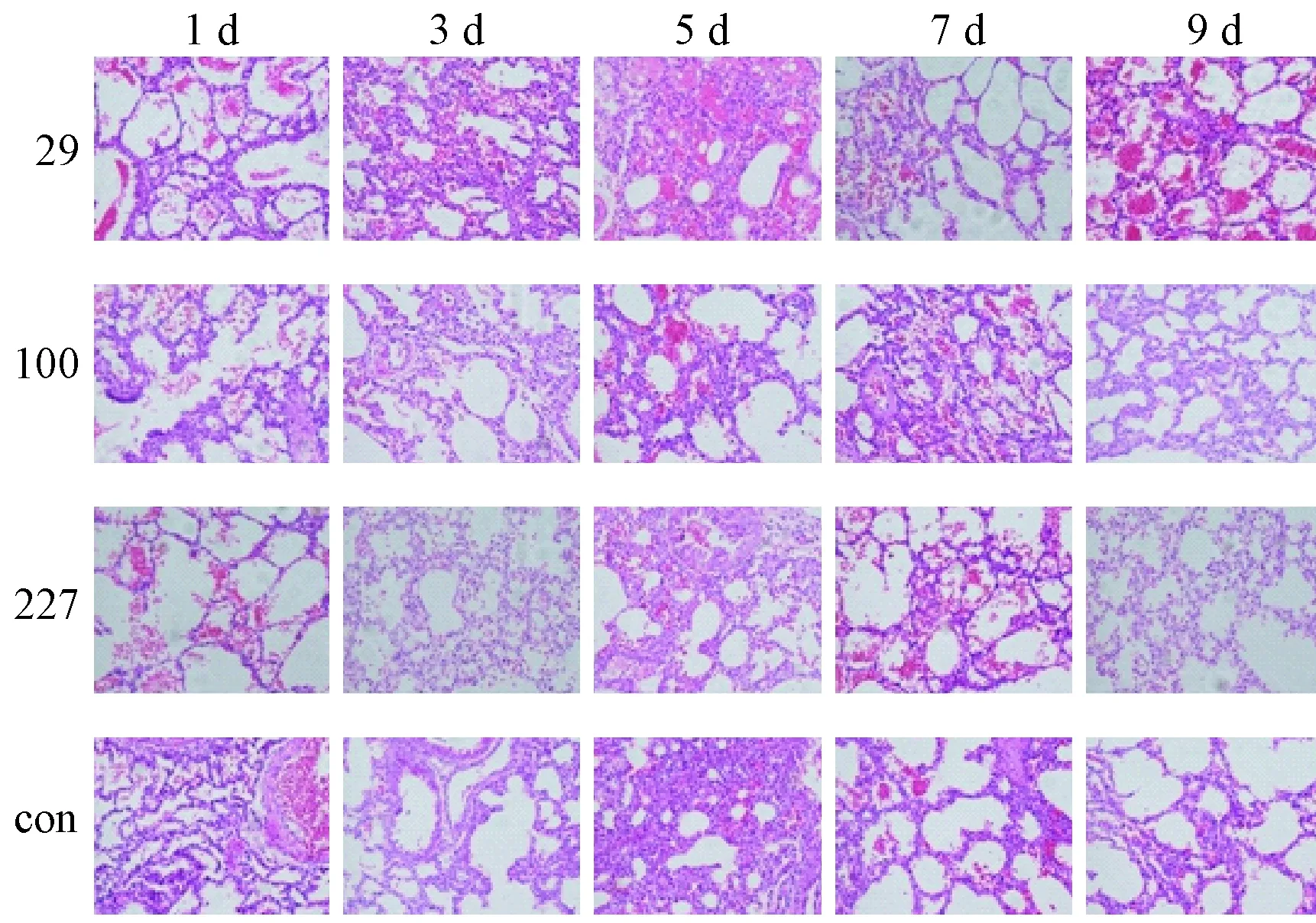
注:29:轻症毒株;100:重症毒株;227:死亡毒株;con:对照组。图5 各组不同时间肺出血情况(HE染色,×200)Note. 29: Mild strain;100:Severe strain;227:Fatal strain;Con:Control.Fig.5 Pulmonary hemorrhage at different time points in the mouse groups(HE staining, ×200)
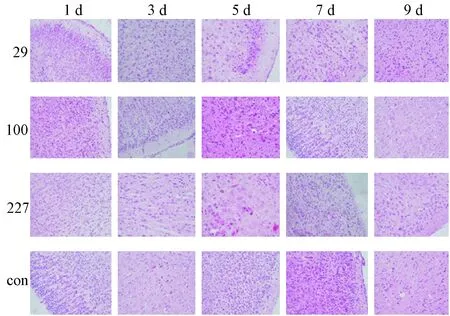
注:29:轻症毒株;100:重症毒株;227:死亡毒株;con:对照组。图6 各组不同时间脑组织病理改变(HE染色,×200)Note. 29: Mild strain.100: Severe strain.227: Fatal strain.Con: Control.Fig.6 Pathological changes of brain tissues at different time points in the mouse groups in each group (HE staining, ×200)

注:29:轻症毒株;100:重症毒株;227:死亡毒株;con:对照组。图7 组织病理改变(HE染色)Note.29: Mild strain;100: Severe strain; 227: Fatal strain; Con: Control.Fig.7 Pathological changes of different organ tissues in the mouse groups(HE staining)
2.3 组织病毒载量
各组织中以肝和肌肉中的病毒载量较其他组织高,轻症株组、重症株组和死亡株组肝组织分别在第5天(105.85copies/mL)、第3天(104.91copies/mL)和第5天(103.53copies/mL)达到其高峰,肌肉组织分别在第7天(106.49copies/mL)、第5天(106.77copies/mL)和第5天(103.98copies/mL)达到高峰;脑组织中病毒的载量在接种后较其他组织低,随着时间推移,轻症株组、重症株组和死亡株组分别在第7天(103.22copies/mL)、第5天(103.75copies/mL)和第5天(102.50copies/mL)达到高峰。死亡株组织中病毒载量在接种后第1天较高,第3天下降后第5天再次增加,第7天后下降至第9天仅肝检测出病毒;而轻症株组和重症株组组织中浓度则逐渐增加,在5~7 d达到高峰,第9天下降(图8)。
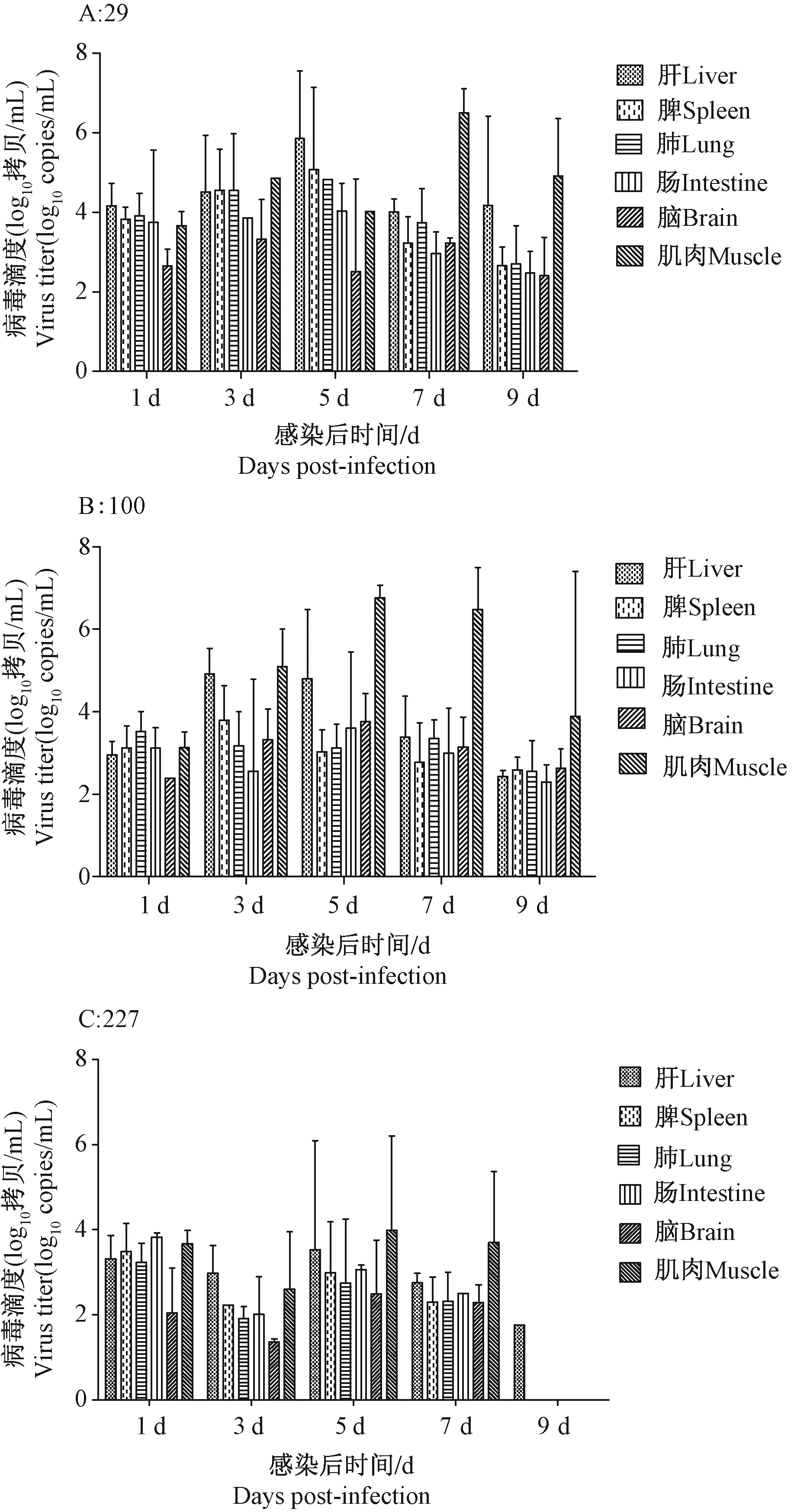
注:A:29号轻症病毒组;B:100号重症病毒组;C:227号死亡病毒组。图8 接种后不同时间组织中病毒载量Note. A: 29-mild strain; B: 100-severe strain; C: 227-fatal strain.Fig.8 Virus titer of tissues at different time points post-infection of the groups
接种后各时间段内不同组组织中的病毒载量,呈现轻症株组高于重症株组和死亡株组的趋势,死亡株组的病毒载量低,但在第5天时,轻症株组肝、脾、肺、肠中的载量最高,而重症株组脑和肌肉中的较其他两组高;第9天时,死亡株组仅肝检测出病毒,轻症株组肝和肌肉中的病毒较重症株组高,脾、肺、肠、脑中的病毒载量,两组相近(图9)。
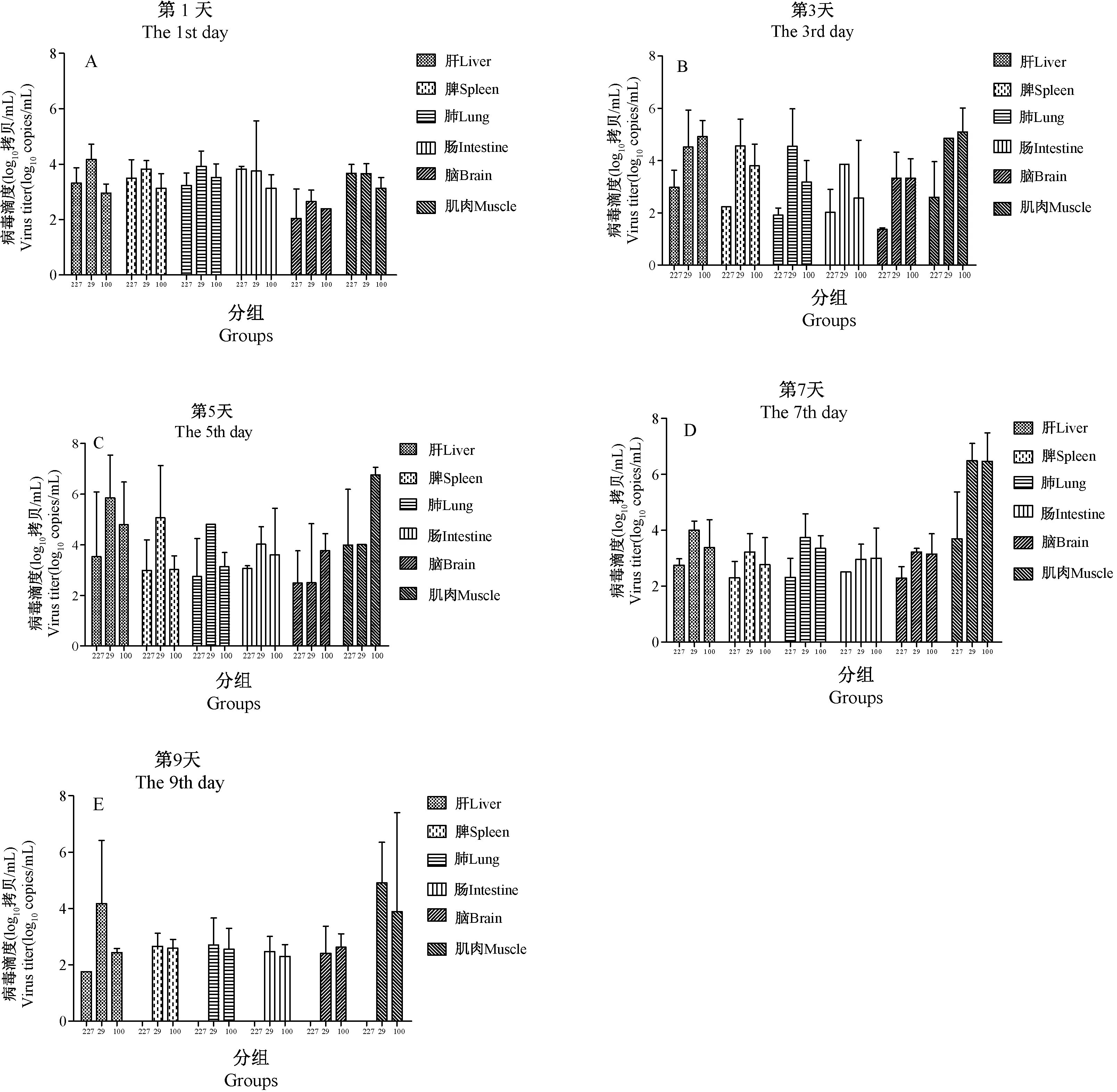
图9 各组不同时间组织病毒载量Fig.9 Virus titers in different organ tissues of the mouse groups at different time points post-infection
3 讨论
EV71是单股正链RNA病毒,属于肠道病毒科,为二十面体立体对称的球形结构,无包膜和突起,直径约为24~30 nm,由外层的衣壳和RNA核心构成[4]。EV71的衣壳是由有四个结构蛋白构成的五聚体,即VP1、VP2、VP3、VP4[4-5],分A、B、C三个基因型;根据VP1序列变异程度进一步分为11个亚型,即A、B1~B5和C1~C5[6],不同时期,不同地区流行的病毒株亚型不同,从1973~2008年期间亚太地区B1~B5和C1~C5都有流行,近年中国的病毒株主要以C4型为主,台湾地区C4、C5和B5均有流行[7]。国内关于EV71的研究也很多,但对临床病毒株以动物进行毒力探索的研究较少;且不同实验动物的选择或/和相同的实验动物不同的年龄,所获得的结果都是不同的;流行的病毒株受地域的影响,国内西南地区关于EV71毒力的动物研究更是匮缺。本研究以成都市地区流行的不同毒力株,在BALB/c新生鼠上进一步探求引起不同临床表现的机制,同时丰富了本地区的相关资料。
本研究中3株病毒在108~10TCID50/mL间,接种不同的临床毒株后,3个实验组均出现肢体麻痹、死亡,病理检测出现脑炎、肌肉炎症、肺出血和肝细胞水肿,成功建立EV71的感染模型。对照组的评分波动于1~3分间,第10天后评分逐渐降低,接近0,与既往研究中对照组评分均为0的情况有所不同[8-9]。本研究症状评分采用盲法,实验员不知病毒临床毒力情况,每日评分时仅提供每窝鼠的编号,未知接种的病毒种类,且整个评分过程由两位实验员独立完成,减少偏倚。对照组观察到乳鼠的疑似驼背、乏力、颤抖的症状,考虑可能与乳鼠神经系统与运动系统发育不完善有关,继而出现运动不稳的相关症状;且症状随着日龄的增加,相关症状逐渐减弱,至14 d时逐渐消失。统计学分析对照组的评分与3个实验组均有差异,进一步证明对照组的这种症状与病毒接种后出现的症状是不同的。实验组在接种后第2天出现一过性症状评分高值,在第5天后症状又开始加重,在第8~10天时出现症状的高峰,后逐渐恢复。考虑其发生可能与病毒的感染机制有关:EV71感染时首先在患者扁桃体、肠道潘氏结等淋巴组织中复制,进一步侵入邻近淋巴组织中大量复制,造成轻度病毒血症,从而引起接种第2天的症状评分较高,此阶段大部分EV71自然痊愈,呈轻症表现;而未得到控制的EV71在体内进一步扩散,侵及网状内皮系统(肝、脾、骨髓和淋巴结)、心脏、肺、胰腺、皮肤、黏膜,甚至危害中枢神经系统,出现相关症状[10],解释了第5天后出现症状的再次加重,达到症状的高峰的现象。实验组体重增长缓慢的出现、严重症状的发生、组织中聚集较高的病毒浓度出现在5 d以后,轻症组和重症组在6 d后出现死亡,严重程度在时间上一致,且与国内的研究基本相符。BALB/c 1日龄的乳鼠接种不同毒力的EV71病毒株,感染后3 d体重增长速度减慢,5 d出现后肢瘫痪,7 d时全部死亡[11];10日龄的BALB/c小鼠研究,在感染后4 d出现症状[12]。
病理读片由经验丰富的病理医师完成,肺出血在对照组均表现为少量红细胞,可能为解剖操作等因素所致,而实验组肺泡腔内出血的程度为大量、中量和少-中量,在相同人员操作将干扰因素所致出血控制在肺泡腔内少量红细胞的情况下,可以得出实验组的肺出血由病毒导致。肝病变在实验组与对照组均有多核巨细胞的增生,但实验组和对照组在炎细胞累及上有差异,轻症株组与重症株组中量炎细胞浸润,死亡株少-中量炎细胞浸润,对照组呈现少量炎细胞。肌肉第7天病变明显,实验组肌纤维卷曲、部分溶解,束膜溶解破裂,细胞核排列紊乱,肌间可见较多炎细胞浸润,对照组与实验组病理改变有差异,主要呈现部分卷曲改变,考虑受解剖剥离等因素影响。
本研究中肝和肌肉中病毒载量较其他组织高,EV71在鼠具有较强的肌肉嗜性[13- 14],适应株病毒的研究在肝、脾、肺、肌肉和脑中均检测出病毒,其中肌肉中的病毒载量最高[15]。脑组织接种后病毒量低,5~7 d时达到其峰浓度,7 d鼠口服模型的研究亦发现,接种后脑组织浓度未检出,在5 d时最高[14],与本研究结果相符。死亡毒株组织中病毒量在接种后第1天较高,第3天下降,第5天达高峰,第9天后仅肝检测出病毒。有研究发现感染后1 d和5 d为病毒感染的高峰期,3 d为一个低谷,7 d载量下降后不再上升,9 d时均没有病毒检出[16],与本研究中死亡株的趋势一致。其发生与病毒侵入机制有关,病毒进入后首先大量复制出现第1次高峰,随后因机体免疫系统的识别下降,适应后的病毒再次大量复制达到第2次高峰,后因鼠免疫系统的成熟完善而被清除,最终组织中不能检测出。
本研究中,轻症组小鼠的体重增长最缓慢,临床症状比死亡组重,死亡率最高(22.8%),接种后各个时间段组织中的病毒量更高,病理切片示肺出血最重;重症组在临床症状、死亡率和组织中病毒量方面,均较死亡组重。研究结果发现,在BALB/c乳鼠临床轻症病毒株毒力最强,死亡病毒株的毒力最弱,与人临床结局相反。其他的研究亦有类似的发现,不同临床毒株在小鼠实验中生存率不存在差异[17];体外研究发现,不同临床来源的病毒在细胞增殖特性和毒力方面差异不大[11]。不同临床病毒株是否因为毒力的差异而导致不同的临床结局,目前尚无定论,考虑可能与病毒基因、宿主及免疫状态综合影响相关。病毒基因变异的研究发现5′非翻译区的几个核苷酸与病毒毒力相关[18];核糖体进入位点(IRES)被证明和RNA病毒的翻译有关[19],该区域核苷酸的变化导致RNA二级结构变化,从而可能影响病毒翻译;VP1是负责病毒与宿主细胞结合的主要蛋白质,其区域氨基酸变化影响病毒和细胞受体之间的相互作用,从而可影响病毒致病性,动物和临床研究表明,VP1第710位的脯氨酸增加EV71毒力[18, 20-21];此外,高度保守的VP1A107结构与EV71成熟相关,进而影响病毒的感染能力[22]。此外,本实验毒株进一步研究发现:与疫苗株相比,基因同源性为95.12%~96.06%,其中同源性最高为重症毒株(96.06%),最低为轻症毒株(95.12%);VP1进化树显示,所有毒株均为C4亚型,除轻症毒株外,其余毒株均位于同一分支上;蛋白预测VP1二级结构存在蛋白结合位点差异,三级结构基本一致,即不同临床结局EV71毒株存在基因的差异,可能存在相关毒力影响因素或关键位点(相关数据发表中)。
不同临床来源的毒株在小鼠上呈现不同反应,其结果与人的临床结局不一致,轻症毒株最严重,死亡毒株最轻,可能与病毒基因差异、宿主因素相关,关于病毒毒力的机制,需要更多的研究。
