1例遗传性凝血因子V缺乏症家系的基因分析
2018-06-20梁枫萍
梁枫萍,程 鹏
(1.广西壮族自治区玉林市第一人民医院肿瘤血液科 537000; 2.广西医科大学第一附属医院血液内科,南宁 530021)
遗传性凝血因子V(FV)缺乏症是一种罕见出血性疾病,由FV结构或功能缺陷导致的常染色体隐性遗传性疾病。本研究通过凝血功能及FV活性的检测,确诊了1例FV缺乏症患者,并对其家系成员的FV基因进行测序,以寻找致病突变基因,探讨其发病机制。
1 资料与方法
1.1一般资料 先证者,男,33岁,广西宾阳人,汉族,自幼无异常出血表现,2014年因不育症就诊。查体:无阳性体征。实验室检查:凝血酶原时间(PT)38.7 s、活化部分凝血活酶时间(APTT)133.3 s ;凝血酶时间(TT)、纤维蛋白原(FIB)正常;FV促凝活性(FV∶C) 0.6%,其他凝血因子活性正常;血常规、肝功能正常。先证者父母,广西宾阳人,非近亲婚配;对先证者的直系家系成员包括先证者父亲、母亲、妹妹均进行凝血功能及基因检测。家系成员中无皮肤、牙龈出血或外伤后出血不止等出血及出血倾向,家系成员血常规、肝功能均正常,未曾使用抗凝剂。本研究经广西医科大学第一附属医院伦理委员会批准并征得先证者及其家系成员知情同意。家系图见图1。
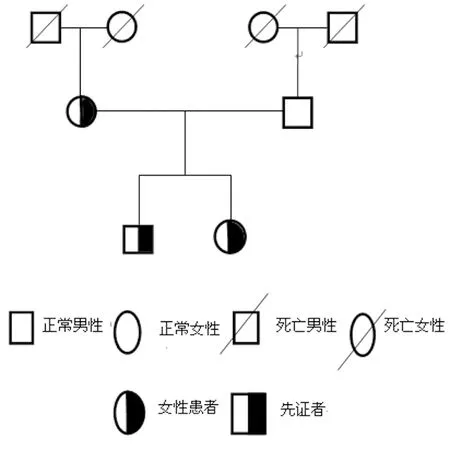
图1 遗传性凝血因子Ⅴ家系图
1.2方法
1.2.1实验仪器 PCR反应扩增仪(东胜龙),3130xl测序列分析仪(美国ABI公司),DK-8D型电热恒温水槽(上海森信实验仪器有限公司),DYCP-31E型稳压稳流电泳仪(北京六一),YXJ-2离心机(湘仪离心机仪器有限公司),H6-1微型电泳槽(上海精益有机玻璃制品仪器厂),凝胶成像系统(美国Gene Genius公司),移液器(范围100~1 000 μL,20~200 μL,0.5~10 μL)(德国Eppendorf公司)。
1.2.2主要试剂 Phusion Hot Start Ⅱ High-Fidelity DNA Polymerase(美国Thermo公司F-549S);Marker、6×DNA Loading Dye(上海生工生物技术有限公司);PCR产物纯化回收试剂盒(上海生工生物技术有限公司SK1141);10×TAE(400 mmol/L Tris-acetate and 10 mmol/L EDTA,pH 8.0)。
1.2.3标本采集和处理 所有研究对象抽取外周静脉血4 mL,EDTA抗凝,标本分2份,分别用于凝血功能分析及DNA提取。DNA提取后进行浓度和纯度测定,将DNA分装并冻存于-80 ℃备用。
1.2.4凝血功能分析 对先证者及家系成员进行PT、APTT、FⅡ∶C、FV∶C、FⅦ∶C、FⅧ∶C、FⅨ∶C、FⅩ∶C、FⅪ∶C、FⅫ∶C测定。
1.2.5引物设计 参照文献[1]设计了30对引物(表1),由上海生工生物技术有限公司合成。

表1 PCR引物序列表
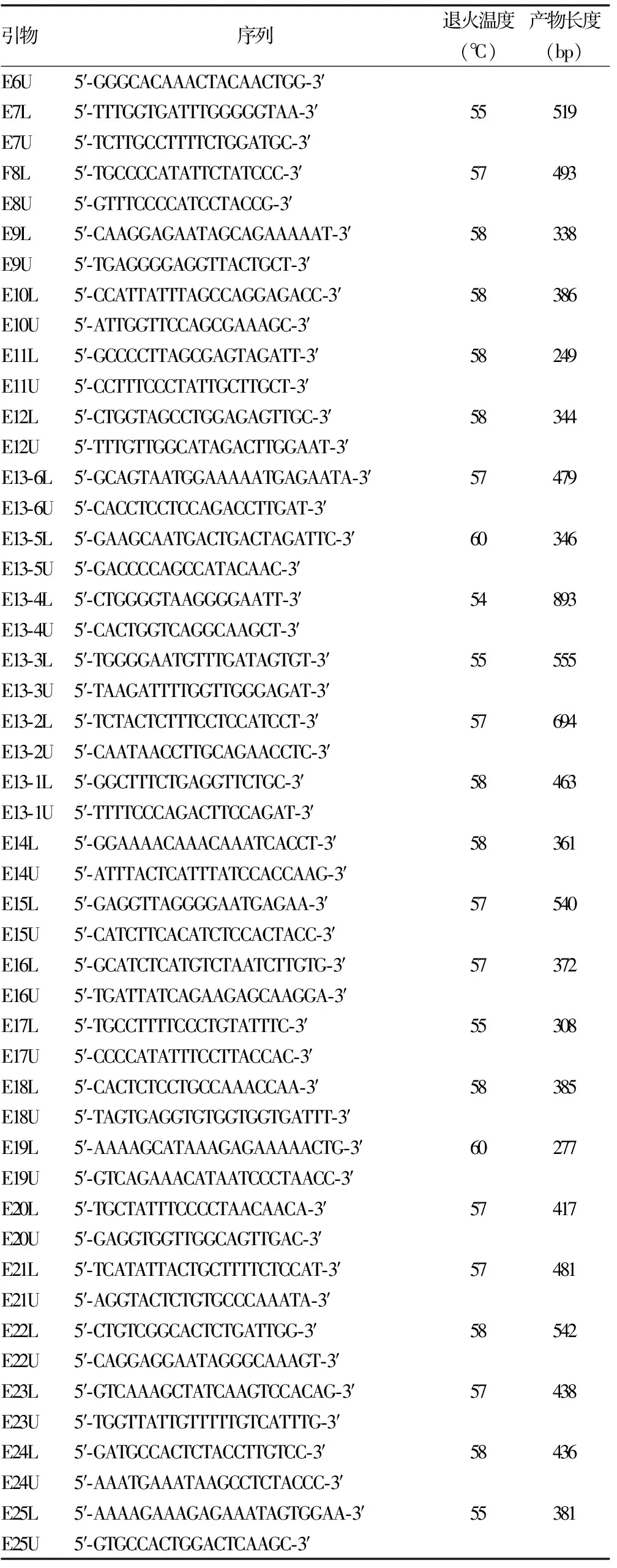
续表1 PCR引物序列表
1.2.6PCR扩增 PCR反应系为20 μL,包括10 μL PCR Mix ,上下游引物各1 μL,模板DNA 1 μL,超纯水7 μL。在DNA热循环仪上进行PCR扩增,反应条件如下:98 ℃预变性2 min,98 ℃变性30 s,60 ℃退火35 s,72 ℃延伸20 s,循环35次,最后72 ℃再延伸5~8 min。取PCR产物5 μL上样于1.8%琼脂糖凝胶,1×TBE缓冲液中100 mV电压电泳30 min后,将凝胶置于数字化凝胶成像分析仪内拍照分析。
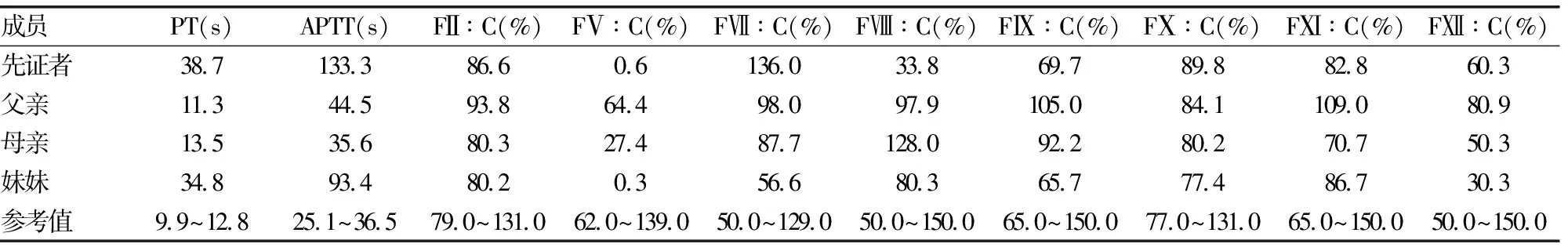
表2 遗传性凝血因子V缺乏症家系成员凝血指标检测结果
1.2.7PCR扩增产物纯化及测序 PCR扩增产物回收纯化,严格按纯化试剂盒说明书操作,纯化产物进行直接测序。以美国NCBI基因库公布的序列AY364535为标准,采用Chroma软件对测序结果进行分析比对,寻找基因变异位点。变异位点与NCBI中的SNP数据库比对,确定是否存在人群基因多态性。最后对异常测序结果重新进行PCR扩增及正向、反向测序,进一步确定基因突变。
2 结 果
2.1凝血功能检测结果 先证者及其妹妹APTT、PT明显延长,先证者FⅤ∶C 0.6%,妹妹FⅤ∶C 0.3%,母亲FⅤ∶C 27.4%;先证者及其家系成员FⅡ∶C、FⅦ∶C、FⅧ∶C、FⅨ∶C、FⅩ∶C、FⅪ∶C、FⅫ∶C均在正常范围内,见表2。
2.2测序结果 先证者FⅤ基因存在1个杂合错义突变G16088C(Asp68His);8个单核苷酸多态性(SNP)位点突变,杂合错义突变A38529G(Arg485Lys),纯合错义突变A58668G(Met1736Val)、A45888G(Lys830Arg)、A45909G(His837Arg)、A46088G(Lys897Glu)、纯合同义突变C45523T(Ile708Ile)、T45550C(Asn717Asn)、A45616G (Ser739Ser);先证者妹妹的基因型与先证者完全一致;先证者父亲不存在杂合错义突变G16088C(Asp68His),8个SNP位点均为杂合突变。先证者母亲存在杂合错义突变G16088C(Asp68His),8个SNP位点均为杂合突变。这些SNP位点与NCBI的SNP数据库记录的相一致,见表3、图2~5。
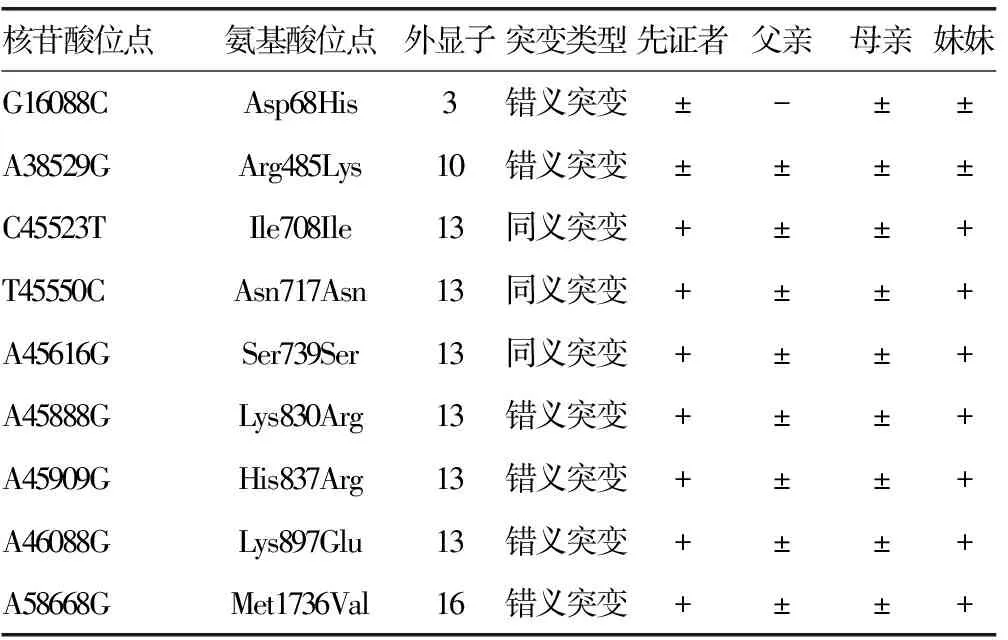
表3 先证者及其家系成员FⅤ基因突变位点
核苷酸位点参照Genbank序列,AY364535;+:纯合突变;±:杂合突变;-:无突变
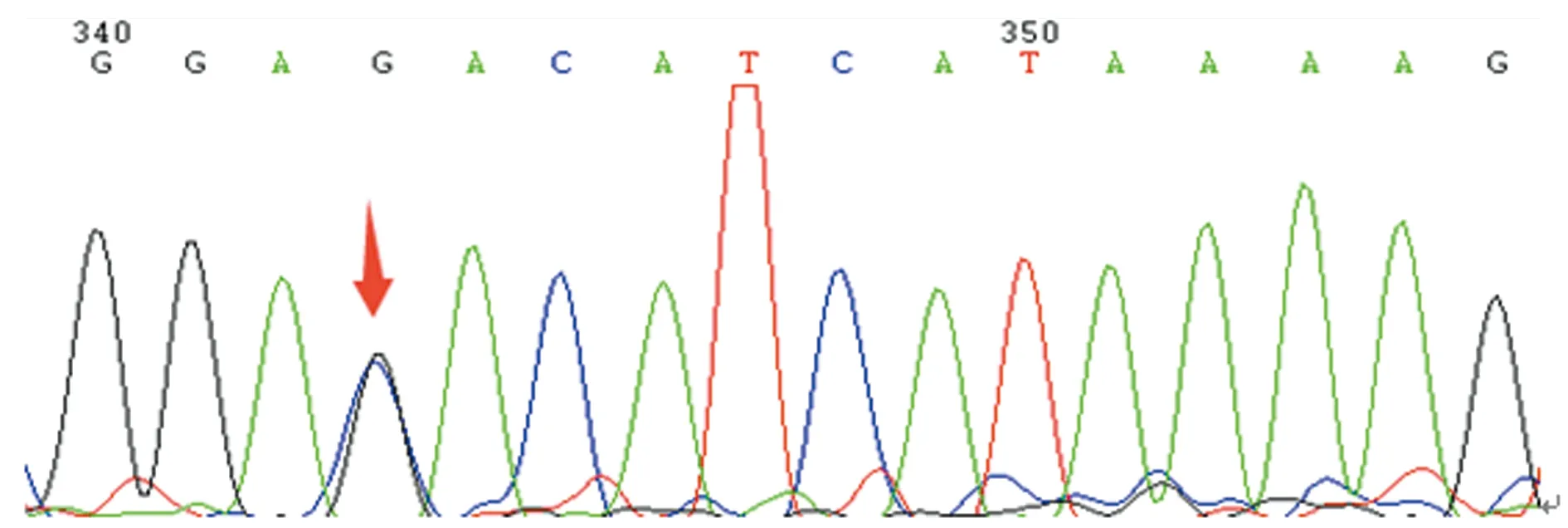
箭头示存在G16088C杂合子突变
图2先证者第3外显子正向测序结果
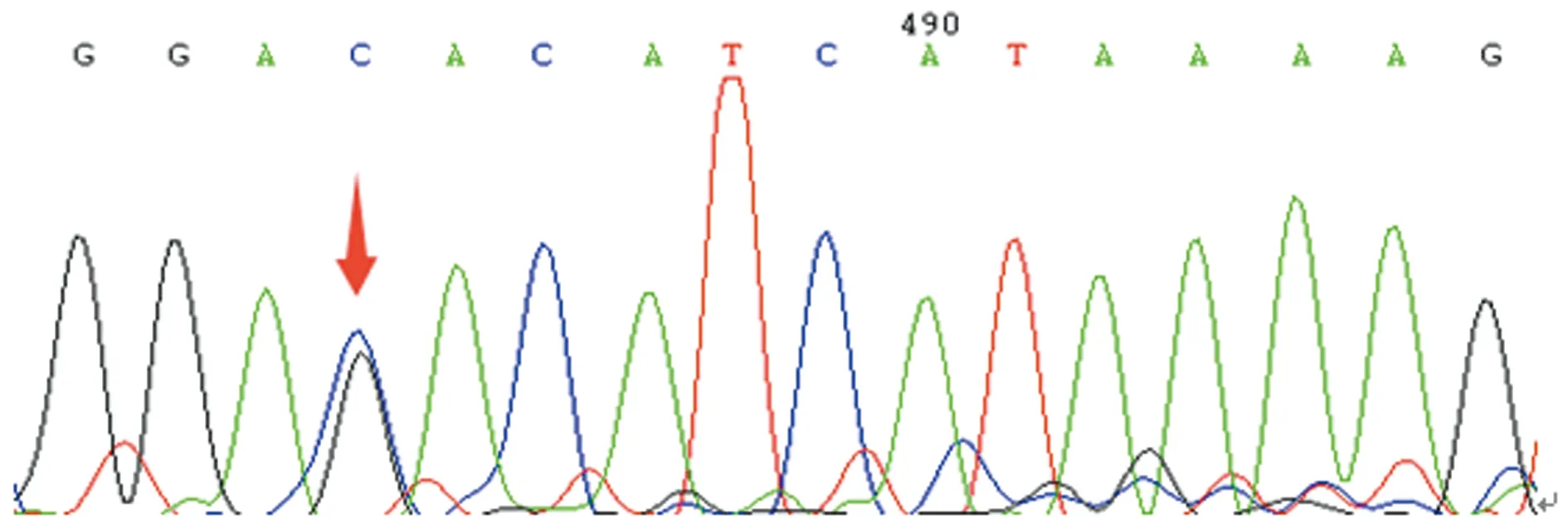
箭头示存在G16088C杂合子突变
图3先证者妹妹第3外显子正向测序结果
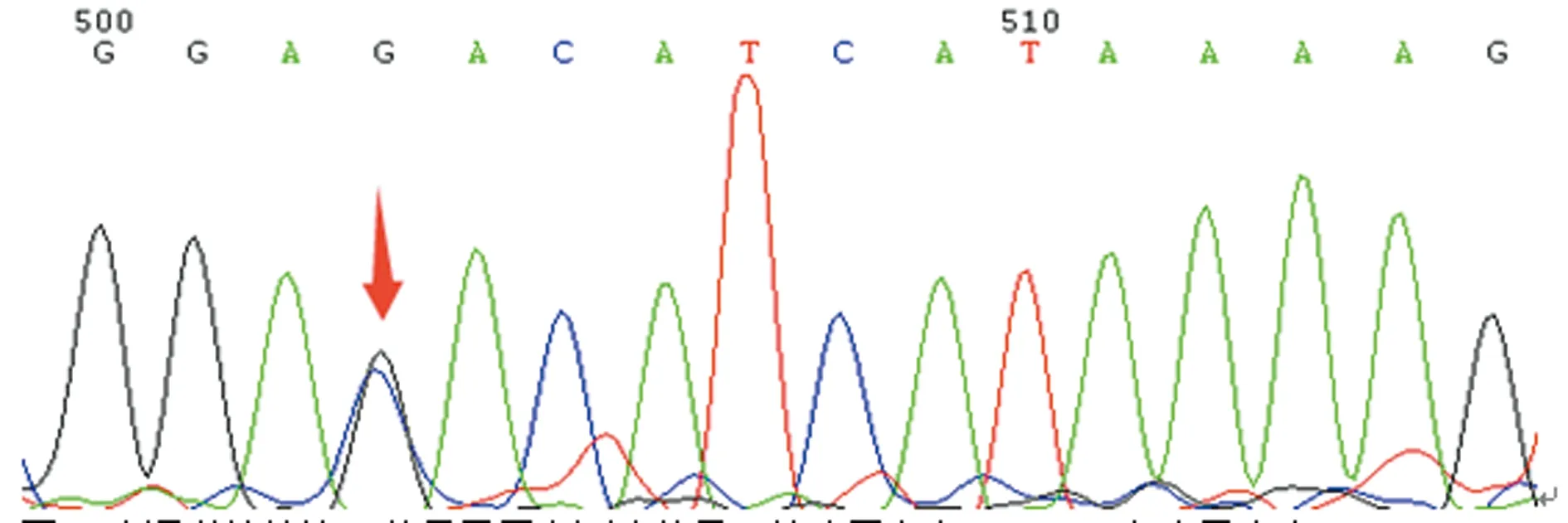
箭头示存在G16088C杂合子突变
图4先证者母亲第3外显子正向测序结果
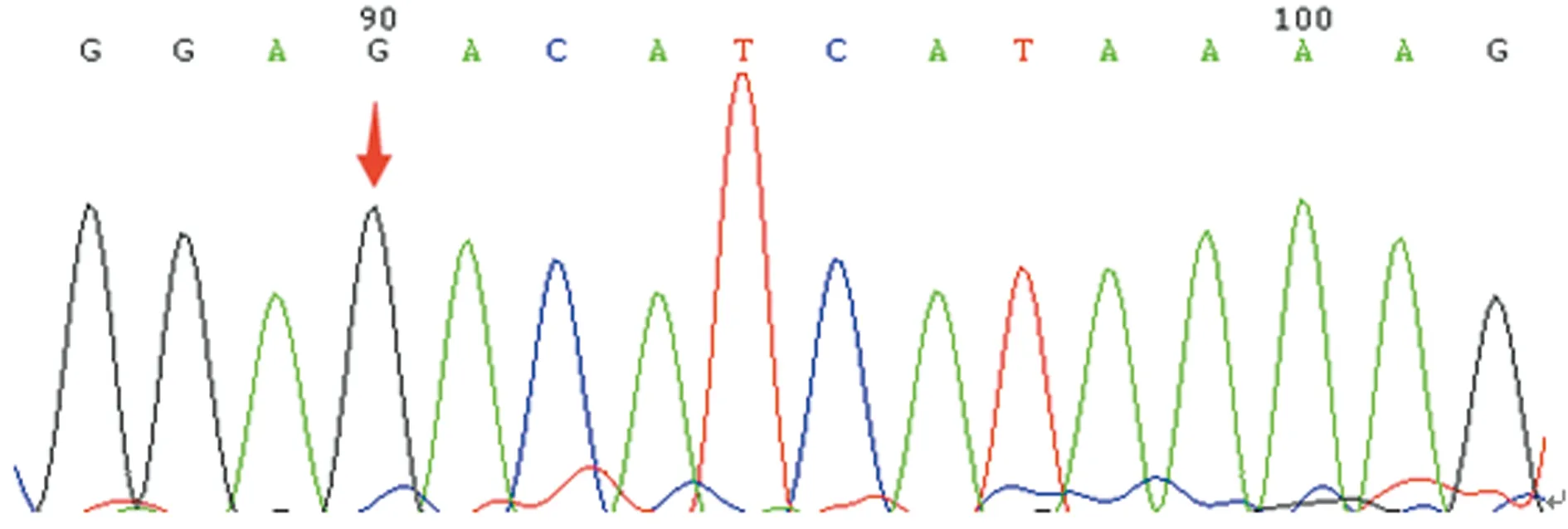
箭头示相同位点与野生型一致
图5先证者父亲第3外显子正向测序结果
3 讨 论
FⅤ缺乏症是由FⅤ结构或功能缺陷导致的常染色体隐性遗传性疾病。患者常表现为皮肤黏膜出血、月经过多、创伤出血不止,但肌肉和关节出血少见,颅脑出血更是罕见[2]。凝血筛查实验PT、APTT延长,即刻及孵育APTT纠正实验可排除狼疮抗凝物及FⅧ因子抗体,进一步行FⅤ∶C测定具有诊断意义。基因分析一般在临床研究中进行,且由于传统基因测序技术的局限性,5%~10%患者的基因突变无法检测出来[3],因此FⅤ∶C轻度下降的杂合突变患者,明确诊断仍面临着挑战。FⅤ缺乏症分为两型:Ⅰ型是FⅤ抗原(FⅤ∶Ag)和FⅤ∶C同步下降;Ⅱ型是FⅤ蛋白异常所致,呈FⅤ∶Ag正常而FⅤ∶C降低,或者FⅤ∶Ag和FⅤ∶C下降不平行。
成熟的FⅤ由2 196个氨基酸构成,分为5个功能区,即A1-A2-B-A3-C1-C2。活化的FⅤ(FⅤa)是异二聚体,重链区包括A1、A2及NH2端,轻链区包括A3、C1、C2及羧基端,通过二价金属离子(2个Ca2+和一个Cu2+)非共价联结[4-6]。编码人类FⅤ的基因定位于1 号染色体q24.2,含25个外显子及24个内含子。第1~12外显子编码信号肽和A1-A2区,第13外显子编码B区,14~25外显子编码A3、C1和C2区。
目前已发现了约160种与FⅤ缺乏症有关的基因突变,包括无义突变、错义突变、删除、插入、剪切位点突变。错义突变通常引起单个氨基酸置换,影响了FⅤ的折叠和构象改变,分泌途径的质量控制系统将其滞留在细胞内,导致细胞内降解和分泌障碍[7],这是大部分错义突变导致FⅤ∶Ag和FⅤ∶C同步降低的Ⅰ型FⅤ缺乏症的机制。少数错义突变(His147Arg、Tyr91Asn、Ala221Val和His147Arg)[8-9],影响了二价金属离子Cu2+的结合位点[9]、A1-A2-A3结构域的相互作用,导致了轻链和重链的相对分离,影响了FⅤa的稳定性,从而导致FⅤ∶Ag和FⅤ∶C非同步下降的Ⅱ型FⅤ缺乏症。虽然大部分的错义突变位于A2和C2结构域,但越来越多发生在A1结构域的错义突变被证实[10]。A1结构域是FⅤa和活化的FⅩ(FⅩa)相互反应的重要区域,此外,A1结构域存在重链与二价金属离子Ca2+相互作用的位点,影响着FⅤa的轻链和重链的相互联结[11]。因此,发生在A1结构域的突变不仅导致Ⅰ型FⅤ缺乏症,也导致Ⅱ型FⅤ缺乏症[12-13]。
曹丽娟等[1]通过分子建模分析发现,Asp68His突变发生后,维持A1区β片层结构的氢键及分子表面范德华力发生偏移,降低了分子结构的稳定性,从而影响FⅤ-Asp68His突变蛋白的折叠、细胞内转运、分泌。
2014年台湾国立成功大学的学者对FⅤ-Asp68His蛋白进行了体外表达研究证实,Asp68His突变导致了FⅤ分泌障碍,且FⅤ细胞内降解增强,从而引起FⅤ∶Ag和FⅤ∶C同步下降[14]。
本研究中,先证者自幼无异常出血表现,因不育症就诊检查发现PT 38.7 s、APTT 133.3 s,FⅤ∶C仅0.6%,排除了肝病等获得性因素导致的FⅤ∶C减低,且先证者母亲和妹妹FⅤ∶C均降低,临床诊断FⅤ缺乏症明确。基因测序结果显示先证者及其母亲、妹妹均存在杂合错义突变G16088C(Asp68His),家系分析表明先证者母亲及妹妹均是Asp68His杂合错义突变(图2、3、4),而父亲相同位点与野生型一致(图5),提示该突变遗传自母亲,因此,基因水平诊断FⅤ缺乏症明确。Asp68His突变是本研究中先证者及其妹妹、母亲FⅤ∶C下降的主要原因。
先证者及其母亲、妹妹基因突变类型均为杂合错义突变,但三者的FⅤ∶C差异较大。对目前文献报道的Asp68His突变FⅤ缺乏症家系数据分析也发现FⅤ∶C水平的差异[1,15],4个Asp68His杂合子的FⅤ∶C波动在45%~63%,1个Asp68His纯合子突变的FⅤ∶C 5%,提示纯合子突变患者的FⅤ∶C较杂合子突变下降明显。本研究的先证者和其母亲、妹妹都是Asp68His突变杂合子,但FⅤ∶C下降明显,与文献报道不一致,提示有其他的因素影响着FⅤ∶C。2010年黄丹丹等[16]报道的FⅤ缺乏症患者证实是Asp68His杂合错义突变,其FⅤ∶C 5%,其基因分析结果发现了位于同一条染色体上的4个SNP,分别导致了Met413Thr、His1327Arg、Metl764Val和Asp2222Gly突变,其研究结果认为,Asp68His杂合错义突变和4个SNP共同导致了FⅤ∶C水平下降。YAMAZAKI等[17]的体外表达研究证实这4个多态性(Met413Thr、His1327Arg、Metl764Val和Asp2222Gly)同时存在时,FⅤ的表达水平比野生型显著降低,约为野生型的20%,其原因是蛋白质合成率明显降低并伴分泌障碍,其中Asp2222Gly是造成分泌障碍的关键因素。本研究的基因分析结果显示,先证者及其妹妹存在4个纯合错义突变多态性(Met1736Val、Lys830Arg、His837Arg、Lys897Glu)和1个杂合错义突变多态性(Arg485Lys),先证者母亲存在这5个SNP的杂合形式,据此推断,这5个SNP的存在影响了FⅤ∶C水平。此外,先证者及其母亲、妹妹均存在同义突变C45523T(Ile708Ile)、T45550C (Asn717Asn)、A45616G (Ser739Ser),突变并未引起编码氨基酸改变,对FⅤ∶C无影响。
总之,Asp68His突变是导致先证者及其母亲、妹妹FⅤ∶C下降的主要原因,Arg485Lys 、Met1736Val、Lys830Arg、His837Arg、Lys897Glu 5种SNP的存在可能影响着FⅤ∶C。这5种SNP下调FⅤ∶C水平的具体机制有待进一步的研究。
[1]曹丽娟,王兆诚.五例遗传性凝血因子V缺乏症的基因分析[D].苏州:苏州大学,2007.
[2]LAK M,SHARIFIAN R,PEYVANDI F,et al.Symptoms of inherited factor V deficiency in 35 Iranian patients[J].Br J Haematol,1998,103(4):1067-1069.
[3]PALLA R,PEYVANDI F,SHAPIRO A D.Rare bleeding disorders:diagnosis and treatment[J].Blood,2015,125(13):2052-2061.
[4]KENT W J,SUGNET C W,FUREY T S,et al.The human genome browser at UCSC[J].Genome Res,2002,12(6):996-1006.
[5]MANN K G,KALAFATIS M.Factor V:a combination of Dr Jekyll and Mr Hyde[J].Blood,2003,101(1):20-30.
[6]NICOLAES G A,DAHLBACK B.Factor V and thrombotic disease:description of a janus-faced protein[J].Arterioscler Thromb Vasc Biol,2002,22(4):530-538.
[7]CAI X H,WANG X F,DING Q L,et al.Factor V C1149G and 5609-10INSCGTGGTT causing factor V deficiency:molecular characterization by in-vitro expression[J].Thromb Haemost,2007,98(3):683-685.
[8]STEEN M,MITEVA M,VILLOUTREIX B O,et al.Factor V New Brunswick:Ala221Val associated with FV deficiency reproduced in vitro and functionally characterized[J].Blood,2003,102(4):1316-1322.
[9]LIU H C,LIN T M,ENG H L,et al.Functional characterization of a novel missense mutation,His147Arg,in A1 domain of FV protein causing type Ⅱ deficiency[J].Thromb Res,2014,134(1):153-159.
[10]VOS H L.An online database of mutations and polymorphisms in and around the coagulation factor V gene[J].J Thromb Haemost,2007,5(1):185-188.
[11]ADAMS T E,HOCKIN M F,MANN K G,et al.The crystal structure of activated protein C-inactivated bovine factor Va:Implications for cofactor function[J].Proc Natl Acad Sci USA,2004,101(24):8918-8923.
[12]PARABOSCHI E M,KAYIRAN S M,ÖZBEK N,et al.Functional characterization of a novel missense mutation identified in a Turkish patient affected by severe coagulation factor V deficiency[J].Haemophilia,2012,18(2):205-210.
[13]DELEV D,PAVLOVA A,HEINZ S,et al.Modelling and expression studies of two novel mutations causing factor V deficiency[J].Thromb Haemost,2008,100(5):766-772.
[14]LIU H C,SHEN M C,ENG H L,et al.Asp68his mutation in the a1 domain of human factor V causes impaired secretion and ineffective translocation[J].Haemophilia,2014,20(4):e318-e326.
[15]CAO L,WANG Z,LI H,et al.Gene analysis and prenatal diagnosis for two families of congenital factor V deficiency[J].Haemophilia,2011,17(1):65-69.
[16]黄丹丹,王学锋,陈华云,等.四个遗传性凝血因子V缺陷症家系临床表型和基因型变化的研究[J].中华血液学杂志,2010,31(3):149-153.
[17]YAMAZAKI T,NICOLAES G A,SRENSEN K W,et al.Molecular basis of quantitative factor V deficiency associated with factor V R2 haplotype[J].Blood,2002,100(7):2515-2521.
