XACB/MSCs/Lv-GFP-FGF-2的制备及其对兔激素性股骨头缺血坏死的治疗效果观察
2018-06-15王健波彭吾训张健张飞张槐赵胤李青邓进贵州医科大学贵阳550000
王健波,彭吾训,张健,张飞,张槐,赵胤,李青,邓进(贵州医科大学,贵阳550000)
股骨头缺血坏死是以股骨头严重缺少血液供应和骨内压明显升高为病理特征的髋关节疾病,其发病机制复杂,影响因素较多[1,2]。目前治疗股骨头缺血坏死的方法有很多,如髓芯减压、骨移植、关节成形及关节置换等[3],但每一种方法均有不足。目前,以基因转染技术改造或加强的骨髓基质干细胞(MSCs)为种子细胞的组织工程骨已逐渐用于股骨头缺血坏死的治疗,但移植后MSCs凋亡的机制尚未完全明确[4]。TNF-α在 MSCs的凋亡过程中发挥不可忽视的作用。2016年10月~2017年8月,本研究以异种脱抗原松质骨(XACB)作为构建组织工程骨的支架材料,利用慢病毒为载体介导成纤维细胞生长因子2(FGF-2)基因转染兔MSCs,并与XACB复合培养,制备了组织工程骨XACB/MSCs/Lv-GFP-FGF-2;现分析其对兔激素性股骨头缺血坏死的治疗作用及其机制。
1 材料与方法
1.1 材料 动物:6周龄新西兰大白兔5只,雌雄不限,体质量1.0~1.5 kg;3月龄新西兰大白兔80只,雌雄不限,体质量3.5~4.0 kg;均购于贵州医科大学动物实验中心。主要试剂:DMEM培养基(美国Gibco公司),胎牛血清(美国Hyclone公司);Percoll分离液(美国Sigma公司);碱性磷酸酶(ALP)试剂盒(北京索莱宝科技有限公司);成骨诱导培养基(广州赛业科技有限公司)。主要仪器:CO2孵箱(Thermo forma 31I,美国),倒置相差显微镜、荧光显微镜(日本Olympus公司),NDl000型核酸蛋白测量仪(美国Nanodrop公司),C1000型PCR扩增仪、iCycler iQ荧光定量PCR仪(美国BIO-RAD公司)。
1.2 组织工程骨XACB/MSCs/Lv-GFP-FGF-2的制备
1.2.1 兔MSCs分离、培养及鉴定 选择6周龄新西兰大白兔5只,静脉麻醉后于股骨及胫骨处用骨髓穿刺针抽取骨髓,采用密度梯度离心法和贴壁法行细胞分离培养。选取第3代MSCs,倒置相差显微镜观察细胞形态,结果显示细胞呈长梭形、外形均一、排列整齐呈鱼群状。使用流式细胞仪鉴定细胞表型分子CD44表达,结果显示CD44阳性率>99%。采用成骨诱导分化培养基培养MSCs,并行茜素红染色及ALP染色。结果均呈阳性,茜素红染色可见钙结节被染成橘红色,ALP染色阳性细胞的细胞膜及细胞质内颗粒染色呈黑色。证实分离出的细胞是MSCs。
1.2.2 兔MSCs转染 ①慢病毒介导FGF-2基因转染MSCs:取生长状况良好的第3代兔MSCs随机分为病毒转染组、空病毒转染组、空白对照组,依据前期预试验确定的MOI值(50),病毒转染组加入载有FGF-2基因的慢病毒液,空病毒转染组加入未载有FGF-2基因的慢病毒液,空白对照组加慢病毒稀释液,使用倒置荧光显微镜观察转染细胞绿色荧光蛋白(GFP)表达情况。结果显示,病毒转染组、空病毒转染组荧光显微镜下可见大量的GFP,空白对照组未见GFP。②稳转细胞株筛选:根据前期预试验结果对转染细胞加入嘌呤霉素进行筛选,获得稳转细胞株。采用Western blottting法检测各组FGF-2蛋白相对表达量(条带灰度值),结果显示病毒转染组、空病毒转染组及空白对照组FGF-2蛋白相对表达量分别为0.757±0.034、0.457±0.015、0.428±0.012,病毒转染组明显高于空病毒转染组及空白对照组(P均<0.05)。采用qRT-PCR法检测各组FGF-2 mRNA相对表达量(采用2-ΔΔCt法计算),结果显示病毒转染组、空病毒转染组及空白对照组FGF-2 mRNA相对表达量分别为32.016±3.902、3.531±0.638、1.023±0.007 ,病毒转染组明显高于空病毒转染组及空白对照组(P均<0.05)。证实嘌呤霉素筛选得到的病毒转染组细胞株可稳定表达FGF-2,病毒转染组、空病毒转染组分别获得稳转细胞MSCs/Lv-GFP-FGF-2、MSCs/Lv-GFP。③细胞株与XACB复合培养:分别调整病毒转染组、空病毒转染组及空白对照组的细胞密度为5×106/mL,将预处理的XACB置入6孔板中。分别加入各组细胞悬液约100 μL/孔,与完全培养基进行复合培养,分别获得组织工程骨XACB/MSCs/Lv-GFP-FGF-2、XACB/MSCs/Lv-GFP、XACB/MSCs。培养第6天,电镜下观察细胞株附着、分布、生长情况。结果显示病毒转染组XACB/MSCs/Lv-GFP-FGF-2细胞株伸出伪足,向周围伸展,帖附于XACB并且生长良好。
1.3 XACB/MSCs/Lv-GFP-FGF-2对兔股骨头缺血坏死的治疗作用及其对股骨头组织TNF-α表达的影响
1.3.1 模型制备及分组处理 选择3月龄新西兰大白兔80只,参照Wu等[5]的方法,采用内毒素与甲基强的松龙制备兔激素性股骨头缺血坏死模型。建模后8周行MRI检查,T1像示股骨头关节软骨下呈点状、片状低信号,T2像示股骨头关节软骨下呈点状、片状高信号,判定激素性股骨头缺血坏死模型建立成功[6]。选择建模成功的激素性股骨头缺血坏死兔60只随机分为A、B、C、D、E组,各12只。各组均静脉注射3%戊巴比妥钠麻醉,无菌操作下髋关节外侧切口,显露股骨头,于股骨头颈交界处开口行髓芯减压,A组不植骨、B组植入自体松质骨、C组植入XACB/MSCs、D组植入XACB/MSCs/Lv-GFP、E组植入XACB/MSCs/Lv-GFP-FGF-2。植入后缝合伤口,术后使用抗生素预防感染。实验过程中如有死亡动物则立刻补齐,保证每组可利用样本均为12只。
1.3.2 股骨头大体形态观察 术后3、6、12周,各组分别随机选择4只兔处死,于无菌条件下取出股骨头,先观察股骨头表面情况,再沿股骨头冠状面剖开,观察股骨头缺血坏死区修复情况。
1.3.3 股骨头组织TNF-α表达检测 ①免疫组化法:将各组不同时期的股骨头组织分为两部分,一部分保存于液氮中;另一部分标本用EDTA脱钙液脱钙后,常规脱水,石蜡包埋,制成5 μm厚度的切片,常规行免疫组织化学染色。TNF-α抗原表达阳性的细胞被染成棕黄色,细胞排列不整、形态紊乱。采用Image-Pro Plus图像计数软件随机选择5个视野,计数100个细胞内TNF-α阳性细胞数,计算TNF-α阳性表达率,取平均值。②Real-time PCR法:取各组不同时期保存于液氮中的股骨头组织,液氮中研磨呈粉状后,采用TRIzol法提取总RNA。按逆转录试剂盒(上海生工生物工程有限公司)说明书逆转录合成 cDNA。TNF-α及内参基因β-actin引物均采用Primer Premier软件设计合成。TNF-α上游引物:5′-TAGTAGCAAACCCGCAAG-3′,下游引物:5′-AAGAGAACCTGGGAGTAGATG-3′;β-actin上游引物:5′-ATCAGCAAGCAGGAGTAT-3′,下游引物:5′-CAATCTCGTCTCGTTTCTG-3′。PCR反应总体系20 μL: 2×qPCR Master Mix 10 μL、上下游引物各0.8 μL、cDNA 2 μL、双蒸水6.4 μL。PCR反应条件:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,循环40次。采用 2-ΔΔCt法计算TNF-α mRNA相对表达量。
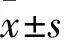
2 结果
2.1 各组股骨头大体形态比较 所有股骨头无脱位、塌陷及骨折。术后3周,A组缺损区与周围骨组织界限清晰,由肉芽组织填充;B、C、D组缺损区移植骨吸收不完全,缺损区界限清晰,由肉芽组织填充,周围见少量新骨形成;E组移植骨未完全吸收,缺损区界限清晰,周围见新骨形成。术后6周,A组缺损区由肉芽组织填充,仍无明显新骨形成;B组移植骨吸收不全,缺损区界限清晰,由肉芽组织填充,周围有新骨形成;C、D组缺损区仍清晰可见,边缘可见明显新骨形成,中央由肉芽组织填充;E组大部分缺损区已被新骨填充,界限模糊,移植骨已基本被吸收。术后12周,A组缺损区几乎由结缔组织填充,周围见少许新骨形成;B组缺损区移植骨与周围正常骨界限较清晰,可见新骨形成;C、D组缺损区移植骨完全被吸收,周围大量新骨形成,中央可见少量结缔组织填充;E组移植骨与周围正常骨组织界限不清,骨修复程度接近正常松质骨。
2.2 各组股骨头组织TNF-α阳性表达率比较 术后3、6、12周,B、C、D、E组股骨头组织TNF-α阳性表达率均逐渐降低(P均<0.05)。术后3周,E组股骨头组织TNF-α阳性表达率低于A、B、C、D组(P均<0.05);术后6、12周相同时间点,股骨头组织TNF-α阳性表达率A组>B组>C、D组>E组(P均<0.05)。见表1。
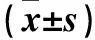
表1 各组股骨头组织TNF-α阳性表达率比较
注:与同组术后3周比较,aP<0.05;与同组术后6周比较,bP<0.05;与A组同时间点比较,cP<0.05;与B组同时间点比较,dP<0.05;与C组同时间点比较,eP<0.05;与D组同时间点比较,fP<0.05。
2.3 各组股骨头组织TNF-α mRNA相对表达量比较 术后3、6、12周,B、C、D、E组股骨头组织TNF-α mRNA相对表达量均逐渐降低(P均<0.05)。术后3周,E组股骨头组织TNF-α mRNA相对表达量低于A、B、C、D组(P均<0.05);术后6、12周相同时间点,股骨头组织TNF-α mRNA相对表达量A组>B组>C、D组>E组(P均<0.05)。见表2。
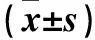
表2 各组股骨头组织TNF-α mRNA相对表达量比较
注:与同组术后3周比较,aP<0.05;与同组术后6周比较,bP<0.05;与A组同时间点比较,cP<0.05;与B组同时间点比较,dP<0.05;与C组同时间点比较,eP<0.05;与D组同时间点比较,fP<0.05。
3 讨论
股骨头缺血坏死的发病机制包括多种理论体系,如血管内凝血及骨坏死学说、脂肪栓塞学说、骨质疏松与显微骨折学说及骨内压增高理论等[7,8],其病理变化为骨细胞坏死。以MSCs 为种子细胞,结合基因转染技术与组织工程技术是目前治疗股骨头缺血坏死的研究热点[9]。MSCs是骨髓基质系统中的一类多能干细胞,免疫原性弱,可诱导分化为骨、软骨、脂肪、肌腱、神经、肌肉等组织,是细胞工程和基因工程的理想载体细胞。MSCs不仅可以携带目的基因,还可发挥细胞替代和细胞转化的特殊作用[10~12]。bFGF 不仅具有广泛的生物学效应,可促进成骨细胞、成软骨细胞蛋白质的合成和细胞分化增殖,协同其他骨生长因子成骨;还能促进毛细血管生长,有利于新骨形成和替代[13,14]。研究发现,转染后的MSCs在形态上与转染前无明显差别,并可成功表达bFGF[15,16]。本研究利用慢病毒为载体介导FGF-2基因转染兔MSCs,结果显示转染后的MSCs可大量表达GFP,FGF-2蛋白相对表达量及mRNA相对表达量均明显升高,证实嘌呤霉素筛选得到的病毒转染组细胞株可稳定表达FGF-2。自体骨移植在修复过程中主要为软骨下骨和关节软骨提供结构性支撑,以防止塌陷[17]。XACB具备良好的生物相容性及合适的力学强度,具有天然的多孔结构和合适的孔隙率,利于复合种子细胞及骨诱导因子,便于血管组织的长入和软骨分化形成[18]。本研究将病毒转染组细胞株与XACB进行复合培养,得到XACB/MSCs/Lv-GFP-FGF-2,电镜结果显示其细胞株伸出伪足,向周围伸展,帖附于XACB并且生长良好;证实成功获得组织工程骨XACB/MSCs/Lv-GFP-FGF-2。
本研究激素性股骨头缺血坏死模型股骨头组织病理学以骨髓细胞坏死、骨髓内脂肪细胞增多为主要表现,符合股骨头缺血坏死病理变化,适合用于股骨头缺血坏死治疗的相关研究。本研究结果显示,术后3周,E组可见少量新骨形成,其余各组均未见新骨形成。术后6周,A组缺损区由肉芽组织填充,仍无明显新骨形成;B、C、D组缺损区仍清晰可见,边缘可见新骨形成;E组大部分缺损区已被新骨填充,移植骨已基本吸收。术后12周,A组仅有少量新骨形成,B、C、D组均未完全修复,E组缺损区修复接近正常松质骨。说明XACB/MSCs/Lv-GFP-FGF-2移植治疗兔激素性股骨头缺血坏死的效果较好。Samara等[19]研究显示,大量炎症因子参与股骨头缺血坏死的发展过程,如IL-1、IL-2、IL-4、IL-6、IL-10和TNF-α。TNF-α是参与骨重建的促炎因子之一[20]。本研究结果显示,术后3周,E组股骨头组织TNF-α阳性表达率及mRNA相对表达量均明显低于A、B、C、D组;术后6、12周相同时间点,股骨头组织TNF-α阳性表达率及mRNA相对表达量A组>B组>C、D组>E组。说明XACB/MSCs/Lv-GFP-FGF-2治疗兔激素性股骨头缺血坏死的机制可能与其降低股骨头组织TNF-α表达有关。分析原因,转染FGF-2基因的MSCs在股骨头缺血坏死早期即可促进成骨细胞合成和毛细血管生长,并下调TNF-α表达,从而减轻炎症反应。
综上所述,本研究成功制备了组织工程骨XACB/MSCs/Lv-GFP-FGF-2;其治疗兔激素性股骨头缺血坏死的效果较好,作用机制可能为抑制股骨头组织TNF-α表达。
参考文献:
[1] Kamal D, Traistaru R, Kamal CK, et al. Macrophage response in patients diagnosed with aseptic necrosis of the femoral head presenting different risk factors[J]. Rom J Morphol Embryol, 2015,56(1):163-168.
[2] DePasse JM, Palumbo MA, Haque M, et al. Complications associated with prone positioning in elective spinal surgery[J]. World J Orthop, 2015,6(3):351-359.
[3] Thiel GSV, Mather RC. The treatment of osteonecrosis in the hip.oper techn sports med[J]. Operat Tech Sport Med, 2015,23(3):222-230.
[4] Zhang F, Cui J, Lv BO, et al. Nicorandil protects mesenchymal stem cells against hypoxia and serum deprivation-induced apoptosis[J]. Int J Mol Med, 2015,36(2):415-423.
[5] Wu X, Yang S, Duan D, et al. Experimental osteonecrosis induced by a combination of low dose lipopolysaccharide and highdose methylprednisolone in rabbits[J]. Joint Bone Spine, 2008,75(5):573-578.
[6] 马焕芝,曾炳芳,李晓林,等.甲基强的松龙联合内毒素诱导兔股骨头缺血性坏死的实验研究[J].中国修复重建外科杂志,2008,22(3):265-270.
[7] Gangji V, Hauzeur JP, Schoutens A, et al. Abnormalities in the replicative capacity of osteoblastic cells in the proximal femur of patients with osteonecrosis of the femoral head[J]. J Rheumatol, 2003,30(2):348-351.
[8] Suh KT, Kim SW, Roh HL, et al. Decreased osteogenic differentiation of mesenchymal stem cells in alcohol-induced osteonecrosis[J]. Clin Orthop Relat Res, 2005,431(431):220-225.
[9] Bordone L, Toti P, MeJames AW, et al. Proliferation, osteogenic differentiation, and fgf-2 modulation of posterofrontal/sagittal suture-derived mesenchymal cells in vitro[J]. Plast Reconstr Surg, 2008,122(1):53.
[10] James AW, Xu Y, Wang R, et al. Proliferation, osteogenic differentiation, and fgf-2 modulation of posterofrontal/sagittal suture-derived mesenchymal cells in vitro[J]. Plast Reconstr Surg, 2008,122(1):53-63.
[11] Maegawa N, Kawamura K, Hirose M, et al. Enhancement of osteoblastic differentiation of mesenchymal stromal cells cultured by selective combination of bone morphogenetic protein-2 (BMP-2) and fibroblast growth factor-2 (FGF-2)[J]. J Tissue Eng Regen Med, 2007,1(4):306-313.
[12] Gulati P, Muthuraman A, Jaggi AS, et al. Neuroprotective effect of gadolinium: a stretch-activated calcium channel blocker in mouse model of ischemia-reperfusion injury[J]. Naunyn Schmiedebergs Arch Pharmacol, 2013,386(3):255-264.
[13] Geraghty S, Kuang JQ, Yoo D, et al. A novel, cryopreserved, viable osteochondral allograft designed to augment marrow stimulation for articular cartilage repair[J]. J Orthop Surg Res, 2015,10(1):66.
[14] Marektrzonkowska N, Kwieczyńska A, Reiwergostomska M, et al. Arterial hypertension is characterized by imbalance of pro-angiogenic versus anti-angiogenic factors[J]. PLoS One, 2015,10(5):e0126190.
[15] Kraus TM, Imhoff FB, Reinert J, et al. Stem cells and bFGF in tendon healing: effects of lentiviral gene transfer and long-term follow-up in a rat Achilles tendon defect model[J]. Bmc Musculoskelet Disord, 2016,17(1):1-7.
[16] Zhang JC, Zheng GF, Wu L, et al. Bone marrow mesenchymal stem cells overexpressing human basic fibroblast growth factor increase vasculogenesis in ischemic rats[J]. Braz J Med Biol Res, 2014,47(10):886-94.
[17] 吕波,董文,刘武清.异种脱蛋白松质骨支架在脊柱横突间融合中应用的可行性[J].中国组织工程研究,2015,43(19):6946-6952.
[18] Mohanty SP, Singh KA, Kundangar R, et al. Management of non-traumatic avascular necrosis of the femoral head-a comparative analysis of the outcome of multiple small diameter drilling and core decompression with fibular grafting[J]. Musculoskelet Surg, 2017,101(1):59-66.
[19] Samara S, Kollia P, Dailiana Z, et al. Predictive role of cytokine gene polymorphisms for the development of femoral head osteonecrosis[J]. Dis Markers, 2012,33(4):215-221.
[20] Wu X, Xu W, Feng X, et al. TNF-a mediated inflammatory macrophage polarization contributes to the pathogenesis of steroid-induced osteonecrosis in mice[J]. Int J Immunopathol Pharmacol, 2015,28(3):351-361.
