紫菜多酚对人恶性黑色素瘤细胞A375增殖和诱导凋亡的影响及机制探讨
2018-06-13邱小明石贤爱
邱小明, 李 锋, 石贤爱
(1. 漳州职业技术学院食品与生物工程系, 福建 漳州 363000; 2. 福州大学生物科学与工程学院, 福建 福州 350116)
0 引言
紫菜属于红藻类紫菜属, 其蛋白质含量高(34.48%~37.21%)、 脂肪含量低(0.5%~2.09%)[1], 富含多种氨基酸(35.48%)、 矿物质元素和维生素(VC和β-胡萝卜素)以及膳食纤维, 且多糖和多酚含量高[2-3], 是理想的营养保健食品. 其中紫菜多酚具有抗氧化、 抗菌、 抗肿瘤、 降血脂[4-6]等多种生物活性.
本研究采用不同极性的有机溶剂对紫菜乙醇浸膏进行提取分离, 并通过硅胶柱层析、 高效液相制备色谱等步骤得到紫菜多酚组分, 将其直接作用于人恶性黑色素瘤细胞A375, 并对其抑制肿瘤细胞增殖及诱导凋亡作用机制进行探讨.
1 材料与方法
1.1 材料与试剂
紫菜购自福建漳浦; 人黑色素瘤细胞株A375购自中科院上海细胞研究所; DMEM培养基购自美国Gibco公司; 胎牛血清购自美国Hyclone公司; 胰蛋白酶购自美国Amresco公司; 二甲基亚砜(DMSO), 3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)购自美国Sigma公司; 48~75 μm硅胶购自国药集团化学试剂有限公司; 6孔、 12孔、 96孔细胞培养板、 细胞培养瓶购自美国Costar公司; 庆大霉素(活力单位为4×104U·mL-1)购自山东圣鲁制药有限公司; Annexin-V/PI 细胞凋亡检测试剂盒购自南京凯基生物技术公司; 其它化学试剂均为分析纯, 购于国药集团化学试剂有限公司.
1.2 实验仪器与设备
CO2培养箱(NUAIR 550, 美国Nuaire公司); 流式细胞仪(Coulter Epics XL, 美国Beckman公司); 倒置光学显微镜(IDE2000, 重庆光电仪器有限公司); 荧光全自动酶标仪(SH-1000, 日本Corona公司); 超低温离心机(Z323K, 德国Hermle公司); 自动分布收集器(BS-100A, 上海沪西有限公司); 分析型高效液相色谱(1525 Binary Pump/2996 Photodiode Array Detector, 美国Waters公司); 半制备型高相液相色谱(1525-2998/2414-2707-WFCI, 美国Waters公司 ); 超薄切片机(7650B, 日本日立公司).
1.3 紫菜多酚活性物质的提取与分离
以经干燥粉碎的紫菜粉末为出发物, 经乙醇浸提得到滤液真空浓缩至粘液状, 然后用石油醚萃取得下层水相层, 真空浓缩至浸膏状, 冷冻干燥制得紫菜多酚粗提物A. 采用硅胶柱在乙酸乙酯/甲醇、 甲醇/水体系梯度洗脱条件下对乙醇粗提物A进行梯度洗脱分离, 洗脱流速为0.5床层体积(BV)·h-1, 用30%(体积分数, 以下同)乙酸乙酯/甲醇、 20%乙酸乙酯/甲醇、 10%乙酸乙酯/甲醇洗脱收集(83~122管处)其中的多酚组分, 经浓缩冷冻干燥得紫菜多酚组分B. 再以乙腈和水为流动相, 采用ODS-BP色谱柱对组分B进行分离, 梯度洗脱条件下分离得到组分C、 D1、 D2, 然后再次选择乙腈和含0.1%乙酸的超纯水作为流动相, 进一步对组分C进行分离, 梯度洗脱条件下分离得到组分C1、 C2.
1.4 多酚类物质的测定方法
酚类物质与福林酚试剂在碱性条件下氧化反应生成兰色的钨钼兰复合物, 可用于酚类物质的检测. 根据该方法, 在760 nm波长下测定梯度质量浓度下的没食子酸溶液的吸光值, 得标准曲线方程:y=11.617x-0.010 5, 式中:x为没食子酸终质量浓度(mg·mL-1);y为760 nm波长下测定的吸光值,R2=0.999 2, 线性关系较好.
1.5 细胞培养及MTT法测定组分对A375细胞增殖抑制作用
人皮肤黑色素瘤细胞A375, 用DMEM完全培养基(含10%胎牛血清、 青霉素100 mol·mL-1、 链霉素100 μg·mL-1), 于37 ℃、 5% CO2培养箱中培养, 每2 d传代1次. 取处于对数生长期的细胞培养于96孔板中, 接种密度为104个·孔-1, 待细胞完全贴壁生长后, 加入终质量浓度分别为30.000 0、 15.000 0、 7.500 0、 3.750 0、 1.875 0、 0.937 5 mg·mL-1的紫菜多酚样品, 同时设置对照组, 各组均设6个复孔, 培养48 h. 弃旧培养液, 每孔加入10 μL、 5 mg·mL-1的MTT, 继续37 ℃孵育4 h弃上清液, 每孔加入100 μL DMSO, 37 ℃充分振荡10 min, 于595 nm测定吸光度值, 每组实验重复3次, 计算药物对肿瘤细胞的半数抑制量(IC50). 以白藜芦醇为阳性对照, 并计算出IC50值. 细胞生长抑制率计算公式如下.

1.6 A375细胞形态学观察
实验分为对照组和药物组, 药物组分别取紫菜多酚组分C1的质量浓度为0.75、 1.50、 3.00 mg·mL-1, 作用48 h后倒置显微镜下观察各组细胞的形态变化, 主要从细胞形状、 皱缩程度、 细胞比例、 贴壁情况等多方面做出分析.
1.7 Annexin V-EGFP /PI双染法流式细胞仪检测细胞凋亡
实验分为对照组和待测药物组, A375细胞经紫菜多酚组分C1处理48 h后, 用不含EDTA的胰酶分别消化收集后用PBS洗涤细胞2次, 1 200 r·min-1离心3 min, 收集1~5×105个细胞; 加入500 μL结合缓冲液将收集到的细胞悬浮起来; 加入5 μL Annexin V-EGFP染色剂混匀后, 加入5 μL PI染色剂, 两者混匀; 室温下放置, 避光反应15 min; 用75 μm尼龙网对染色后的细胞进行过滤; 流式细胞仪检测, 计数10 000个细胞, 分析不同染色区域内的细胞比例.
1.8 酪氨酸酶活性的测定[7]
将对数生长期的A375细胞接种于6孔板上, 培养12 h细胞贴壁后, 用终质量浓度为3.000 0、 1.500 0、 0.750 0、 0.375 0、 0.187 5 mg·mL-1紫菜多酚组分C1处理细胞48 h. 然后用PBS洗涤细胞2次, 胰蛋白酶消化贴壁细胞, 1 200 r·min-1离心3 min, 收集细胞. 然后加入1%(质量分数) tritonX-100的PBS溶液90 μL, 迅速置-80 ℃冰箱冷冻30 min. 于室温下融化, 使细胞完全裂解, 37 ℃预温后加入1 mg·mL-1左旋多巴10 μL, 37 ℃反应60 min. 在490 nm测定吸光值. 同步按照节1.4的方法进行MTT法测同样药物处理条件下A375细胞570 nm波长下的吸光值. 计算相对酪氨酸酶活力, 计算公式如下.

1.9 黑色素含量的测定[7]
将对数生长期的A375细胞接种于6孔板上, 培养12 h细胞贴壁后, 用终质量浓度为3.000 0、 1.500 0、 0.750 0、 0.375 0、 0.187 5 mg·mL-1紫菜多酚组分C1处理细胞48 h. 然后用PBS洗涤细胞2次, 胰蛋白酶消化贴壁细胞, 1 200 r·min-1离心3 min, 收集细胞. 加入1 mol·L-1NaOH溶液(含10% (体积分数)DMSO)1 mL, 充分溶解细胞, 室温放置20 min. 波长400 nm测定吸光值, 换算为每106个细胞吸光度.
1.10 细胞超微结构的测定
用质量浓度为0.187 5和1.500 0 mg·mL-1的紫菜多酚组分C1分别处理A375细胞24 h; 然后用胰酶消化A375细胞, 4 ℃, 1 000 r·min-1离心10 min离心收集细胞. 用2.5%(质量分数)戊二醛, 磷酸缓冲液配制固定2 h; 后用PBS漂洗3次, 每次15 min; 再用1%(质量分数)锇酸固定液固定1 h; PBS漂洗3次, 每次15 min. 梯度为30%(体积分数, 以下同)乙醇、 50%乙醇、 70%乙醇、 80%乙醇、 90%乙醇分别脱水8 min, 100%乙醇脱水3次, 每次8 min. 纯乙醇与包埋液体积比为1∶1.5, 室温1 h; 纯乙醇与包埋液体积比1∶3, 室温2 h; 纯树脂浸透过夜; 纯包埋液37 ℃, 4 h. 按如下顺序固定化: 45 ℃烘箱内12 h, 60 ℃烘箱内48 h. 使用超薄切片机, 切为厚度为70 nm的薄片; 2%(质量分数)醋酸铀-枸橼酸铅双染色.
1.11 数据处理
采用Origin软件单因素方差和 Tukey’s检验,P<0.05表明差异具有统计学意义,P<0.01表明差异极具有统计学意义, 结果用x±s表示.
2 结果与分析
2.1 紫菜多酚活性组分的分离纯化
紫菜粉末物在70%(体积分数, 以下同)乙醇溶液、 60 ℃、 浸提1.5 h的条件下提取2次, 得紫菜多酚乙醇粗提物A, 然后采用乙酸乙酯/甲醇、 甲醇/水体系, 通过硅胶柱层析对组分A进一步纯化. 在30%乙酸乙酯/甲醇、 20%乙酸乙酯/甲醇、 10%乙酸乙酯/甲醇部位进行收集(83~122管), 得纯度较高的多酚组分B. 以乙腈和水为流动相, 联合ODS-BP柱和C4柱对组分B再次纯化梯度洗脱条件下得组分C、 D1、 D2.
最后选择流动相乙腈和含0.1%乙酸的超纯水, 对组分C进一步分离, 在梯度洗脱条件得组分C1、 C2. 经HPLC分析, C1、 C2、 D1、 D2为单峰, 为纯度较高组分, 如图1所示.

图1 组分检测色谱图Fig.1 Chromatograms of component
2.2 紫菜多酚组分C1、 C2抗肿瘤活性评价
用不同浓度多酚组分C1、 C2分别处理A375细胞48 h, 以白藜芦醇为阳性对照, 用MTT法检测组分C1、 C2对A375细胞增殖的抑制作用, 结果如图2所示, 组分C1、 C2对A375细胞均表现出一定的生长抑制. 组分C1对人黑色素瘤细胞A375的增殖抑制作用高于组分C2, 其IC50值分别为1.10、 1.58 mg·mL-1, 组分C1对A375细胞作用效果更明显.
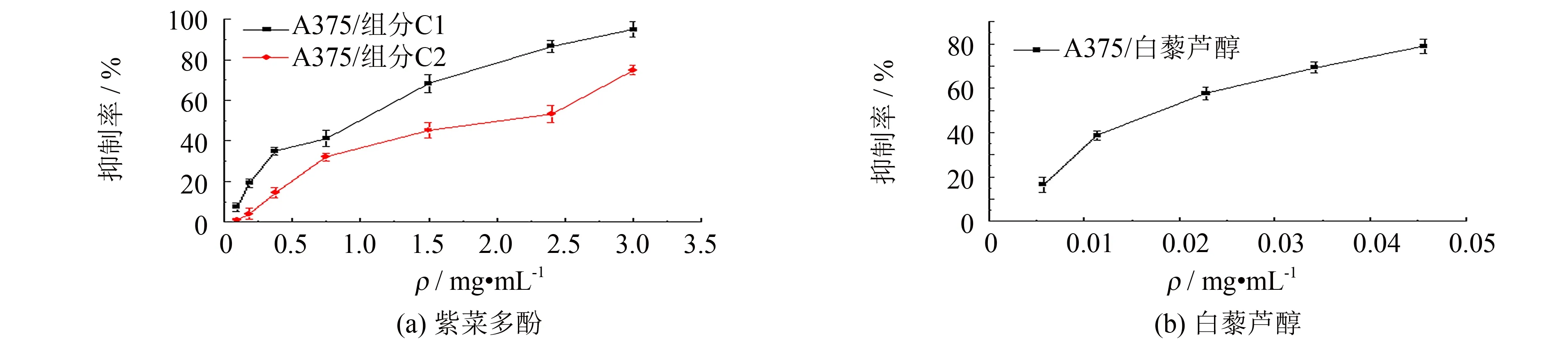
图2 各组分对A375细胞生长的影响Fig.2 Effect of each component on inhibition ratio of A375 cell
2.3 紫菜多酚组分C1对A375细胞形态及增殖的影响
分别用质量浓度为0.75、 1.50、 3.00 mg·mL-1的紫菜多酚组分C1作用于A375细胞48 h, 倒置显微镜下观察细胞的形态变化, 结果如图3所示. 对照组细胞生长迅速, 贴壁状态良好, 光学显微镜下呈梭形. 随着组分C1质量浓度的增加, 细胞形态发生变化, 梭形状细胞逐渐减少, 细胞形态逐渐变圆或固缩, 碎片增多. 当药物质量浓度达到3.00 mg·mL-1时, 在显微镜下可见大量的悬浮细胞, 细胞形态明显皱缩且数目明显减少, 大部分细胞生长受到抑制.

图3 紫菜多酚组分C1对A375形态学的影响Fig.3 Effect of component C1 on morphology of A375
2.4 Annexin V-EGFP/PI双染法检测A375细胞凋亡

图4 不同质量浓度组分C1诱导A375凋亡作用Fig.4 Induced apoptosis treated with different mass concentrations of component C1 upon A375
用Annexin V-EGFP/PI双染方法测定不同浓度紫菜多酚组分C1作用48 h后对A375细胞凋亡的影响, 实验数据如图4所示. 结果表明, 0.5、 1.0、 2.0 mg·mL-1紫菜多酚组细胞凋亡率较空白组分别增加13.8%、 12.3%、 14.6%, 组分C1对A375细胞增殖抑制作用可能是通过诱导A375细胞凋亡途径实现.
2.5 紫菜多酚组分C1对A375细胞增殖抑制作用的机制
黑色素是由黑色素细胞在酪氨酸酶的催化作用下经一系列反应生成, 其中酪氨酸酶是指导黑色素合成和代谢的核心酶[8]. 正常情况下, 在酪氨酸酶的催化作用下, 酪氨酸被羟化生成L-多巴, 并进一步被氧化成多巴醌, 最后多巴醌经一系列复杂的过程生成黑色素, 黑色素含量和酪氨酸酶活力是检测A375细胞分化的重要指标[7]. 因此从酪氨酸活力、 黑色素含量及细胞超微结构等3个指标可以很好地表征A375是否发生细胞分化.
2.5.1 紫菜多酚组分C1对A375相对酪氨酸酶活性的影响
为进一步探索组分C1对A375细胞增殖抑制作用的机制, 本研究用不同质量浓度组分C1处理A375细胞48 h后, 检测A375细胞裂解液中相对酪氨酸酶活力与其质量浓度的关系如图5所示. 当组分C1的质量浓度为3.000 0 mg·mL-1时, 细胞内相对酪氨酸酶活力达到2.98, 是阴性对照组(1.15)的2.61倍, 具有显著的差异性.
2.5.2 紫菜多酚组分C1对A375黑色素含量的影响
黑色素合成能力及酪氨酸酶的活力是反映A375瘤细胞分化能力的重要因素. 本实验采用NaOH裂解细胞, 测定400 nm处的吸光值(OD400 nm), 折算成每106个细胞的OD400 nm值, 间接反映胞内黑色素的含量. 紫菜多酚C1对A375细胞黑色素含量的影响如图6所示, 当组分C1的质量浓度为3.000 0 mg·mL-1时, OD400 nm值(每106个细胞)达到0.239, 是阴性对照组(0.102)的2.34倍, 具有显著的差异性.

图5 组分C1对A375细胞酪氨酸酶活力的影响Fig.5 Effect of component C1 on tyrosine enzyme activity of A375 cell line
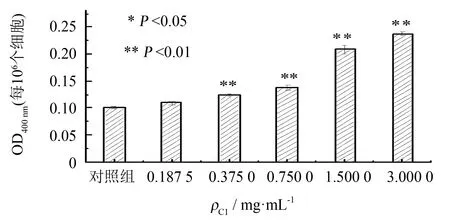
图6 紫菜多酚C1对A375细胞黑色素含量的影响Fig.6 Effect of component C1 on melanin level of A375 cell line
2.5.3 紫菜多酚组分C1对A375细胞超微结构的影响
由节2.5.1和节2.5.2的实验结果可初步判定组分C1具有诱导A375细胞向正常细胞分化的趋势. 黑色素瘤细胞一旦出现分化趋势, 除了黑色素含量和酪氨酸酶活力会发生改变外, 细胞的超微结构也一定会发生相应的变化[9-10]. 本研究用质量浓度为0.187 5、 1.500 0 mg·mL-1的组分C1分别处理A375细胞作为实验组, 不经组分C1处理的细胞正常培养作为对照组, 采用透射电镜进一步观察A375细胞超微结构的变化, 结果如图7所示. 经组分C1处理后, A375细胞核体积明显缩小, 细胞质所占比例增大, 细胞器种类和数目明显增多, 对照组细胞核饱满、 充盈, 细胞器种类单一、 数目稀少. 结果表明随着组分C1质量浓度的增加, 细胞逐渐趋向良性分化, 在一定程度降低了A375细胞的恶性程度.
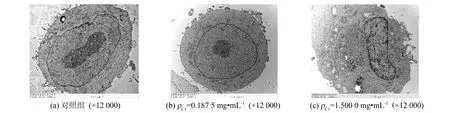
图7 紫菜多酚组分C1对A375细胞超微结构的影响Fig.7 Effect of component C1 on morphology change of A375 cell line
3 结语
多酚类物质抗肿瘤活性的作用机理主要集中在诱导细胞凋亡、 抑制细胞增殖、 诱导正常分化等方面[11-14]. 有研究表明多酚可直接作用杀死肿瘤细胞, 也可通过改变细胞周期发挥阻滞作用, 同时还有通过提高机体免疫能力及抗氧化活性来达到抑制肿瘤生长的作用[15].
本研究以紫菜为原料, 经乙醇浸提、 硅胶树脂柱层析、 联合ODS-BP柱和C4柱高效液相色谱法等分离手段, 得到了一个对A375细胞具有较强抑制活性和诱导凋亡作用的紫菜多酚组分C1. 经细胞形态学观察、 Annexin V-FITC/PI染色流式细胞术分析细胞凋亡等实验确认了C1组分对A375细胞的诱导凋亡作用, 且具有剂量依赖性. 紫菜多酚组分C1可显著提高酪氨酸活力和增加黑色素含量, 透射电镜观察细胞的超微结构变化, 发现其具有诱导A375黑色素瘤细胞凋亡和分化的作用, 从而达到抗肿瘤效果.
参考文献:
[1] 谢程亮, 黄健, 孙彬, 等. 坛紫菜(红藻门、 红毛菜纲)化学成分分析[J]. 中国海洋药物杂志, 2009, 28(1): 29-35.
[2] 吕钟钟, 罗建光, 管华诗. 紫菜的生物活性研究进展[J]. 中国海洋大学学报(自然科学版), 2009, 39(增刊1): 47-51.
[3] OH S, LEE E, CHOE E. Light effects on lipid oxidation, antioxidants, and pigments in dried laver(Porphyra) during storage[J]. Food Science and Biotechnology, 2014 , 23(3): 701-709.
[4] 邓泽元. 食品营养学[M]. 北京: 中国农业出版社, 2009: 299-302.
[5] SHI J, NAWAZ H, POHORLY J,etal. Extraction of polyphenolics from plant material for functional foods-engineering and technology[J]. Food Reviews International, 2005, 21(1): 139-166.
[6] MATKOWSKI A. Plantinvitroculture for the production of antioxidants: a review[J]. Biotechnology Advances, 2008, 26(6): 548-560.
[7] 张荣生, 李峰, 李云磊, 等. 沙蚕活性物质的提取分离及对黑色素瘤细胞A375 的作用机制[J]. 药物生物技术, 2014, 21(5): 402-405.
[8] 杨美花, 石艳, 李智聪, 等. 原儿茶酸对小鼠黑色素瘤B16细胞酪氨酸酶活力及黑色素生成的抑制效应[J]. 厦门大学学报(自然科学版), 2013, 52(6): 842-845.
[9] 段玉清, 刘睿, 谢笔钧. 莲房原花青素对酪氨酸酶活力和黑色素生物合成影响的初步研究[J]. 食品科学, 2004, 25(3): 169-174.
[10] 刘朝圣, 龚坚, 申梦洁. 湘西龙山百合对小鼠B-16黑色素瘤细胞黑色素含量、 酪氨酸酶活性的影响[J]. 湖南中医药大学学报, 2017, 37(2): 145-148.
[11] WALT N B V D, ZAKERI Z, CRONJE M J. The induction of apoptosis in A375 malignant melanoma cells by sutherlandia frutescens[J]. Evidence-based Complementary and Alternative Medicine, 2016, 2016(2):1-14
[12] VAID M, SINGH T, PRASAD R,etal. Silymarin inhibits melanoma cell growth bothinvitroandinvivoby targeting cell cycle regulators, angiogenic biomarkers and induction of apoptosis[J]. Mol Carcinog, 2015, 54(11): 1328-1339.
[13] ZHANG W, TANG B, HUANG Q,etal. Galangin inhibits tumor growth and metastasis of B16F10 melanoma[J]. J Cell Biochem, 2013, 114(1): 152-161.
[14] TRAPP V, PARMAKHTIAR B, PAPAZIAN V,etal. Anti- angiogenic effects of resveratrol mediated by decreased VEGF and increased TSP1 expression in melanoma-endothelial cell co-culture[J]. Angiogenesis, 2010, 13(4): 305-315.
[15] 伊娟娟, 王振宇, 曲航. 植物多酚抗肿瘤活性及其机制研究进展[J]. 食品工业科技, 2016, 37(18): 391-395.
