人源程序性死亡配体PD-L2蛋白的原核表达与抗血清制备
2018-06-13杨娟娟夏菁潞俞博彤
杨娟娟, 刘 照, 夏菁潞, 罗 岭, 俞博彤, 孟 春
(福州大学生物科学与工程学院, 福建 福州 350116)
0 引言
目前, 全球癌症死亡人数占总死亡人数的近六分之一, 加强癌症的筛查和早期诊断是一项具有挑战性的任务. PD-1/PD-Ls信号通路是目前广为研究的抗癌靶点之一[1-3], 可充分利用人体自身的免疫系统抵御、 抗击癌症. 初始T细胞活化离不开抗原肽-MHC复合物与T细胞表面受体(T cell receptor, TCR)的相互作用, 但同时需要抗原递呈细胞表面(antigen-presenting cell, APC)的共刺激分子结合其表面的相应受体提供第二刺激信号. B7家族作为唯一能从APC单向传送信号至T细胞的共刺激分子, 可以调控免疫信号的强度、 持续时间和过程[4]. 程序性死亡受体1(PD-1)与其配体PD-L1/PD-L2是B7家族的重要成员, 可激活细胞内的抑制信号, 诱导T细胞凋亡, 抑制自身免疫应答反应, 从而导致肿瘤细胞的免疫逃逸和自身免疫相关疾病的发生[5].
2001年, Tseng等[6]通过筛选鼠源树突状细胞和巨噬细胞的基因库发现了PD-L2, 并表明该蛋白参与树突状细胞发挥功能的过程. Latchman等[7]报道: PD-L2蛋白是PD-1蛋白的第二个配体分子, 可以显著地抑制T细胞受体介导的CD4+T细胞的增殖和细胞因子的产生; 且PD-L2蛋白在经干扰素γ处理的抗原递呈细胞和正常组织细胞以及肿瘤细胞上的表达量显著上调. 特异性抗体分析实验表明, PD-L2蛋白仅仅表达在树突状细胞和巨噬细胞上; 基于PD-L2蛋白的表达模式, PD-L2蛋白选择性地作用于淋巴器官[6, 8]. 更为引人瞩目的是, 通过Th2细胞可以上调巨噬细胞上PD-L2蛋白的表达[9]. Okazaki等[10]报道PD-1蛋白的胞质尾区的免疫受体基序ITSM与PD-L2蛋白相互作用, 通过招募SHP-1或SHP-2等磷酸酶产生抑制信号, 从而导致下游的TCR或BCR信号效应器去磷酸化, 最终产生负性免疫调控信号. 位于抗原递呈细胞上的PD-L2蛋白还可以抑制T细胞的自体反应, 从而产生免疫耐受; 位于薄壁细胞上的PD-L2蛋白可以通过抑制效应T细胞维持免疫承受能力, 从而保护组织不被破坏[11]. PD-L2的表达量变化是HIV疾病进展的重要生物标志, 阻断PD-1/PD-L2途径可以提高T细胞增殖能力[12-13]; 在寄生虫感染中, 单独阻断PD-L2能减轻巨噬细胞对T细胞的抑制能力[14]; PD-L2的表达量变化与子宫内膜癌的发展进程密切相关[3].
人们不断探究PD-L2蛋白的功能, PD-1/PD-L2信号通路被认为是负性免疫调控分子的关卡[15], 并且发现肿瘤细胞上高表达PD-L2蛋白, 通过PD-L2与T细胞表面受体PD-1分子的结合, 传递负性抑制信号, 躲避CD8+T细胞的杀伤作用, 减弱机体抗肿瘤免疫应答, 造成肿瘤细胞的免疫逃逸. 因此, 人源PD-L2(hPD-L2)作为肿瘤发生、 发展、 转移以及肿瘤预后的重要指标, 可以利用免疫组化技术(IHC)指导肿瘤的诊断和治疗[16]. hPD-L2基因, 定位于9号染色体长臂(9q24.2), cDNA全长约为1.7kb, 且该蛋白是由273个氨基酸残基组成的跨膜蛋白, 包含有位于N端的胞外免疫球蛋白样IgV结构域、 IgC结构域、 跨膜结构域和胞质尾区[17]. 本研究分别选取hPD-L2蛋白的主要抗原表位区IgV Domain(包含20~123位的氨基酸残基, hPD-L220~123)和整个胞外区(包含IgV Domain和IgC Domain, 氨基酸残基包含20~208, hPD-L220~208), 经原核表达和纯化, 制备高滴度、 高特异性的鼠抗人多抗血清.
1 材料和方法
1.1 材料
蛋白表达载体pET-27b, 宿主菌DH-5α和RossetaTM(DE3)感受态细胞均由本实验室保存; hPD-L2的基因(Gene ID: NM_025239.3)由南京金斯瑞公司合成; 分子克隆所使用的上下游引物由生工生物工程(上海)有限公司合成.
1.2 试剂与仪器
分子克隆所使用的TapDNA聚合酶、 2×dNTP、 10×PCR buffer、 限制性内切酶NdeI和XhoI与T4 DNA 连接酶以及蛋白Marker均购自中国Takara公司; 质粒提取与纯化试剂盒、 胶回收试剂盒、 卡那霉素、 尿素、 异丙基-β-D-硫代半乳糖苷(IPTG)以及其他化学试剂均购自生工生物工程(上海)有限公司; 用于LB培养基的胰蛋白胨和酵母提取物购自英国Oxoid公司; 弗式完全佐剂和弗式不完全佐剂购自美国Sigma公司; 免疫组化实验相关试剂、 ELISA相关试剂均由福州迈新生物技术开发有限公司提供. 所使用的仪器有: 高速冷冻离心机(Eppendorf AG, 德国Eppendorf公司); pH计(Orion3 STAR, 美国Thermo Fisher公司); 超净台(SW-CJCO, 苏州净化设备有限公司); 超声波细胞破碎仪(JY92-2D, 宁波新芝生物科技股份有限公司); 紫外-可见分光光度计(752型, 上海第三分析仪器厂); 生物安全柜(上海力康科学仪器公司); 倒置显微镜(XDS-1B, 德国莱卡公司); PCR扩增仪(Eppendorf, 德国Eppendorf公司)和超低温冰箱(美国Thermo Fisher公司).
1.3 方法
1) pET-27b-hPD-L220~123和pET-27b-hPD-L220~208重组质粒的构建. 利用Primer Premier 5.0软件分别设计hPD-L2蛋白的胞外免疫球蛋白样IgV结构域(hPD-L220~123)和整个胞外区结构域(包括免疫球蛋白样IgV结构域和IgC结构域, hPD-L220~208)的引物(见表1). 以hPD-L2的DNA为模板, 利用表1中的引物, 进行聚合酶链式反应(PCR)大量扩增hPD-L220~123的基因片段, 扩增体系为50 μL, PCR的反应条件为: 94 ℃、 5 min, 94 ℃、 30 s, 60.3 ℃、 30 s, 72 ℃、 45 s, 35个循环, 72 ℃、 10 min. 利用相同方法大量扩增hPD-L220~208的基因片段, 扩增体系为50 μL, PCR的反应条件为: 94 ℃、 5 min, 94 ℃、 30 s, 65 ℃、 30 s, 72 ℃、 45 s, 35个循环, 72 ℃、 10 min. 同时利用NdeI和XhoI双酶切上述扩增的hPD-L220~123与hPD-L220~208的基因片段和pET-27b载体, 将二者连接, 转化至DH5α感受态细胞, 挑选单菌落进行PCR鉴定, 将阳性菌落送至测序公司进行测序, 分别将测序结果正确的重组质粒命名为pET-27b-hPD-L220~123和pET-27b-hPD-L220~208. 提取测序结果正确的单菌落重组质粒, 转化至RossetaTM(DE3)感受态细胞进行蛋白的表达与纯化.

表1 构建hPD-L2重组质粒所使用的引物
注: 下划线表示限制性内切酶所对应的碱基序列
2) hPD-L220~123和hPD-L220~208重组蛋白的表达与纯化. 分别挑取含有重组质粒pET-27b-hPD-L220~123和pET-27b-hPD-L220~208的单克隆RossetaTM(DE3)菌落, 接种于10 mL含有50 μg·mL-1卡那抗生素的LB培养基中, 过夜振荡培养(37 ℃, 220 r·min-1), 按照1∶100的体积比接种于1 L含有50 μg·mL-1卡那抗生素的LB培养基中, 于37 ℃和220 r·min-1条件下继续培养2~3 h(OD600 nm约0.9), 加入终浓度为0.5 mmol·L-1的IPTG, 于37 ℃和200 r·min-1条件下诱导5 h. 于4 000 r·min-1、 4 ℃、 离心30 min收集菌体, 利用PBS缓冲液洗涤菌体3次, 然后利用50 mL的PBS缓冲液重悬菌体, 超声破碎, 收集上清, 用30 mL含有8 mol·L-1尿素的PBS缓冲液溶解沉淀, 并利用Ni-NTA柱进行亲和层析纯化. 将Ni-NTA柱亲和层析纯化后的蛋白进行透析复性, 置于复性液(100 mmol·L-1Tris-HCl , pH 8.5, 100 mmol·L-1L-Arginine, 200 mmol·L-1NaCl, 0.2 mmol·L-1GSH, 0.2 mmol·L-1GSSG, 0.099 mmol·L-1NDSB, 4.6 g·L-1glycerol), 于4 ℃条件下复性12 h, 复性后的蛋白于4 ℃、 11 000 r·min-1离心30 min, 收集上清, 浓缩至5 mg·mL-1.
3) 圆二色(CD)谱实验. 在室温下, 利用JASCO J-810圆二色谱仪测定蛋白的远紫外圆二色特征. 分别准备蛋白质量浓度为0.3 mg·mL-1的hPD-L220~123和hPD-L220~208重组蛋白, 样品池的光径为0.1 cm, 设置采样参数: 扫描速率100 nm·min-1, 狭缝宽度2 nm, 采样间隔0.2 nm, 响应时间1 s, 扫描波长260 ~190 nm. 取连续3次扫描的平均值并扣除缓冲液背景的影响.
4) Western-blot法鉴定重组蛋白. 将纯化后的hPD-L220~123和hPD-L220~208重组蛋白经聚丙烯酰胺凝胶电泳(SDS-PAGE)转移至PVDF膜, 加入5%(质量分数) BSA-TBST于37 ℃封闭1 h. 洗膜3次, 每次3 min, 加入从CST购买的兔抗人PD-L2单抗作为一抗于37℃孵育1h. 洗膜后加入HRP标记的羊抗鼠二抗于37 ℃孵育1 h, 洗膜, 利用ECL法检测实验结果.
5) 多抗血清制备及滴度测定. 分别将纯化后的hPD-L220~123和hPD-L220~208重组蛋白利用生理盐水稀释至质量浓度为1 mg·mL-1, 然后与等体积的弗氏完全佐剂混合, 利用乳化器将混合物乳化均匀. 对Balb/c雌性小鼠进行免疫, 首次免疫剂量为100 μg·只-1, 加强免疫两次(时间间隔为14 d, 两个重组蛋白质量浓度为1 mg·mL-1, 样品与弗氏不完全佐剂混匀), 免疫剂量为50 μg·只-1. 免疫前3 d的血清作为空白对照; 第3次免疫10 d后, 断尾取血清, 利用间接ELISA法测定多抗的滴度.
6) 多抗血清的效价测定. 分别以高纯度的质量浓度为5 μg·mL-1的hPD-L220~123和hPD-L220~208重组蛋白作为包被抗原, 每孔包被100 μL、 4 ℃过夜, 同时将Balb/c雌性小鼠免疫前3 d的血清作为阴性对照, 利用间接ELISA法检测经hPD-L220~123和hPD-L220~208重组蛋白免疫的Balb/c雌性小鼠血清中的抗体效价.
7) 多抗血清的特异性检测. 采用常规Western-blot法检测制备的hPD-L220~123和hPD-L220~208重组蛋白的多抗血清的效果, 具体步骤按节1.3的4)进行, 其中一抗为制备的hPD-L220~123和hPD-L220~208重组蛋白的多抗血清(1∶1 000, 摩尔比), 二抗为HRP标记的羊抗鼠抗体.
8) 多抗血清的免疫组化法(IHC)评估与鉴定. 利用hPD-L2蛋白阳性表达的胰腺组织切片进行免疫组化实验, 以hPD-L220~123和hPD-L220~208重组蛋白的免疫血清作为待测一抗, 以CST兔抗人PD-L2单抗作为阳性对照, 以未免疫前对应的Balb/c雌性小鼠的血清作为阴性对照.
2 实验结果
2.1 pET-27b-hPD-L220~123和pET-27b-hPD-L220~208重组质粒的构建

图1 hPD-L220~123和hPD-L220~208对应基因片段的PCR产物的结果图Fig.1 PCR products of hPD-L220-123and hPD-L220-208
以合成的hPD-L2基因为模板, 利用PCR方法成功扩增hPD-L220~123和hPD-L220~208相应的基因片段, 其大小分别为312 bp和567 bp(见图1), 然后将二者分别插入至pET-27b载体获得相应的重组质粒, 最后将经PCR验证和基因测序表明正确的重组质粒pET-27b-hPD-L220~123和pET-27b-hPD-L220~208分别转化至RossetaTM(DE3)感受态细胞进行蛋白的表达与纯化.
2.2 hPD-L220~123和hPD-L220~208重组蛋白的表达、 纯化与鉴定
按照节1.3方法2)对hPD-L220~123和hPD-L220~208重组蛋白进行诱导表达, 可使带有His标签的hPD-L220~123和hPD-L220~208重组蛋白得到很好的表达, SDS-PAGE结果如图2所示. 相应融合蛋白的相对分子质量分别约为14和27 ku(见图2(a)泳道2和图2(b)泳道2), 与理论相对分子质量相符. 将上述两个重组蛋白的菌体进行超声破碎, 分别取上清与沉淀进行SDS-PAGE鉴定, 发现在菌体裂解液上清中均未检测到融合蛋白表达(见图2(a)泳道3和图2(b)泳道3), 而只在重组菌体的沉淀中检测到重组蛋白表达(见图2(a)泳道4和图2(b)泳道4), 说明hPD-L220~123和hPD-L220~208重组蛋白是以包涵体的形式表达的. 将hPD-L220~123和hPD-L220~208重组蛋白的包涵体经8 mol·L-1脲溶解变性, 0.45 μm的滤膜过滤, 利用Ni-NTA柱亲和层析法纯化, 经复性液复性可获得纯度达到95%左右的融合蛋白(见图2(a)泳道5和图2(b)泳道5).
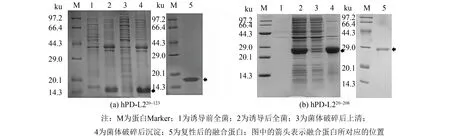
图2 hPD-L220~123蛋白和hPD-L220~208蛋白表达与纯化的SDS-PAGE结果图Fig.2 SDS-PAGE gel analysis of expression and purification of hPD-L220-123and hPD-L220-208
为了验证复性后的hPD-L220~123和hPD-L220~208重组蛋白的折叠情况, 对纯化后这两个重组蛋白进行CD实验. hPD-L220~123重组蛋白的远紫外CD谱图显示: 在195 nm有一个明显的正峰, 而在215 nm有一个明显的负峰, 且二级结构的含量分别为6.6%的α-helix、 60.4%的β-sheet以及33%的coil(见图3(a)). hPD-L220~208重组蛋白的远紫外CD谱图显示: 在195 nm有一个明显的正峰, 而在216 nm有一个明显的负峰, 且二级结构的含量分别为17.1%的α-helix、 58.1%的β-sheet以及24.8%的coil(见图3(b)). 上述CD实验结果表明, 经复性后的hPD-L220~123和hPD-L220~208重组蛋白折叠较好, 二级结构均以β-sheet折叠为主, 可进行后续制备多抗血清实验.

图3 hPD-L220~123蛋白和hPD-L220~208蛋白的CD谱图Fig.3 Analysis of purified hPD-L220-123and hPD-L220-208 by far UV CD spectrometry
利用从CST购买的兔抗人PD-L2单抗对纯化的hPD-L220~123和hPD-L220~208重组蛋白进行Western-blot鉴定, 结果如图4所示. 图4表明: 分别位于14和27 ku处的纯化hPD-L220~123和hPD-L220~208重组蛋白与兔抗人的PD-L2抗体有特异性反应(见图4 泳道1和图4 泳道3), 与预期的结果一致; 而阴性对照, 即转入pET-27b空载体的菌株, 在IPTG诱导后, 无任何特异性条带出现(见图4 泳道2和图4 泳道4). Western-blot鉴定实验结果表明, 本研究所表达与纯化的hPD-L220~123和hPD-L220~208重组蛋白具有较好的免疫原性, 可进行后续的制备多抗血清实验.

图4 hPD-L220~123and hPD-L220~208的Western-blot鉴定结果图Fig.4 Western blotting analysis of hPD-L220-123and hPD-L220-208
2.3 hPD-L220~123和hPD-L220~208重组蛋白的多抗血清的制备、 滴度测定与效价测定
按照节1.3方法5)制备鼠抗人的hPD-L220~123和hPD-L220~208重组蛋白的多抗血清, 采用断尾取血的方式对3次免疫后的Balb/c雌性小鼠进行取血, 将取得的血于室温静置30~60 min, 8 000 r·min-1、 4 ℃离心10 min, 移取上清即为免疫后的血清. 将第一次免疫前3 d取的小鼠血清作为阴性对照, PBS作为空白对照. 分别包被5 μg·mL-1的hPD-L220~123和hPD-L220~208重组蛋白, 利用间接ELISA法测定抗体滴度与效价, 列于表2. 由表2可知, 制备的鼠抗人的hPD-L220~123和hPD-L220~208重组蛋白的多抗血清中抗体效价均高于106, 表明制备的多抗均获得足够的抗体滴度和亲和力.

表2 hPD-L220~123and hPD-L220~208重组蛋白的免疫血清滴度
注: OVER为吸光值较大, 不在测量显示范围内
2.4 hPD-L220~123和hPD-L220~208重组蛋白的多抗血清的特异性检测

图5 Western-blot法鉴定多抗血清Fig.5 Western blotting analysis of multiple antiserum
图5为Western-blot法鉴定多抗血清的结果. 利用从Sino Biological 公司购买的hPD-L2蛋白为检测抗原, 将从CST购买的兔抗人PD-L2抗体作为阳性对照(见图5泳道1), 以未免疫的Balb/c雌性小鼠血清作为阴性对照(见图5泳道2), 采用Western-Blot方法对制备的hPD-L220~123和hPD-L220~208重组蛋白的多抗血清的特异性进行检测. Western-Blot结果显示: 所制备的多抗血清与购买的hPD-L2蛋白的单抗均在hPD-L2蛋白相应的位置出现了特异性反应条带(见图5泳道3和4), 而阴性对照则在hPD-L2蛋白相应位置无特异性反应条带. 该实验结果表明: hPD-L220~123和hPD-L220~208重组蛋白作为免疫原所制备的多抗血清能够特异性地识别hPD-L2蛋白.
2.5 hPD-L220~123和hPD-L220~208重组蛋白的多抗血清的IHC评估与鉴定
选用hPD-L2蛋白大量表达的胰腺组织切片进行实验, 利用IHC法对制备的hPD-L220~123和hPD-L220~208重组蛋白的多抗(稀释1 500倍作为待测一抗)进行评估与鉴定, 以从CST购买的兔抗人PD-L2单抗作为阳性对照, 以未免疫的Balb/c雌性小鼠血清作为阴性对照. 免疫组化的阳性结果呈棕色显示, 且PD-L2阳性结果应准确定位于细胞膜上, 分析结果见图6. 作为阳性对照的兔抗人PD-L2单抗在hPD-L2蛋白阳性表达的胰腺组织切片的细胞膜定位较清晰、 准确, 且无非特异性着色(见图6(a)). 作为阴性对照的未免疫Balb/c雌性小鼠血清在hPD-L2蛋白阳性表达的胰腺组织切片上无细胞膜定位(见图6(b)). 与阴性对照相比, hPD-L220~123蛋白3次免疫后的多抗血清在hPD-L2蛋白阳性表达的胰腺组织切片上具有阳性染色, 但是与阳性对照相比, 染色较弱, 且膜定位不明显(见图6(c)). hPD-L220~208蛋白3次免疫后的多抗血清在hPD-L2蛋白阳性表达的胰腺组织切片上具有较为明显的阳性染色结果, 且膜定位较为清晰与准确, 与阳性对照的结果较为一致(见图6(d)).

图6 多抗血清的免疫组化分析Fig.6 Immunohistochemistry assay of multiple antiserum
3 结语
hPD-L2在多种恶性肿瘤, 如肺癌、 肝癌、 食管癌、 胰腺癌、 子宫颈癌和卵巢癌细胞中呈异常表达[18-20], 因此, 可采用IHC的方法对组织或细胞中的PD-L2蛋白进行定量检测和精确定位, 以此指导肿瘤的诊断、 治疗以及准确评价肿瘤预后疗效. 本研究大量制备了hPD-L220~123和hPD-L220~208的重组蛋白, 经Ni-NTA柱纯化和复性后, 重组蛋白的纯度均达到了95%以上. CD实验结果表明, 制备的hPD-L220~123和hPD-L220~208重组蛋白经包涵体变复性后空间折叠较好, 且以β-sheet折叠的二级结构为主. Western-blot实验结果表明制备的hPD-L220~123和hPD-L220~208重组蛋白经包涵体变复性后具有较好的免疫原性, 因此恢复了较好的生物学功能. 重组蛋白hPD-L220~123和hPD-L220~208作为免疫原免疫Balb/c雌性小鼠制备鼠抗人的多抗血清, 经间接ELISA法检测其效价均达到1∶106, 表明多抗血清均具有良好的滴度, 且在Western-blot应用中具有较强的特异性和敏感性. 但IHC实验的评估与鉴定结果表明: hPD-L220~208重组蛋白作为免疫原制备的多抗血清具有明显的阳性染色结果, 且膜定位较为清晰与准确; 而hPD-L220~123重组蛋白作为免疫原制备的多抗血清阳性染色较弱且定位模糊. 因此, 只有制备包含有胞外免疫球蛋白样IgV结构域和IgC结构域的PD-L2重组蛋白作为抗原制备的抗体, 才能获得较为准确的临床诊断结果. 该研究结果不仅为hPD-L2蛋白的功能研究提供有用的抗体试剂, 也为建立快速、 高效的肿瘤诊断方法奠定一定的基础.
参考文献:
[1]OHAEGBULAM K C, ASSAL A, LAZAR-MOLNAR E,etal. Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J]. Trends in Molecular Medicine, 2015, 21(1): 24-33.
[2] JI M, LIU Y, LI Q,etal. PD-1/PD-L1 pathway in non-small-cell lung cancer and its relation with EGFR mutation[J]. Journal of Translational Medicine, 2015, 13(1): 5.
[3] MO Z F, LIU J, ZHANG Q Y,etal. Expression of PD-1, PD-L1 and PD-L2 is associated with differentiation status and histological type of endometrial cancer[J]. Oncology Letters, 2016, 12(2): 944-950.
[4] PARDOLL D M. Spinning molecular immunology into successful immunotherapy[J]. Nature Reviews Immunology, 2002, 2(4): 227-238.
[5] RITPRAJAK P, AZUMA M. Intrinsic and extrinsic control of expression of the immunoregulatory molecule PD-L1 in epithelial cells and squamous cell carcinoma[J]. Oral Oncology, 2015, 51(3): 221-228.
[6] TSENG S Y, OTSUJI M, GORSKI K,etal. B7-DC, a new dendritic cell molecule with potent costimulatory properties for T cells[J]. The Journal of Experimental Medicine. 2001, 193(7): 839-846.
[7] LATCHMAN Y, WOOD C R, CHEMOVA T,etal. PD-L2 is a second ligand for PD-1 and inhibits T cell activation[J]. Nature Immunology, 2001, 2(3): 261-268.
[8] SHIN T, KENNEDY G, GORSKI K,etal. Cooperative B7-1/2 (CD80/CD86) and B7-DC costimulation of CD4+T cells independent of the PD-1 receptor[J]. The Journal of Experimental Medicine, 2003, 198(1): 31-38.
[9] LOKE P, ALLISON J P. PD-L1 and PD-L2 are differentially regulated by Th1 and Th2 cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(9): 5336-5341.
[10] OKAZAKI T, MAEDA A, NISHIMURA H,etal. PD-1 immunoreceptor inhibits B cell receptor-mediated signaling by recruiting src homology 2-domain-containing tyrosine phosphatase 2 to phosphotyrosine[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(24): 13866-13871.
[11] OKAZAKI T, HONJO T. The PD-1-PD-L pathway in immunological tolerance[J]. Trends in Immunology, 2006, 27(4): 195-201.
[12] SALISCH N C, KAUFMANN D E, AWAD A S,etal. Inhibitory TCR coreceptor PD-1 is a sensitive indicator of low-level replication of SIV and HIV-1[J]. The Journal of Immunology, 2010, 184(1): 476-487.
[13] RODRãGUEZ-GARCãA M, PORICHIS F, DE JONG O G,etal. Expression of PD-L1 and PD-L2 on human macrophages is up-regulated by HIV-1 and differentially modulated by IL-10[J]. Journal of Leukocyte Biology, 2011, 89(4): 507-515.
[14] LIANG S C, GREENWALD R J, LATCHMAN Y E,etal. PD-L1 and PD-L2 have distinct roles in regulating host immunity to cutaneous leishmaniasis[J]. Eur J Immunol, 2006, 36(1): 58-64.
[15] DONG Y, SUN Q, ZHANG X. PD-1 and its ligands are important immune checkpoints in cancer[J]. Oncotarget, 2017, 8(2): 2171-2186.
[16] 王小亚, 林齐心, 李妙君, 等. 表达Ki-67的CHO细胞用于制备免疫组织化学细胞质量控制片[J]. 中华病理学杂志, 2014, 43(3): 189-191.
[17] 曹旭东, 孔令洪, 王一理. B7家族新成员[J]. 细胞与分子免疫学杂志, 2003, 19(4): 312-417.
[18] WOLCHOK J D, KLUGER H, CALLAHAN M K,etal. Nivolumab plus ipilimumab in advanced melanoma[J]. The New England Journal of Medicine, 2013, 369(2): 122-133.
[19] KARIM R, JORDANOVA E S, PIERSMA S J,etal. Tumor-expressed B7-H1 and B7-DC in relation to PD-1+ T-cell infiltration and survival of patients with cervical carcinoma[J]. Clinical Cancer Research, 2009, 15(20): 6341-6347.
[20] ROZALI E N, HATO S V, ROBINSON B W,etal. Programmed death ligand 2 in cancer-induced immune suppression[J]. Clinical & Developmental Immunology, 2015, 2012(2): 656340.
