含氟茂铁吡唑类衍生物的合成及燃速催化性能的研究
2018-06-13袁耀锋杨思涵王吉成
袁耀锋 , 杨思涵, 王吉成, 林 芬
(1. 福州大学化学学院, 福建 福州 350116; 2. 福州大学测试中心, 福建 福州 350116)
0 引言
二茂铁衍生物是一类高效的燃速催化剂, 在火箭燃料等领域有着广泛的应用[1-2]. 正丁基二茂铁(NBF)、 叔丁基二茂铁(TBF)等就曾作为广泛应用的燃速催化剂[3], 但这些茂铁衍生物均存在易挥发、 易迁移的缺陷. 要降低或解决此类缺陷, 必须考虑降低二茂铁衍生物的挥发、 迁移性, 要设法加强它与推进剂各组分之间的相互作用, 即增加分子间范德华力. 从分子设计的角度看, 为了降低迁移率和挥发性, 常见的办法有: 引入极性基团(如: 羟基和酯基等[4]), 引入氮原子或氮杂环[5-6], 或在引入氮元素的基础上进一步与过渡金属配位[7-12]. 其中, 大量研究结果表明, 含杂原子和杂环的二茂铁衍生物因其富电子效应及对化合物极性的改善, 与传统的含能材料相比, 其性能优异、 独特并具有可调控性[13-14], 是新型化学推进剂的研究热点之一. 因此, 设计合成含氮杂环的茂铁衍生物对于燃速催化研究具有重要意义. 本研究在二茂铁单元中引入了含氮的吡唑环, 并引入含氟基团, 以期获得催化、 挥发迁移等各项性能优异的燃速催化剂.
1 材料与方法
1.1 合成路线
5种3-二茂铁基-5-芳基-1-苯甲酰基吡唑啉的合成路线, 如图1所示.
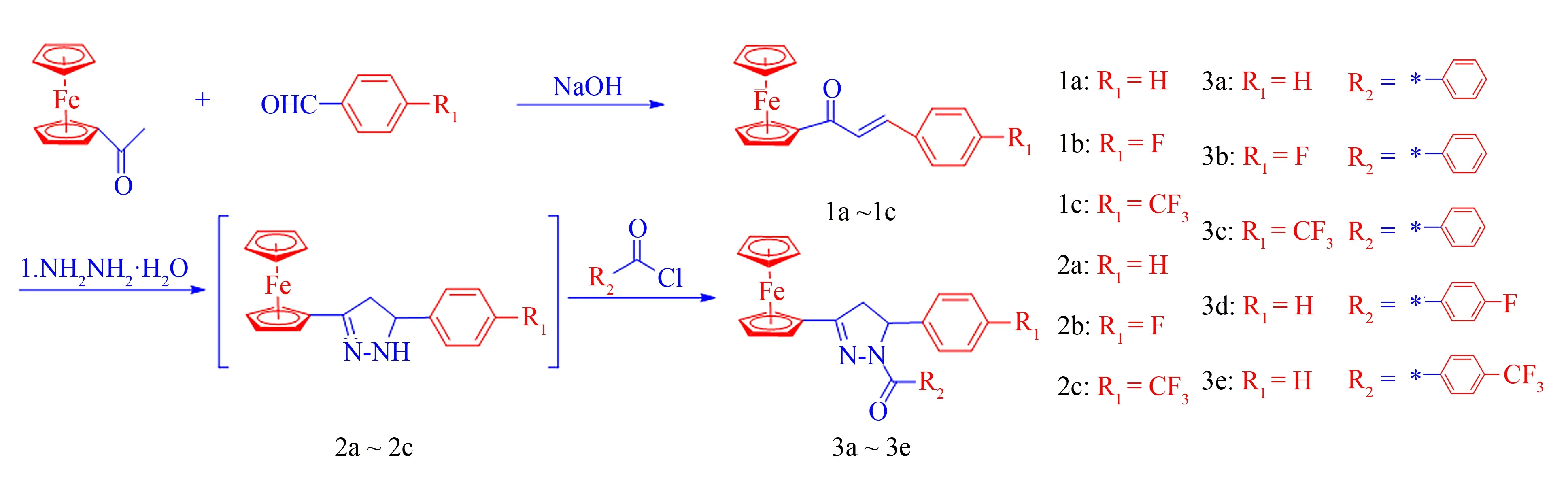
图1 含氟茂铁吡唑类衍生物的合成路线Fig.1 Synthetic route of the 3-ferrocenyl-5-aryl-1-substituted benzoyl pyrazolines
1.2 主要仪器和试剂
熔点仪(WRS-1B, 上海申光公司); 核磁共振仪(AVANCE III 400M, 瑞士Bruker公司), 400 MHz, TMS为内标; 红外光谱仪(Spectrum 2000 FTIR, 美国Perkin Elmer公司); 质谱仪(Thermo-Finnigan ion-trap LCQ, 德国Thermo Finnigan公司); 高分辨质谱仪(Agilent LCQ-TOF-MS 6520, 美国Agilent公司); 紫外光谱仪(Perkin Elmer Lambda 750, 美国Perkin Elmer公司); 电化学工作站(CHI620C, 上海辰华公司); 差示扫描量热/热重分析同步热分仪(STA 449C, 德国Netzsch公司). 试剂均为分析纯. 紫外光谱实验试剂为光谱纯, 所有反应使用的溶剂使用前都按照标准化方法[15]纯化后再使用. 电化学测试中使用的四正丁基六氟磷酸铵以乙醇重结晶后使用.
1.3 合成实验
1.3.1 1-二茂铁基-3-芳基-α, β-不饱和酮(1a~1c)的合成
参考文献[16]合成. 取100 mL三口烧瓶, N2保护下, 加入10 mmol相应的芳香醛, 2.28 g(10 mmol)乙酰基二茂铁, 2.00 g (50 mmol)NaOH和20 mL无水乙醇. 40 ℃下不断搅拌, TLC监测反应结束(约30 min), 冷却至室温, 依次抽滤、 水洗、 干燥、 乙醇重结晶, 干燥得紫红色固体1-二茂铁基-3-取代苯基-α, β-不饱和酮(1a~1c).
1-二茂铁基-3-苯基-α, β-不饱和酮(1a): 紫红色固体2.72 g, 产率为86%, 熔点为135~137 ℃(与文献[16]一致). 1-二茂铁基-5-(4-氟苯基)-α, β-不饱和酮(1b): 紫红色固体2.84 g, 产率为85%, 熔点为148~149 ℃. 1-二茂铁基-5-(4-三氟甲基苯基)-α, β-不饱和酮(1c): 紫红色固体3.00 g, 产率为78%, 熔点为177~178 ℃.
1.3.2 3-二茂铁基-5-芳基-1-(取代)苯甲酰基吡唑啉衍生物(3a~3e)的合成
N2保护下, 加入3.0 mmol 3-二茂铁基-5-取代苯基-α, β-不饱和酮化合物(1a~1c), 1 mL 98%(质量分数)的水合肼(20 mmol), 20 mL乙醇. 加热回流, TLC监测反应(约30 min), 冷却至室温, 减压除去过量的水合肼和乙醇, 得黄褐色稠状物(2a~2c). CH2Cl2溶解, 转移至三口烧瓶中, N2保护下, 恒压滴液漏斗缓慢滴入溶有相应酰氯(3.5 mmol)的CH2Cl2溶液, 室温下搅拌(约10 min). TLC监测反应结束后, 抽滤取下层滤液, 依次用饱和Na2CO3溶液、 饱和NaCl溶液各洗涤2~3次, 无水Na2SO4干燥, 过滤, 浓缩, 旋蒸得粗产物. 硅胶柱分离, 以PE∶DCM=1∶2(体积比)为洗脱剂, 收集黄色带得3-二茂铁基-5-苯基-1-(取代)苯甲酰基吡唑啉衍生物(3a~3e).
3-二茂铁基-5-苯基-1-苯甲酰基吡唑啉(3a): 橙黄色固体0.610 0 g, 产率为47%, 熔点为144~145 ℃. 3-二茂铁基-5-(4-氟苯基)-1-苯甲酰基吡唑啉(3b): 橙黄色固体0.590 0 g, 产率为44%, 熔点为108~111 ℃. 3-二茂铁基-5-(4-三氟甲基苯基)-1-苯甲酰基吡唑啉(3c): 橙黄色固体0.590 0 g, 产率为39%, 熔点为136~137 ℃. 3-二茂铁基-5-苯基-1-(4-氟)苯甲酰基吡唑啉(3d): 橙黄色固体0.569 6 g, 产率为42%, 熔点为119~120 ℃. 3-二茂铁基-5-苯基-1-(4-三氟甲基)苯甲酰基吡唑啉(3e): 橙黄色固体0.617 5 g, 产率为41%, 熔点为138~139 ℃.
1.4 紫外可见测试
配置浓度为1.0×10-5mol·L-1化合物3a~3e的乙腈溶液, 选取大小为1.0 cm×1.0 cm×4.0 cm的比色皿, 3.0 mL纯乙腈作为背景, 在250~600 nm范围内测量UV-vis吸收光谱.
1.5 电化学性能测试
利用CHI620C电化学工作站测试化合物3a~3e的电化学性能. 室温下, 以0.1 mol·L-1的TBAF作为支持电解质, CH3CN为溶剂, 配置浓度为1.0×10-3mol·L-1目标化合物的乙腈溶液. 以二茂铁作为内标进行校正. 按照IUPAC的建议[17], 用CV和DPV两种电化学分析方法研究目标化合物3a~3e的电化学性质.
1.6 燃速催化性能测试
以DSC及TG两种热分析方法研究所制备的3-二茂铁基-5-苯基-1-苯甲酰基吡唑啉衍生物3a~3e对常用火箭推进氧化剂AP的催化热分解性能, 相关实验在TG/DSC型同步热分析仪上完成. 测试中用Ar保护, 升温速率为10 ℃·min-1, 数据采集温度范围为25~500 ℃, 样品质量为5.00~10.00 mg, 吡唑啉衍生物的添加量为5 %(质量分数).
2 结果与讨论
2.1 目标化合物的合成及结构表征
以乙酰基二茂铁和取代苯甲醛为原料, 利用羟醛缩合反应制备3种含二茂铁基的α, β-不饱和酮. 然后将其与水合肼缩合成环合成吡唑啉, 再与相应酰氯反应, 引入具备强吸电子能力的含氟基团. 合成5种3-二茂铁基-5-苯基-1-苯甲酰基吡唑啉(3a~3e), 并运用IR、 MS、 NMR及HRMS对化合物结构进行表征.
2.1.1 新化合物1b和1c的结构表征
化合物3-二茂铁基-5-(4-氟苯基)-α, β-不饱和酮(1b)表征数据如下: 紫红色固体, 熔点 148~149 ℃.1H NMR(400 MHz, CDCl3):δ值分别为7.78(d,J=15.6 Hz, 1H, —CO=CH—), 7.68(t,J=6.4 Hz, 2H, Ph—H), 7.15(t,J=8.4 Hz, 2H, Ph—H), 7.08(d,J=15.6 Hz, 1H, —CH—Cp), 4.94(s, 2H, Cp—H), 4.63(s, 2H, Cp—H), 4.25(s, 5H, Cp—H);19F NMR(376 MHz, CDCl3):δ值为-109.83(s, Ph—F).
3-二茂铁基-5-(4-三氟甲基苯基)-α, β-不饱和酮(1c)表征数据如下: 紫红色固体, 熔点 177~178 ℃.1H NMR(400 MHz, CDCl3):δ值分别为7.82(d,J=15.56 Hz, 1H, —CO=CH—), 7.77(d,J=8.4 Hz, 2H, Ph—H), 7.71(d,J=8.4 Hz, 2H, Ph—H), 7.19(d,J=15.6 Hz, 1H, —CH—CP), 4.95(t,J=2.0 Hz, 2H, Cp—H), 4.65(t,J=2.0 Hz, 2H, Cp—H), 4.25(s, 5H, Cp—H);19F NMR(376 MHz, CDCl3):δ值为 -62.79(s, Ph—CF3).
2.1.2 新化合物3-二茂铁基-5-苯基-1-(取代)苯甲酰基吡唑啉衍生物(3a~3e)的结构表征
3-二茂铁基-5-苯基-1-苯甲酰基吡唑啉(3a)的表征数据如下: 橙黄色固体, 熔点 144~145 ℃.1H NMR(400 MHz, CDCl3):δ值分别为8.06(d,J=6.4 Hz, 2H, Ph—H), 7.44~7.51(m, 3H, Ph—H), 7.36~7.41(m, 4H, Ph—H), 7.30~7.31(m, 1H, Ph—H), 5.82(d,J=11.2 Hz, 1H, Pz—H), 4.70(s, 1H, Cp—H), 4.57(s, 1H, Cp—H), 4.42(s, 2H, Cp—H), 4.14(s, 5H, Cp—H), 3.72(dd,J1=17.2 Hz,J2=11.2 Hz, 1H, Pz—H), 3.05(dd,J1=17.2 Hz,J2=4.4 Hz, 1H, Pz—H);13C NMR(101 MHz, CDCl3):δ值分别为165.5(C=O), 156.8(Pz—C), 142.0(Ph—C), 134.5(Ph—C), 130.8(Ph—C), 130.3(Ph—C), 129.0(Ph—C), 127.6(Ph—C), 127.5(Ph—C), 125.4(Ph—C), 75.3(Cp—C), 70.5(Cp—C), 70.4(Cp—C), 69.4(Cp—C), 67.9(Cp—C), 67.4(Cp—C), 60.7(Pz—C), 43.0(Pz—C); IR(KBr ,σ/cm-1): 3 114, 3 059, 1 632, 1 597, 1 411; HRMS(ESI)m/z: [M+H]+calcd for 435.116 0; found 435.114 8.
3-二茂铁基-5-(4-氟苯基)-1-苯甲酰基吡唑啉(3b)表征数据如下: 橙黄色固体, 熔点 108~111 ℃.1H NMR(400 MHz, CDCl3):δ值分别为8.04(d,J=4.2 Hz, 2H, Ph—H), 7.43~7.53(m, 3H, Ph—H), 7.34(s, 2H, Ph—H), 7.08(t,J=8.0 Hz, 2H, Ph—H), 5.80( s, 1H, Pz—H), 4.72(s, 1H, Cp—H), 4.62(s, 1H, Cp—H), 4.46(s, 2H, Cp—H), 4.18(s, 5H, Cp—H), 3.69(s, 1H, Pz—H), 3.01(d,J=14.0 Hz, 1H, Pz—H);19F NMR(376 MHz, CDCl3):δ值为-114.78(s, Ph—F);13C NMR(101 MHz, CDCl3)δ值分别为165.5(C=O), 162.2(J=246.8 Hz, C—F), 156.8(Pz—C), 137.8(J=3.2 Hz, Ph—C), 134.3(Ph—C), 131.0(Ph—C), 130.3(Ph—C), 127.6(Ph—C), 127.2(J=8.2 Hz, Ph—C), 115.9(J=21.7 Hz, Ph—C), 75.2(Cp—C), 70.6(Cp—C), 70.5(Cp—C), 70.0(Cp—C), 69.4(Cp—C), 67.9(Cp—C), 67.4(Cp—C), 60.1(Pz—C), 42.9(Pz—C); IR(KBr,σ/cm-1): 3 082, 2 926, 1 630, 1 600, 697; HRMS(ESI)m/z: [M+H]+calcd for 453.106 6; found 453.105 2.
3-二茂铁基-5-(4-三氟甲基苯基)-1-苯甲酰基吡唑啉(3c)表征数据如下: 橙黄色固体, 熔点 136~137 ℃.1H NMR(400 MHz, CDCl3):δ值分别为8.06(d,J=6.0 Hz, 2H, Ph—H), 7.66(d,J=8.0 Hz, 2H, Ph—H), 7.45~7.54(m, 5H, Ph—H), 5.85(d,J=8.4 Hz, 1H, Pz—H), 4.71(s, 1H, Cp—H), 4.64(s, 1H, Cp—H), 4.47(s, 2H, Cp—H), 4.19(s, 5H, Cp—H), 3.75(dd,J1=17.6Hz,J2=12.0 Hz, 1H, Pz—H), 3.02(d,J=16.4 Hz, 1H, Pz—H);19F NMR(376 MHz, CDCl3):δ值为-62.51(s, Ph—F);13C NMR(101 MHz, CDCl3)δ值分别为165.6(C=O), 156.8(Pz—C), 146.0(Ph—C), 134.0(Ph—C), 131.1(Ph—C), 130.3(Ph—C), 129.9(J=32.7 Hz, Ph—C), 127.7(Ph—C), 126.1(J=3.7 Hz, Ph—C), 125.9(Ph—C), 124.1(J=273.1 Hz, —CF3), 74.9(Cp—C), 70.7(Cp—C), 70.6(Cp—C), 70.1(Cp—C), 69.5(Cp—C), 67.8(Cp—C), 67.5(Cp—C), 60.4(Pz—C), 42.7(Pz—C); IR(KBr,σ/ cm-1): 3 095, 2 923, 1 622, 1 105, 704; HRMS(ESI)m/z: [M+H]+calcd for 503.103 4; found 503.101 9.
3-二茂铁基-5-苯基-1-(4-氟)苯甲酰基吡唑啉(3d)表征数据如下: 橙黄色固体, 熔点 119~120 ℃.1H NMR(400 MHz, CDCl3):δ值分别为8.12(t,J=5.6 Hz, 2H, Ph—H), 7.30~7.41(m, 5H, Ph—H), 7.13(t,J=8.4 Hz, 2H, Ph—H), 5.80(d, 2H,J=11.6 Hz, Pz—H), 4.72(s, 1H, Cp—H), 4.59(s, 1H, Cp—H), 4.45(s, 2H, Cp—H), 4.16(s, 5H, Cp—H), 3.71(dd,J1=17.2 Hz,J2=11.6 Hz, 1H, Pz—H), 3.02(dd,J1=17.2 Hz, J2=4.4 Hz, 1H, Pz—H);19F NMR(376 MHz, CDCl3):δ值为-109.05(s, Ph—F);13C NMR(101 MHz, CDCl3)δ值分别为164.3(J=252.1 Hz, C—F), 164.2(C=O), 157.2(Pz—C), 141.9(Ph—C), 132.8(J=8.5 Hz, Ph—C), 130.6(J=2.2 Hz, Ph—C), 129.0(Ph—C), 127.8(Ph—C), 125.4(Ph—C), 114.6(J=21.6 Hz, Ph—C), 75.21(Cp—C), 70.7(Cp—C), 70.5(Cp—C), 69.5(Cp—C), 68.0(Cp—C), 67.3(Cp—C), 60.8(Pz—C), 43.0(Pz—C). IR(KBr,σ/cm-1): 3 101, 3 063, 1 626, 1 489, 1 424, 710; HRMS(ESI)m/z: [M+H]+calcd for 453.106 6; found 453.104 8.
3-二茂铁基-5-苯基-1-(4-三氟甲基)苯甲酰基吡唑啉(3e)表征数据如下: 橙黄色固体, 熔点 138~139 ℃.1H NMR(400 MHz, CDCl3):δ值分别为8.14(d,J=8.0 Hz, 2H, Ph—H), 7.72(d,J=8.0 Hz, 2H, Ph—H), 7.30~7.43(m, 5H, Ph—H), 5.81(d, 2H,J=9.6 Hz, Pz—H), 4.69(s, 1H, Cp—H), 4.58(s, 1H, Cp—H), 4.45(s, 2H, Cp—H), 4.16(s, 5H, Cp—H), 3.73(dd,J1=17.2 Hz,J2=10.8 Hz, 1H, Pz—H), 3.02(d,J=17.2 Hz, 1H, Pz—H);19F NMR(376 MHz, CDCl3):δ值为-62.85(s, Ph—F);13C NMR(101 MHz, CDCl3)δ值分别为164.1(C=O), 157.9(Pz—C), 141.6(Ph—C), 137.8.0(Ph—C), 132.3(J=32.5 Hz, Ph—C), 130.6(Ph—C), 129.1(Ph—C), 127.9(Ph—C), 125.4(Ph—C), 124.6(J=3.6 Hz, Ph—C), 124.0(J=273.6 Hz, —CF3), 74.9(Cp—C), 70.7(Cp—C), 70.6(Cp—C), 69.5(Cp—C), 68.0(Cp—C), 67.4(Cp—C), 60.8(Pz—C), 43.1(Pz—C); IR(KBr,σ/cm-1): 3 088, 2 923, 1 635, 1 508, 1 322; HRMS(ESI)m/z: [M+H]+calcd for 503.103 4; found 503.101 9.
2.1.3 新化合物3-二茂铁基-5-苯基-1-(取代)苯甲酰基吡唑啉衍生物(3a~3e)的核磁共振氢谱分析

图2 化合物3c的1H NMR谱Fig.2 1H NMR spectrum of compound 3c
NMR谱: 以CDCl3为溶剂, TMS为内标, 表征化合物(3a~3e)的1H NMR、19F NMR以及13C NMR. 化合物(3b~3e)中均包含对位二取代苯, 属于AA′BB′体系; 吡唑环上含有—CH2和—CH 3个氢, 属于ABX三旋体系. 由于化合物结构类似, 故以化合物3c为例进行分析. 将化合物3c的H编号为Ha~Hm, 该化合物的1H NMR谱图如图2所示. 观察谱图可以发现, 在δ=8.06和δ=7.66处各有一组双峰且峰面积积分均为2, 归属于苯环上的4个氢. 由于是对位取代的苯环, 属于AA′BB′体系, 因此两组峰都是双重峰, Hd和He化学位移等价, Hf和Hg化学位移等价, 且耦合常数J分别是6.0和8.0 Hz. 此外,δ=7.45~7.54处的多重峰积分面积为5, 归属于单取代苯环上的5个H. 吡唑环的3个氢属于ABX三旋体系, 出峰位置分别在δ=5.85、 3.75和3.02, 积分面积都是1. 理论上来讲这3个位置都应是四重峰, 但由于实际裂分偏差,δ=5.85和δ=3.02处仅裂分成双重峰,δ=3.75处正常裂分为四重峰. 其中Ha连于苯环的邻位碳上, 化学位置较活泼, 其峰位置为δ=5.85, 耦合常数J=8.4 Hz; Hb和Hc较Ha较不活泼, 其出峰位置分别在δ=3.75和δ=3.02, 耦合常数分别为J1=17.6 Hz,J2=12.0 Hz和J=16.4 Hz. 剩余茂环上的氢出峰位置在δ=4.19~4.71, 其中δ=4.71和δ=4.64处的单峰积分面积均为1, 归属于取代环戊二烯环上的两个α—H(取代茂环上的邻位氢),δ=4.47的单峰积分面积为2, 该峰归属于取代环戊二烯环上的β—H(取代茂环上的间位氢).δ=4.19的单峰积分面积为5, 归属于未被取代环戊二烯环上的5个H.
化合物3c的19F NMR和13C NMR的谱图如图3所示. 从19F NMR谱图中可以很明显看到只有一组峰, 且出峰位置在δ=-62.51, 归属于化合物唯一的—CF3中的F, 即苯环对位的三氟甲基取代. 在13C NMR谱图中,δ=165.5处的峰归属于羰基C(C=O),δ=156.8处的峰归属于吡唑环上的C=N双键的C.δ=146.0、 134.0、 131.1、 130.3、 127.7、 125.9处的单峰归属于未取代苯环和取代苯环上与三氟甲基距离较远的C. 由于苯环上连有三氟甲基, 会导致距离较近碳的耦合裂分.δ=129.9处裂分的四重峰是与三氟甲基相连苯环上的C的裂分, 耦合常数J=32.9 Hz.δ=126.1处裂分的四重峰归属于邻位碳的裂分特征峰, 耦合常数J=3.7 Hz.δ=124.05处的四重峰是三氟甲基碳的裂分,J=271.7 Hz.δ=67.5~74.9处的峰归属于茂铁环上的C,δ=60.4和δ=42.7归属于吡唑环上的两个C.

图3 化合物3c的19F NMR和 13C NMR谱图Fig.3 19F NMR and 13C NMR spectrum of compound 3c
2.1.4 紫外可见分析
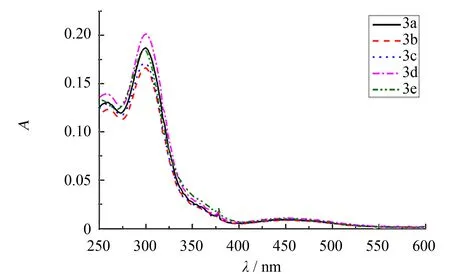
图4 化合物3a~3e的紫外可见光谱图Fig.4 UV-vis spectra of compounds 3a-3e
紫外可见分析测试结果如图4所示. 化合物3a~3e主要均在在3个位置出峰, 分别是250、 300和450 nm. 其中250和450 nm是二茂铁环的特征吸收, 分别属于铁原子的π-π*和d-d跃迁, 可能也混有d-π*跃迁[18-19]. 300 nm是吡唑环的特征吸收(π-π*). 450 nm较纯二茂铁(435 nm)有较明显的红移, 归因于化合物中的吡唑环延长了共轭体系. 由于苯环上取代基与茂环相距较远, 因此茂环的特征峰位置(250、 450 nm)几乎没有偏移. 化合物3a~3e出峰位置较大的区别是在300 nm左右, 最大吸收波长(λmax)见表1. 由表1可以看出化合物3a~3e的λmax仅有细微差别, 但总体来看3a~3c主链上苯环的取代基分别为: —H, —F, —CF3, 吸电子能力逐渐增强, 使吸收峰略微蓝移,λmax依次有略微减小. 化合物3d、 3e是位于侧链苯环上的取代基不同, 分别是—F, —CF3, 也表现出同样的趋势, 吸电子能力增强使λmax略微减小, 吸收峰略微蓝移.

表1 化合物3a~3e的紫外可见光谱测试
2.2 电化学性质分析
用CV和DPV两种电化学分析方法研究目标化合物3a~3e的电化学性质, 并考察了其氧化还原特性. 为了方便观察曲线的偏移情况, 作化合物3a~3e的CV叠加图和DPV堆积图, 如图5所示.

图5 化合物3a~3e的CV和DPV谱图Fig.5 CV and DPV spectra of compounds 3a-3e
表2是化合物3a~3e在扫速为100 mV·s-1下, CV测得的电化学数据, 可以看出5个化合物均只有一组氧化还原峰, 归属于分子中茂环Fc/Fc+的氧化还原过程. 并且氧化峰电位和还原峰电位的差值|Epa-Epc|均在0.070~0.105 V之间, 氧化峰电流和还原峰电流的比值ipa/ipc均约等于1, 说明这些化合物都具有良好的氧化还原特性, 发生了准可逆的氧化还原过程.
观察CV曲线可知, 无论是主链还是侧链上连有吸电子基(—F, —CF3), 均使茂环的电子云密度减小, 结果使氧化电位均有不同程度的减小, 还原电位有不同程度的增加. 纵向将化合物3b、 3c与化合物3d、 3e两两对比, 很容易发现, 吸电子能力越强, 氧化峰电位越低, 还原峰电位却越高. 将化合物3b、 3d与化合物3c、 3e比较也可以发现, 含氟的吸电子基团连于侧链, 半波电位增加更多. DPV堆积图可以相对更明显地看出5种化合物的氧化峰电位的轻微偏移趋势.

表2 CV测得化合物3a~3e的电化学数据

2.3 燃速催化性能分析
测试所用的AP均于真空干燥箱中充分干燥, 后经玛瑙研钵充分研磨, 因此属于小粒度粉末, 测试的结果也只有明显的第二阶段放热峰, 与文献[20]相符. DSC及TG测试结果如图6所示. 在DSC图中, 247.9 ℃左右有一个小的吸热峰, 应归属于AP由斜方晶系转变为立方晶系的转晶峰; 316.7 ℃处有一小的放热峰, 属于AP分解的第一阶段, 在此阶段的低温分解进程中, 只有一部分NH3能被HClO4的分解产物氧化. 随着分解进程深入, 晶体表面逐渐被NH3覆盖. 当表面上的反应中心全部被NH3覆盖时, AP分解终止. 当温度升高时, NH3会从反应表面解吸, 使之前被覆盖的反应中心重新得到活化. 此时AP也可能会部分液化, 凝聚相成为此时的反应位点, 不存在上述被抑制的“局部化学”过程, 因此反应速率更快、 放热加剧、 分解较快、 峰较强. 这就是AP分解的第二阶段, 即升温到450 ℃左右时出现的强的放热峰[21].

图6 纯AP的 DSC及TG测试结果Fig.6 DSC and TG spectra of pure AP



图7 化合物3a~3c和3d~3e的DSC测试结果Fig.7 DSC spectra of compounds 3a-3c and 3d-3e

图8 化合物3a~3c和3d~3e的TG测试结果图Fig.8 TG spectra of compounds 3a-3c and 3d-3e
3 结语
实验设计合成了5种3-二茂铁基-5-苯基-1-苯甲酰基吡唑啉衍生物(3a~3e), 并运用IR、 MS、 NMR及HRMS对化合物结构进行了表征. 热分析测试结果表明, 目标化合物3a~3c均对高氯酸铵(AP)有优良的燃速催化效果, 然而含氟基团的引入使得其与AP混合后的热分解温度略高于不含氟化合物.
参考文献:
[1] DILSIZ N, ÜNVER A. Characterization studies on aging properties of acetyl ferrocene containing HTPB-based elastomers[J]. Journal of Applied Polymer Science, 2006, 101(4): 2538-2545.
[2] GORE G M, BHATEWARA R G, TIPARE K R,etal. Studies on ferrocene polyglycol oligomer-burning-rate modifier for composite propellants[J]. J Propulsion, 2004, 20(4): 758-760.
[3] SAYLES D C, HUNTSVILLE A. Propellant composition containing triferrocenylmethyl perchlorate as catalytic oxidizer: US3860463[P]. 1975-01-14[2017-05-25].
[4] 唐松青, 丁宏勋. 丁羟推进剂的高效燃速催化剂[J]. 化学推进剂与高分子材料. 2004, 2(1): 8-11.
[5] CHENG Z, ZHANG G, FAN X,etal. Synthesis, characterization, migration and catalytic effects of energetic ionic ferrocene compounds on thermal decomposition of main components of solid propellants[J]. Inorganica Chimica Acta, 2014, 421(1): 191-199.
[6] LIU X, LI J, BI F,etal. Ionic ferrocene-based burning-rate catalysts with polycyano anions: synthesis, structural characterization, migration, and catalytic effects during combustion[J]. European Journal of Inorganic Chemistry, 2015, 2015(9): 1496-1504.
[7] ZHAO H, GUO L, CHEN S,etal. Synthesis, complexation of 1, 2, 3-(NH)-triazolylferrocene derivatives and their catalytic effect on thermal decomposition of ammonium perchlorate[J]. RSC Advances, 2013, 3(43): 19929-19932.
[8] ZHUO J B, MA Z H, LIN C X,etal. Synthesis of two nickel(II) complexes bearing pyrrolide-imine ligand and their catalytic effects on thermal decomposition of ammonium perchlorate[J]. Journal of Molecular Structure, 2015, 1085: 13-20.
[9] FAN X, WANG C, LI J,etal. Zinc(II) and cadmium(II) complexes of 5-ferrocenyl-1H-tetrazole: synthesis, structures, and catalytic effects on thermal decomposition of energetic compounds[J]. Zeitschrift Für Anorganische Und Allgemeine Chemie, 2015, 641(6): 1169-1175.
[10] WANG C, LI J, FAN X,etal. 5-ferrocenyl-1H-tetrazole-derived transition-metal complexes: synthesis, crystal structures and catalytic effects on the thermal decomposition of the main components of solid propellants[J]. European Journal of Inorganic Chemistry, 2015, 2015(6): 1012-1021.
[11] GAO X, AN T, LI J,etal. Ferrocenyl ionic compounds based on 5-ferrocenyl-1H-tetrazole. Synthesis, characterization, migration, and catalytic effects during combustion[J]. Zeitschrift Für Anorganische Und Allgemeine Chemie, 2016, 642(2): 155-162.
[12] LI J, WANG C, GAO X,etal. Alkaline and alkaline earth salts of 5-ferrocenyl-1H-tetrazole. Synthesis, characterization and catalytic effects on thermal decomposition of energetic compounds[J]. Polyhedron, 2016, 106: 58-64.
[13] HUANG H, ZHOU Z, LIANG L,etal. Nitrogen-rich energetic dianionic salts of 3, 4-bis(1H-5-tetrazolyl)furoxan with excellent thermal stability[J]. Zeitschrift Für Anorganische Und Allgemeine Chemie, 2012, 638(2): 392-400.
[14] WANG R, GUO Y, ZENG Z,etal. Furazan-functionalized tetrazolate-based aalts: a new family of insensitive energetic materials[J]. Chemistry-A European Journal, 2009, 15(11): 2625-2634.
[15] ARMAREGO W L F, CHAI C L L. Purification of laboratory chemicals[M]. Oxford: Butterworth-Heinemann, 2013.
[16] ZHUO J B, LI H D, LIN C X,etal. Ferrocene-based sulfonyl dihydropyrazole derivatives: synthesis, structure, electrochemistry and effect on thermal decomposition of NH4ClO4[J]. Journal of Molecular Structure, 2014, 1067(7): 112-119.
[17] GRITZNER G, KUTA J. Recommendations on reporting electrode potentials in nonaqueous solvents[J]. Pure and Applied Chemistry, 1984, 56(4): 461-466.
[18] CAMIRE N, MUELLER-WESTERHOFF U T, GEIGER W E. Improved electrochemistry of multi-ferrocenyl compounds: investigation of biferrocene, terferrocene, bis(fulvalene) diiron and diferrocenylethane in dichloromethane using [NBu4][B(C6F5)4] as supporting electrolyte[J]. Journal of Organometallic Chemistry, 2001, 637(23): 823-826.
[19] ROSENBLUM M, SANTER J O, HOWELLS W G. The chemistry and structure of ferrocene. VIII. Interannular resonance and the mechanism of electrophilic substitution[J]. Journal of the American Chemical Society, 1963, 85(10): 1450-1458.
[20] BRILL T B, BRUSH P J, PATIL D G. Thermal decomposition of energetic materials 60. Major reaction stages of a simulated burning surface of NH4ClO4[J]. Combustion and Flame, 1993, 94(1/2): 70-76.
[21] 刘子如, 向海. 高氯酸铵的热分解[J]. 含能材料, 2000, 8(2): 75-79.
