食品中嘌呤含量分布及其高效液相色谱检测研究进展
2018-06-11李婷婷任丽琨王当丰励建荣
李婷婷,任丽琨,王当丰,励建荣
(1.大连民族大学生物技术与资源利用教育部重点实验室,辽宁大连 116600)(2.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,辽宁锦州 121013)
嘌呤是一种生物碱,由一个嘧啶环和咪唑环稠合而成[1],主要包括腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤及其衍生物。嘌呤在体内不可或缺,它能形成嘌呤核苷酸进而构成人体重要的遗传物质-核酸,此外嘌呤参与构成能量物质三磷酸腺苷(ATP)并以此形式参与机体的各种活动。尿酸是人体嘌呤代谢的终产物,人体血尿酸正常含量为200~410 μmol/L[2],且男性偏高于女性。当男性、女性体内血尿酸含量分别超过420 μmol/L、357 μmol/L[3]时称为高尿酸血症(Hyperuricemia),高尿酸血症是痛风的无症状表现形式,主要由人体嘌呤代谢紊乱或尿酸排泄受阻引起[4]。人体内嘌呤的获取途径主要有三种,即体内合成、人体核酸分解及食物获取[5],其中食物获取是外源获取嘌呤的主要途径。研究发现,嘌呤广泛存在于各类食品中,而痛风的发生与摄入食品的种类及含量密切相关,现有研究显示豆类、菌类、肉类、海产品和啤酒中都含有大量嘌呤,过多的摄入富含嘌呤的食物可显著影响血尿酸水平,增加痛风发病率[6]。
目前常用的嘌呤检测法主要有高效液相色谱法、气相色谱法和毛细管电泳法等,而嘌呤检测中样品前处理的方法主要是酸提取法和超声提取法。目前国内外并没有建立统一、精确、高效的嘌呤检测方法。此外,虽然国内外对于食品中嘌呤含量的研究较多,但尚未有研究者对其进行归纳,从而不能便捷地为消费者提供健康、科学的饮食指导。因此本文对国内外研究者已检测出的部分食品中嘌呤含量的结果进行归类总结,并对样品前处理及嘌呤检测方法进行分析,以期为确定准确高效的嘌呤检测技术提供借鉴,为预防痛风、指导消费者选择适合的食品提供依据。
1 食品中嘌呤含量
食物是人体摄取嘌呤的重要途径之一。饮食中嘌呤的吸收量能够显著影响血尿酸水平,且与高尿酸血症及痛风发病密切相关。关宝生等[7]通过自行设计的调查表,对痛风病例组及对照组进行问卷调查。结果发现良好的饮食习惯,合理的饮食结构可有效的预防痛风和高尿酸血症的发生。但近年来随着国民生活水平的提高及饮食结构的改变,我国痛风发病率逐年升高。因此,痛风病的防治尤为重要,目前痛风治疗的方法主要包括药物治疗和饮食治疗,其中饮食治疗是一种基础治疗方法,效果优于药物治疗[8]。因此,消费者在日常生活中应了解各种食品的嘌呤含量,改变膳食结构,食用低嘌呤食物,积极降低自身体内尿酸含量,从而减少痛风和高尿酸血症的发生。
1.1 动物源食品中嘌呤含量
不同食品中嘌呤含量不同,荣胜忠[9]对目前已测出的500种常见食物的嘌呤进行分析,发现动物源食品的嘌呤含量普遍高于植物源食品。且动物源食品中,内脏、海鲜嘌呤含量高于肉及肉制品、血液及血制品的嘌呤含量。潘洪志[10]等利用高效液相色谱法对我国常见动物源食品中的嘌呤含量进行测定,结果发现动物肝脏和鱼虾蟹贝类含量最高,猪肝的总嘌呤值高达2752.00 mg/kg,与荣胜忠[9]结果一致。
表1为部分动物源食品嘌呤含量表。由表可知鱼类嘌呤总量在100~170 mg/100 g之间,肉类产品嘌呤含量高于70 mg/100 g低于110 mg/100 g。动物内脏中鹅肝、鸭肝和猪肝嘌呤含量较高。海胆嘌呤含量一般在150~200 mg/100 g之间,而表1中罐藏海胆总嘌呤值高达1568.50 mg/100 g,这可能是由于罐藏加工所导致的。此外,不同食品嘌呤含量差异较大,这与其遗传差异以及生长环境有关。
部分研究者还对贮藏及加工过程中嘌呤的变化进行探究,Piñeiro-Sotelo M等[11]对-18 ℃贮藏下的海胆中的四种嘌呤进行了测定,发现随着贮藏时间的延长鸟嘌呤逐渐减少,次黄嘌呤含量持续升高,黄嘌呤含量先增大后减小,这些变化可能与鱼体死亡后自身腐败产生的多种酶促使嘌呤降解及转化有关。
王新宴[3]利用高效液相色谱法检测了多种肉制品在水煮过程中嘌呤的变化情况,结果显示水煮10 min时肉中的嘌呤含量急剧下降,汤中的嘌呤含量升高,此外在生肉、熟肉、及肉汤中次黄嘌呤含量始终最高。这是由于动物体内的三磷酸腺苷在煮沸的过程中迅速降解为肌苷酸(IMP),继而降解为次黄嘌呤腺苷(HxR)和次黄嘌呤[12],从而导致次黄嘌呤积累,含量升高。
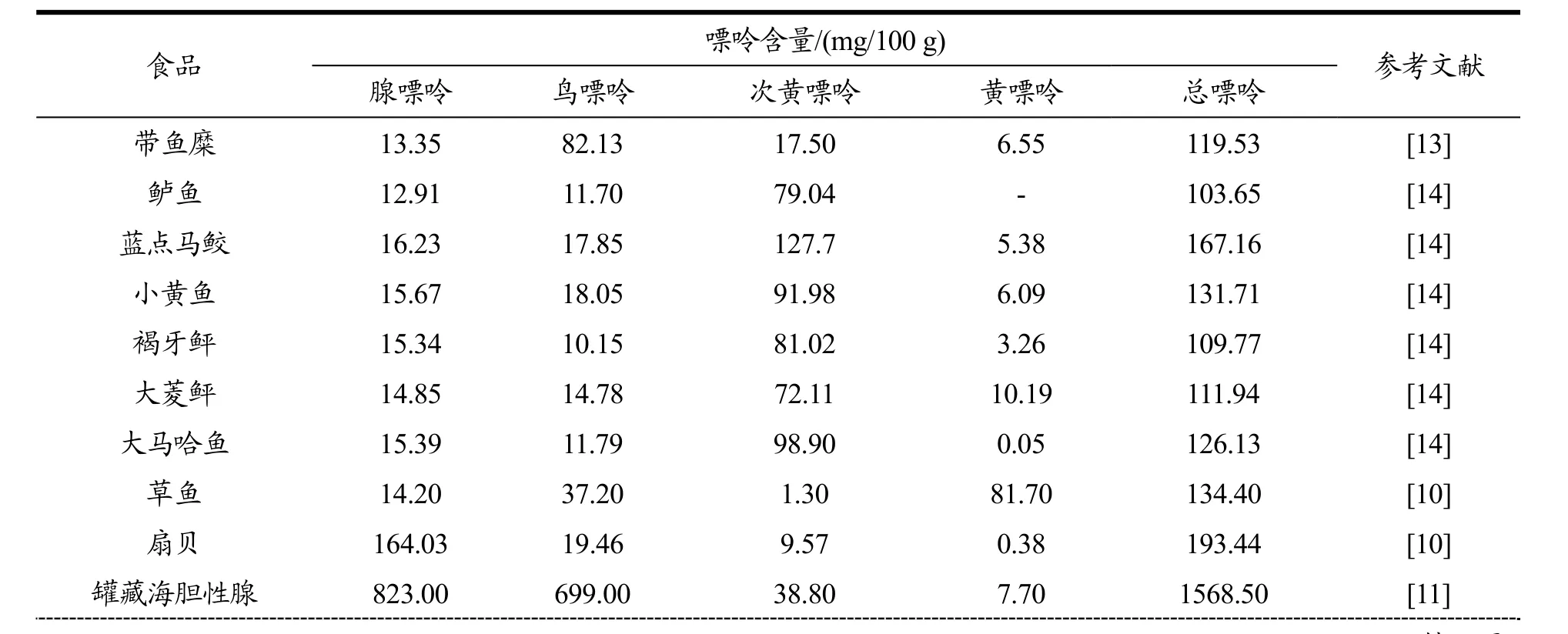
表1 部分动物型食品中嘌呤含量Table 1 Purine content in some animal foods
1.2 植物源食品中嘌呤含量
植物源食品种类繁多,部分研究检测所得的植物源食品嘌呤含量见表 2,由表可知,豆类、食用菌、啤酒和小麦等食品均含有较多嘌呤。过多的食用这些食品将会导致人体血尿酸水平升高继而提高罹患痛风的风险。因此在日常膳食中应合理搭配动物源、植物源食品,降低体内血尿酸含量,减少痛风的发生。
1.2.1 豆类食品中嘌呤含量
豆类食品营养丰富,风味独特,常食用豆类制品可减少人体脂肪含量,增加免疫力。但由于其高嘌呤值,限制了痛风病人的食用。刘少林[17]通过高效液相色谱法测定了大豆中四种嘌呤的含量,结果显示四种嘌呤中大豆以腺嘌呤和鸟嘌呤为主,含量分别为0.73及0.82 mg/g。崔素萍等[5]利用超声波辅助技术,以脱脂豆粕为原料,研制出了嘌呤含量为123.50 mg/100 g的低嘌呤脱脂豆粕粉。李慧慧[4]对豆浆分别采用吸附、盐析、吸附-盐析、盐析-吸附等前处理方法,发现盐析-吸附法可有效地脱除嘌呤,脱除率高达59.7%,继而研发了低嘌呤豆浆,供痛风患者食用。这些研究的成功为开发低嘌呤食品提供了切实可行的理论依据。
1.2.2 食用菌中嘌呤含量
总之,基于碳氟键断裂或活化的硼化反应作为新的氟化学和硼化学的交叉研究领域正日益引起人们的关注,新反应、新方法也层出不穷。我们相信将碳氟键的惰性与硼酯基团强大的反应能力相结合,一定会为药物的后阶段修饰策略 (the late-stage drug modification) 提供强有力工具。钯或铁催化的芳基氟的硼化反应[12]发表在Organic Letters, 2018, 20, 5564上,铜催化的偕二氟烯烃的硼化反应[14]发表在Organic Letters, 2017, 19, 3283上。该两项工作得到了国家自然科学基金和中国科学院有机氟化学重点实验室开放课题的支持。
菌类食品具有良好的食用和药用价值,是素食主义者重要的的营养来源。食用菌中的嘌呤含量相对较高。在痛风患者参考食谱中,被视为需限量食用的食品[18]。刘桂英等[19]检测了香菇、金针菇、银耳、平菇、木耳及茶树菇中的嘌呤含量,结果显示,不同菌中嘌呤含量差异较大,其中香菇总嘌呤含量高达 323.70 mg/100 g。此外鸟嘌呤和腺嘌呤在以上检测的六种菌类食品中的含量均较高,这与陈月菊等[20]的研究结果一致。荣胜忠等[21]对不同种类鲜菌和干菌的嘌呤含量进行了比对,发现干菌中的嘌呤含量在681.00~4049.20 mg/kg之间,鲜菌中的嘌呤含量则在213.80~730.30 mg/kg之间。干菌中嘌呤含量明显高于鲜菌,从而推测嘌呤含量与食品含水量密切相关。
1.2.3 饮品中的嘌呤含量
饮品是指经加工制造形成的适于供人体饮用的液体,具有一定的营养价值。Kaneko等[22]以150 mmol/L(pH=2.5~2.8)磷酸钠缓冲溶液为流动相,设置流速0.6 mL/min、柱温35 ℃,成功检测出部分常见饮品中的嘌呤含量,其中普通啤酒嘌呤含量较高为225.0~580.2 mol/L,威士忌 8 μmol/L、白兰地 26.4 μmol/L、日本烧酒1.3 μmol/L、酸奶和牛奶嘌呤的含量小于5.2 mg/100 g,除啤酒外均属于嘌呤含量极低的饮品,痛风病人可放心食用。谢芳钦[23]对国内购买的啤酒、牛奶、果汁、碳酸饮料和矿泉水中的嘌呤含量进行测定,测定结果与 Kaneko结果一致,除啤酒中嘌呤含量较高外,其余饮品中的嘌呤含量均较低,可放心饮用。众多研究表明,啤酒中嘌呤含量较高,但其味道鲜美,营养丰富,深受消费喜爱,素有“液体面包”的美誉[24]。工业生产中啤酒主要以麦芽为原料经酵母发酵制得,麦芽发芽时核酸大量生成,发芽后期及啤酒生产过程中核酸酶会促使核酸分解,在糖化过程中继而降解生成大分子嘌呤物质[25],致使啤酒中嘌呤含量升高。研究表明,大量饮用啤酒后,人体尿酸水平显著升高,严重者将导致高尿酸血症。因此很多学者在测定啤酒中嘌呤含量的同时积极呼吁改进啤酒生产工艺,降低啤酒中嘌呤含量,生产低嘌呤啤酒。李惠萍等[26]通过增加小麦芽在生产原料中的比例,采用高浓度酿造后稀释的工艺,酿造出嘌呤含量低于18 mg/L的啤酒。此外在啤酒生产的同时使用活性炭对其进行吸附操作,发现嘌呤含量降低了50%,但吸附作用同时显著降低了啤酒原有的口感及风味。商曰玲等[27]使用反相色谱法检测了 14种啤酒的游离嘌呤和总嘌呤含量,并且分析了嘌呤含量与啤酒常规指标间的相关性,结果显示 14种啤酒中的游离嘌呤含量为7.11~24.93 mg/L,总嘌呤含量为28.65~79.35 mg/L,游离嘌呤含量与酒精度、色度及总酸度密切相关,而总嘌呤含量与各指标间的相关性不大。
1.2.4 其他植物源食品嘌呤含量
除以上几种植物源食品外,刘春凤等[28]经检测发现,不同品种小麦中嘌呤含量具有较大差异,且小麦中的游离嘌呤碱主要是次黄嘌呤、腺嘌呤和鸟嘌呤,其质量分数高达 90%以上。曲欣[14]等以水-甲醇-冰乙酸-10%四丁基氢氧化铵(V/V/V/V,879/100/15/6)为流动相,经Agilent XDB-C18柱(4.6 mm×250 mm,5.0μm)对菠菜、海带、豆腐和苹果等非动物型食品的嘌呤进行检测,实验结果发现苹果中并未检测出任何嘌呤成分,可视为痛风病人的理想食品。而豆腐中嘌呤含量(329.35 mg/kg)高于本实验中测定的其他植物源食品,因此在痛风病人日常饮食中应注意其摄入量。
2 样品处理及检测方法
目前众多食品的嘌呤含量数据尚不完整,因此需要对其进行补充和完善。现有的嘌呤检测方法主要有高效液相色谱法[31]、气相色谱法[32]、毛细管电泳法[33]和离子对交换法[34]等,此外胡奇杰等[35]通过重氮化反应及黄嘌呤氧化酶将四种嘌呤转化为尿酸,通过测定尿酸含量确定总嘌呤值。在以上几种方法中高效液相色谱法是近几年来使用最广泛的检测方法,其具有高效、快速和高灵敏度等[36]优点,能够对食品中的嘌呤含量进行快速且准确的检测。但由于样品种类、样品前处理方法、流动相、色谱柱、柱温和流速等众多因素能够显著影响高效液相色谱法的检测结果,故目前尚未建立统一的检测方法。因此本文从样品前处理及检测方法两方面,对现有嘌呤检测方法进行比对,以期为日后使用高效液相色谱法检测嘌呤提供借鉴。
2.1 样品前处理方法
嘌呤主要存在于核酸中,因此嘌呤检测的第一步是将核酸中的嘌呤进行提取。现有的嘌呤提取方法主要有酸提取法,超声提取法等。不同的提取方法对样品嘌呤提取率影响不同。研究者从多方面对样品前处理方法进行探究,力求获取最有效的嘌呤提取方法。
2.1.1 酸提取法
冷酸提取法常用于游离嘌呤的提取[37],而总嘌呤的提取一般使用热酸。酸的种类及其用量均对嘌呤提取结果有显著影响。三氟乙酸及高氯酸是目前嘌呤酸提取法中最常用的两种酸,此外,部分研究者对硫酸、磷酸、乙酸等[38,39]的水解效果进行了探究,发现在色谱分析中高氯酸的效果优于其它酸提取,这是由于进行样品水解的高氯酸可以用钾盐冰浴除去,即使高氯酸少量溶解也不会对色谱分析造成干扰[40]。但高浓度的高氯酸会使嘌呤降解回收率降低,Kaneko K[8]采用高氯酸处理样品,黄嘌呤加标回收率仅为 87.4%。此外高氯酸在消化过程中会产生大量有毒气体[41],造成污染。因此在色谱分析中,高氯酸效果虽好,但应尽量避免使用。尤玉如等[42]通过高效液相色谱法检测啤酒中的嘌呤含量,使用不同的酸对样品进行处理。发现使用三氟乙酸与甲酸(1:1)混合液可高效的提取食品中的嘌呤物质,样品加标回收率在99.41%~101.31%之间嘌呤损失较小。单独使用高氯酸效果较优但无法使鸟嘌呤与杂峰分离,从而导致其损失较大。乙酸的单独使用不能将嘌呤完全提取,只能水解出样品中少量的腺嘌呤、鸟嘌呤和次黄嘌呤且水解度不高,盐酸虽然能水解出四种嘌呤,但嘌呤检测量小于三氟乙酸和甲酸的混合液对样品的水解结果,这可能是由于盐酸对嘌呤没有保护作用。因此最终选择三氟乙酸与甲酸(1:1)混合液作为最佳嘌呤提取条件。实验结果与曲欣等[43]的样品前处理条件优化结果相同。Havlik J等[44]使用三氟乙酸与甲酸(1:1)混合液作为嘌呤提取液,较好地分离了四种嘌呤并检测了部分常见素肉食品中的嘌呤含量,此外吕兵兵[13]和凌云[16]等使用 V(三氟乙酸):V(甲酸):V(水)=5:5:1的混合溶液对带鱼糜及肉类样品进行水解,发现水解效果亦较优,嘌呤损失率小,四种嘌呤加标回收率均高于91.5%。
2.1.2 超声提取法
超声波具有机械效应、空化效应等,可增大分子间的运动速度及介质的穿透力,因此常被用于提取生物碱等成分。不同的样品固液比及超声时间对嘌呤提取率都有一定的影响。程庆红等[45]利用超声法对贻贝水溶液中的嘌呤进行提取,并探究了其最佳提取条件。结果显示当料液质量比为80:1,提取时间为150 min时嘌呤提取效果最佳,其总提取率达到1.68 mg/g。但曲欣[43]和陈月菊等[20]认为超声提取虽然设备简单、操作方便但不能将样品中的嘌呤物质提取完全,而仅能提取游离嘌呤,因此只能作为样品前处理的一种辅助手段。刘秀艳等[46]采用稀乙醇浸提地龙粉末并以超声作为辅助手段,最终得到次黄嘌呤的平均回收率为100.3%,RSD=1.9%。实验表明该方法准确可靠,重现性好,结果稳定。
2.2 嘌呤检测方法
高效液相色谱法是目前最常用的嘌呤检测方法,但由于不同样品间性质差异较大,因此没有较为统一的检测方法。研究者对不同样品的嘌呤检测色谱条件进行探究,从色谱柱、流动相、柱温和流速等多方面对条件进行优化,力求探寻最优的嘌呤高效液相检测方法。表3为部分样品检测色谱条件。表中实验方法所得相关系数及精密度均符合分析检测实验要求。其中使用Ultimate AQ-C18色谱柱、以四丁基氢氧化铵:冰乙酸:水(1.5/1.5/997):10%甲醇为流动相时样品精密度最好,达到0.5%。但在样品检测中最终色谱条件的确定,需根据所检测样品及检测时的具体情况而定。因此本文对色谱柱、流动相等色谱条件的选择进行分析,以期指导研究者合理的选择色谱条件,准确、高效的检测食品中嘌呤含量。
2.2.1 色谱柱的选择
嘌呤检测通常使用C18色谱柱作为固定相,且不同型号的C18色谱柱分别有其相适应的色谱条件。宋学英[50]采用两种C18色谱柱(Agilent SB-C18、Waters SymmetryShield RPC18)分离 ATP、ADP、AMP,发现结果差异较大,因此得出采用不同厂家或相同厂家不同系列的色谱柱分析样品时对色谱峰保留时间及分离度都有较大影响。曲欣[14]与凌云[16]同样使用C18色谱柱,且在相同的流动相磷酸二氢钾(0.02 mol/L、pH=3.8)及其他色谱条件下分离嘌呤标准储备液,结果存在明显差异。凌云使用上诉条件成功使四种嘌呤基线分离、峰型较好,而曲欣得到的标准储备液色谱图中,腺嘌呤和鸟嘌呤出现分峰,无法进行后续样品检测实验。推测可能是由于曲欣实验中使用的色谱柱为Agilent XDB-C18柱(4.6 mm×250 mm,5.0 μm),而凌云在检测过程中使用的是Waters-Atlantis dC18柱(4.6 mm×250 mm,5.0 μm)。Agilent XDB-C18与Waters-Atlantis dC18色谱柱均为硅胶填料色谱柱,但前者主要采用三种不同类型的多孔硅胶微球,利用辛基硅烷化学键合到全多孔硅胶颗粒、降低碳载量并使用双封端技术将裸露的硅羟基键合后封闭起来,可以高效、准确的检测极性物质。后者采用高纯度硅胶及双键键结合 C18技术,填料密度低,亲水相。嘌呤具有极性,当使用的流动相中水的比重较大时建议使用亲水相的C18色谱柱,其保留极性化合的能力较强[51]。当向流动相中加入庚烷磺酸钠、四丁基氢氧化铵等离子对试剂时C18会与其结合形成带电的基团,亲水相的色谱柱与离子对试剂结合能力不如普通色谱柱[52],致使极性物质分离效果不佳。色谱柱的选择与流动相及其他色谱条件密切相关,因此,选择适宜的色谱柱,是高效、准确测定嘌呤含量的关键步骤。

表3 嘌呤高效液相检测方法选择Table 3 Selection of high performance liquid phase detection method for purine
2.2.2 流动相的选择
选择正确的流动相可以有效地改善分离效果,提高嘌呤检测准确性。吕兵兵[13]、刘镇[1]、钟宁[29]和毛玉涛等[53]采用不同pH的0.02 mol/L KH2PO4作为流动相测定了多种食品中的嘌呤含量,均获得较好的试验结果。食品中的四种嘌呤均属于弱碱性物质,性质相对稳定而C18色谱柱为硅胶柱其硅羟基的pKa范围为3.5~4.5,硅羟基会吸引碱性化合物导拖尾现象产生[4],因此设定适宜的pH值可以保持嘌呤活性,帮助嘌呤从固定相中分离[54],提高检测准确度。此外四种嘌呤中鸟嘌呤和腺嘌呤的pKb值为3.20和4.15,改变流动相pH对嘌呤的分离影响显著。刘少林[17]配制pH分别为3.0、3.4、3.8、4.0、4.6的0.02 mol/L KH2PO4溶液,考察其对四种嘌呤的分离效果,发现当采用Waters Atlantis dRPC18(4.6 mm×250 mm,5.0 μm)色谱柱,在流速0.6 mL/min,柱温25 ℃的色谱条件下,流动相pH为4.60时可使分离效果最优。同样毛玉涛[53]等对0.02 mol/L KH2PO4的最佳pH值进行了探究,最终选择在pH=3的条件下对嘌呤进行冲洗。
此外,杨祥根[30]、王静莹等[15]将KH2PO4的浓度减小至 0.007 mol/L,Havlik J[44]采用 0.05 mol/L的KH2PO4,均可较好的分离四种嘌呤,这表明使用KH2PO4作为流动相时其浓度和pH要根据样品种类和试验条件进行选择。曲欣[14]等采用水-甲醇-冰乙酸-10%四丁基氢氧化铵(V/V/V/V=879/100/15/6)作为流动相成功使腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤基线分离。其中四丁基氢氧化铵可以与嘌呤生成中性离子,增强与非极性相的作用,改善分离效果[25]。冰乙酸用于调节流动相pH,甲醇可以提高分离率,改变流动相间的相互作用。崔素萍等[5]将四丁基氢氧化铵、冰醋酸及超纯水按1.5:1.5:997体积配制,然后与甲醇按体积比 99:1混合。最终测定结果的精密度 RSD小于0.50%。
除以上两种流动相外,程庆红[48]等以甲醇:水(5:95),谢芳钦等[23]使用 10 mmol/L甲酸铵(pH=3.45)-甲醇(V/V=99:1),Inazawa K[55]等采用 150 mmol Na3PO4-H3PO4(pH=2.5)为流动相时,都可以使四种嘌呤分离且峰型较优。总体来说,在嘌呤高效液相色谱检测实验中常用的流动相为磷酸二氢钾。使用磷酸二氢钾作为流动相时,其步骤繁琐需要寻找适宜的pH值,四种嘌呤峰保留时间较长,较为耗时且盐溶液会腐蚀色谱柱降低色谱柱使用寿命[51]。因此建议使用含离子对试剂的溶液作为流动相,可以避免调节pH的繁琐步骤,缩短检测时间,减少盐溶液对色谱柱腐蚀的危险。
2.2.3 其他色谱条件的选择
当温度过高时,腺嘌呤和黄嘌呤易分解,这会对嘌呤含量检测结果造成不良影响。程庆红[48]等在保持其他色谱条件不变的情况下,改变柱温参数,发现温度对腺嘌呤和黄嘌呤的检测结果影响较大,而对次黄嘌呤的检测结果几乎没有影响。目前,大多数研究者选用柱温于25~30 ℃之间进行嘌呤检测。高效液相色谱分析中流速一般在0~2 mL/min之间,研究表明流动相在高流速下,柱效较高且不易产生拖尾现象,但较高的流速同样会使柱压增大,缩短色谱柱的使用寿命,甚至会造成色谱柱塌陷损坏色谱柱。因此在嘌呤测定中多设定流速为 0~1 mL/min。程庆红[48]等在200~300 nm波长范围内对腺嘌呤、黄嘌呤及次黄嘌呤进行光谱扫描,发现三种嘌呤紫外最大吸收波长在254~277之间。目前,大多研究者均使用254 nm作为检测波长,而 Piñeiro-Sotelo M[11]、Inazawa K[55]等分别在255、260 nm紫外波长下对食品中的嘌呤进行检测,检测结果差异并不显著。因此推测波长对嘌呤检测结果影响不大,保证在254~277 nm之间即可。
3 总结
目前,嘌呤样品前处理及高效液相色谱法检测没有统一的方法,因此同一食品检测得到的结果也不尽相同。通过比较发现,在样品前处理中使用三氟乙酸和甲酸混合液对嘌呤的提取效果优于其他提取液,样品回收率可达 99.41%~101.31%。液相检测中常采用KH2PO4作为流动相,但其浓度和pH要根据检测样品种类及其他实验条件确定,步骤繁琐、耗时。建议使用含离子对试剂的溶液作为流动相,可以避免调节pH的繁琐步骤,节省时间。色谱柱应根据选定的流动相成分中水相比例进行选择,当水相比例过大时,建议选择亲水相色谱柱提高分离效率。温度可以影响嘌呤的稳定性因此检测柱温常设定在25~30 ℃之间。高流速会缩短检测时间减少拖尾现象产生但会对色谱柱造成一定的损害,建议流速设定在0~1 mL/min。现有检测方法种类繁多,但大多需要调节pH或流动相配比,较为繁琐。样品前处理多使用高氯酸和三氟乙酸,具有挥发性对环境及人体呼吸道危害较大,因此在现有实验方法的基础上,探寻出更为简便、环保的方法仍需进一步研究,同时,了解各种食品的嘌呤底值,掌握其在不同生产加方式中的变化规律。从而帮助痛风患者合理饮食,为痛风病的防治提供科学指导,也是未来需要深入探究的主要方向。
[1]刘镇,王灵芝,章姗姗,等.反相高效液相色谱法同时测定黄酒中4种游离嘌呤[J].酿酒科技,2017,4:100-102 LIU Zhen, WANG Ling-zhi, ZHANG Shan-shan, et al.Simultaneous determination of four free purines in yellow rice wine by reversed phase HPLC [J]. Liquor-making Science &Technology, 2017, 4: 100-102
[2]So A. Developments in the scientific and clinical understanding of gout [J]. Arthritis Res Ther, 2008, 10(5): 1-6
[3]王新宴,凌云,储晓刚,等.肉制品中四种嘌呤含量在水煮过程中的变化[J].食品科学,2008,29(7):67-69 WANG Xin-yan, LING Yun, CHU Xiao-gang, et al. Effects of boil processing on content of four kinds of purines in meat products [J]. Food Science, 2008, 29(7): 67-69
[4]李慧慧.低嘌呤豆浆及其速溶粉的研究[D].贵阳:贵州大学,2016 LI Hui-hui. Study on low purine soybean milk and instant powder [D]. Guiyang: Guizhou University, 2016
[5]崔素萍,车康,谢微,等.高效液相色谱测定脱脂豆粕中嘌呤含量[J].中国食品学报,2014,14(7):224-229 CUI Su-ping, CHE Kang, XIE Wei, et al. Determine purine content in nonfat soybean mealby HPLC [J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(7):224-229
[6]荣胜忠,张艳男,王栋,等.常见干豆类及豆制品中嘌呤含量研究[J].中国食物与营养,2014,20(6):61-63 RONG Sheng-zhong, ZHANG Yan-nan, WANG Dong, et al.Study on the purine content in common dried legumes and legume products [J]. Food and Nutrition in China, 2014, 20(6):61-63
[7]关宝生,白雪,周宪君,等.痛风和高尿酸血症患者饮食危险因素的病例对照研究[J].牡丹江医学院学报,2013,34(2):15-17 GUAN Bao-sheng, BAI Xue, ZHOU Xian-jun, et al.Case-control study of dietary risk factors for gout and hyperuricemiain patients [J]. Journal of Mudanjiang Medical University, 2013, 34(2): 15-17
[8]Kaneko K, Yamanobe T, Fujimori S. Determination of purine contents of alcoholic beverages using high performance liquid chromatography [J]. Biomedical Chromatography, 2009, 23(8):858
[9]荣胜忠.中国食物嘌呤数据库的构建及嘌呤摄入量评估[A].中国营养学会(Chinese Nutrition Society),2013:2 RONG Sheng-zhong. The establishment of the Chinese food purine database and the assessment of purine intake [A].Chinese Nutrition Society, 2013: 2
[10]潘洪志,荣胜忠,邹立娜,等.中国常见动物性食品中嘌呤的含量[J].营养学报,2012,34(1):74-78 PAN Hong-zhi, RONG Sheng-zhong, ZOU Li-na, et al. The content of purines in common animal food in China [J].Journal of Nutrition, 2012, 34(1): 74-78
[11]Piñeiro-Sotelo M, López-Hernández J, Simal-Lozano J.Determination of purine bases in sea urchin (Paracentortus lividus) gonads by high-performance liquid chromatography[J]. Food Chemistry, 2002, 79(1): 113-117
[12]吴依蒙,陈舜胜,今野久仁彦,等.牙鲆在保藏过程中影响ATP关联化合物降解的因素[J].水产学报,2016,40(7):1114-1122 WU Yi-meng, CHEN Shun-sheng, KONNO Kunihiko, et al.Factors affecting change of ATP related compounds decomposition in stored bastard halibut [J]. Journal of Fisheries of China, 2016, 40(7): 1114-1122
[13]吕兵兵,张进杰,储银,等.反相高效液相色谱法检测带鱼糜中的嘌呤含量[J].中国食品学报,2012,12(7):192-198 LV Bing-bing, ZHANG Jin-jie, CHU Yin, et al. Determination of purine content in hairtail surimi by reversed-phase high performance liquid chromatography [J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(7): 192-198
[14]曲欣,林洪,隋建新.高效液相色谱法测定食品中嘌呤含量[J].中国海洋大学学报(自然科学版),2014,44(12):41-47 QU Xin, LIN Hong, SUI Jian-xin. Determination of food purine count with high performance liquid chromatography [J].Ocean University of China (Natural Science), 2014, 44(12):41-47
[15]王静莹,薄海波,吉生军,等.高效液相色谱法测定牛羊杂碎等肉类中嘌呤及尿酸[J].食品与发酵工业,2017,43(4):232-237 WANG Jing-ying, BO Hai-bo, JI Sheng-jun, et al.Determination of purine and uric acid in cooked chopped entrails of cattle and sheep etc. meat by high performance liquid [J]. Food and Fermentation Industries, 2017, 43(4): 232-237
[16]凌云,王新宴,雍炜,等.高效液相色谱法检测肉类食品中4种嘌呤碱[J].分析化学,2008,36(6):724-728 LING Yun, WANG Xin-Yan, YONG Wei, et al. Determination of four purines in meat by high performance liquid chromatography [J]. Chinese Journal of Analytical Chemistry,2008, 36(6): 724-728
[17]刘少林,李梅青,丁之恩.HPLC法测定大豆中嘌呤含量的研究[J].安徽农业大学学报,2009,36(4):674-676 LIU Shao-lin, LI Mei-qing, DING Zhi-en. Determination of purine content in soybean by HPLC [J]. Journal of Anhui Agricultural University, 2009, 36(4): 674-676
[18]秦秀玲.痛风病人的饮食研究进展[J].医学动物防治,2007,23(9):661-664 QIN Xiu-ling. Research on the diet of gout patients [J].Medical Animal Control, 2007, 23(9): 661-664
[19]刘桂英,杨海斌,张加玲.菌类食品中嘌呤含量高效液相色谱测定[J]. 中国公共卫生,2012,28(4):554-555 LIU Gui-ying, YANG Hai-bin, ZHANG Jia-ling.Determination of purine content in bacterial food [J]. Chin. J Public Healt, 2012, 28(4): 554-555
[20]陈月菊.几种常见食用菌嘌呤含量测定及其加工中动态变化研究[D].南京:南京农业大学,2012 CHEN Yue-ju. Determination of Purine Bases in edible fungus and the dynamic changes of purines in the process [D].Nanjing: Nanjing Agricultural University, 2012
[21]荣胜忠,叶红婷,关红军,等.不同种类鲜菌、干菌食品中嘌呤含量的比较研究[J].中国食物与营养,2014,20(3):62-64 RONG Sheng-zhong, YE Hong-ting, GUAN Hong-jun, et al.Analysis on purine in different kinds of fresh fungi and dried fungi [J]. Food and Nutrition in China, 2014, 20(3): 62-64
[22]Kaneko K, Aoyagi Y, Fukuuchi T, et al. Total purine and purine base content of common foodstuffs for facilitating nutritional therapy for gout and hyperuricemia [J]. Biological& Pharmaceutical Bulletin, 2014, 37(5): 709-721
[23]谢芳钦,陈爱平,罗朝晨,等.常见饮品中嘌呤含量的测定[J].中国预防医学杂志,2013,7:551-552 XIE Fang-qin, CHEN Ai-ping, LUO Chao-chen, et al. The determination of purine content in common beverages [J].Chinese Preventive Medicine, 2013, 7: 551-552
[24]木易.“液体面包”-啤酒[J].企业经济,1982,8:40 MU Yi. "Liquid bread" - beer [J]. Enterprise Economy, 1982, 8:40
[25]林先军,李永仙,李崎,等.反相离子对色谱法测定啤酒中的嘌呤类物质[J].食品科学,2006,27(9):219-222 LIN Xian-jun, LI Yong-xian, LI Qi, et al. Determination of purine compounds in beer by reversed-phase ion pair chromatography [J]. Food Science, 2006, 27(9): 219-222
[26]李惠萍,何熙,钟晓盈,等.低嘌呤啤酒的研制[J].中外酒业·啤酒科技,2015,11:12-15 LI Hui-ping, HE Xi, ZHONG Xiao-ying, et al. The development of low purine beer [J]. Global Alcohol Industry Information, 2015, 11: 12-15
[27]商曰玲,杜金华.不同成品啤酒中嘌呤含量的测定[J].食品与发酵工业,2009,7:146-150 SHANG Yue-ling, DU Jin-hua. Determination of purine contents in different beers [J]. Food and Fermentation Industries, 2009, 7: 146-150
[28]刘春凤,李崎,李永仙,等.固相萃取-反相高效液相色谱法测定小麦中的嘌呤类物质[J].食品与生物技术学报,2008,27(5):120-123 LIU Chun-feng, LI Qi, LI Yong-xian, et al. Determination of purines in wheat by solid phase extraction-reverse phase high performance liquid chromatography [J]. Journal of Food Science and Biotechnology, 2008, 27(5): 120-123
[29]钟宁,李芳,刘兆霖,等.高效液相色谱法测定鹿茸血酒中嘌呤类物质[J].现代预防医学,2012,39(21):5652-5654,5656 ZHONG Ning, LI Fang, LIU Zhao-lin, et al. Determination of purine substances in the velvet antler blood wine by high performance liquid chromatography [J]. Modern Preventive Medicine, 2012, 39(21): 5652-5654, 5656
[30]杨祥根,密招顺.啤酒中嘌呤类物质的检测[J].啤酒科技,2013,12:51-53 YANG Xiang-gen, MI Zhao-shun. Detection of purines in beer[J]. Beer Tech., 2013, 12: 51-53
[31]Rong S, Zou L, Zhang Y, et al. Determination of purine contents in different parts of pork and beef by high performance liquid chromatography [J]. Food Chemistry, 2015,170: 303
[32]张志宏,陈松康,林昕晨,等.GC测定硫唑嘌呤中吡啶残留量[J].中国现代应用药学,2008,25(6):540-542 ZHANG Zhi-hong, CHEN Song-kang, LIN Xin-chen, et al.GC determination of pyridine residue in thiazole [J]. Chinese Journal of Modern Applied Pharmacy, 2008, 25(6): 540-542
[33]Klampfl C W, Himmelsbach M, Buchberger W, et al.Determination of purines and pyrimidines in beer samples by capillary zone electrophoresis [J]. Analytica Chimica Acta,2002, 454(2): 185-191
[34]LuLiu, JinOuyang, WillyR G. Baeyens. Separation of purine and pyrimidine bases by ion chromatography with direct conductivity detection [J]. Journal of Chromatography A, 2008,1193: 104-108
[35]胡奇杰,王新财,叶秀娟,等.太湖青虾中嘌呤总量测定方法的研究[J].食品工业,2014,11:210-214 HU Qi-jie, WANG Xin-cai, YE Xiu-juan, et al. Methods study for determ ination of total am ount of purine in taihu shrimp by diazotization-xanthine oxidase [J]. The Food Industry, 2014,11: 210-214
[36]刘军霞,李文杰.浅析高效液相色谱在药物分析中的应用[J].生物技术世界,2014,1:96-97 LIU Jun-xia, LI Wen-jie. Analysis of high performance liquid chromatography (HPLC) in drug analysis [J]. Biotech World,2014, 1: 96-97
[37]Brule D, Sarwar G, Savoie L. Effect of methods of cooking on free and total purine bases in meat and fish [J]. Canadian Institute of Food Science and Technology Journal, 1989, 22(3):248-251
[38]FAN H, YANG F Q, LI S P. Determination of purine and pyrimidine bases in natural and cultured Cordyceps, using optimum acid hydrolysis followed by high performance liquid chromatography [J]. Journal of Pharmaceutical & Biomedical Analysis, 2007, 45(1): 141
[39]Li H. Determination of Purines in Beer by HPLC Using a Simple and Rapid Sample Pretreatment [J]. Journal of the American Society of Brewing Chemists, 2015, 73(2): 137-142
[40]何炘,陈静波,郑国庚,等.嘌呤检测的研究进展[J].食品研究与开发,2010,31(8):199-202 HE Xin, CHEN Jing-bo, ZHENG Guo-geng, et al. The development of purine determination [J]. Food Research and Development, 2010, 31(8): 199-202
[41]Brulé D, Sarwar G, Savoiet L. Purine content of selected canadian food products [J]. Journal of Food Composition and Analysis, 1988, 1(2): 130-138
[42]尤玉如,张艳萍,刘士旺.HPLC法测定啤酒中嘌呤含量的方法研究[J].中国酿造,2008,27(3):76-79 YOU Yu-ru, ZHANG Yan-pin, LIU Shi-wang. Determination of purine contents in beer by HPLC [J]. China Brewing, 2008,27(3): 76-79
[43]曲欣.水产品中嘌呤含量分布及其在贮藏加工中变化规律的研究[D].青岛:中国海洋大学,2013 QU Xin. Study on the contents and change rules during processingand storage of purine in aquatic foods [D]. Qingdao:Ocean University of China, 2013
[44]Havlik J, Plachy V, Fernandez J, et al. Dietary purines in vegetarian meat analogues [J]. Journal of the Science of Food& Agriculture, 2010, 90(14): 2352-2357
[45]程庆红,张颖,孟凡艳,等.微波与超声波提取贻贝中嘌呤物质的方法研究[J].应用化工,2015,2:311-313 CHENG Qing-hong, ZHANG Ying, MENG Fan-yan, et al.Comparative study of microwave and ultrasonic extraction methods of purine substances in mussels [J]. Applied Chemical Industry, 2015, 2: 311-313
[46]刘秀艳.HPLC法测定地龙中次黄嘌呤含量[J].辽宁中医杂志,2007,34(12):1783 LIU Xiu-yan. Determine the content of subxanthine in the dragon by HPLC [J]. Liaoning Journal of Traditional Chinese Medicine, 2007, 34(12): 1783
[47]赵晓莉,崔小兵,狄留庆,等.HPLC 法测定海马中次黄嘌呤、黄嘌呤的含量[J].中药材,2002,25(10):716-717 ZHAO Xiao-li, CUI Xiao-bin, DI Liu-qing, et al. Determine the content of xanthine and xanthine in the hippocampus by HPLC [J]. Traditional Chinese Medicine, 2002, 25(10):716-717
[48]程庆红.海鲜食品中嘌呤类物质的提取与测定[D].长春:吉林大学,2008 CHENG Qing-hong. Extraction and determination of purines in seafood [D]. Changchun: Jilin University, 2008
[49]宋晶萍,朱敏.HPLC测定鹿胎软胶囊中4种嘌呤的含量[J].中药材,2014,37(1):19-21 SONG Jing-ping, ZHU Min. Determination of four kinds of purines in deer fetus soft capsule by HPLC [J]. Traditional Chinese Medicine, 2014, 37(1): 19-21
[50]宋学英,杨华.色谱柱的选择及应用[J].分析仪器,2016,6:84-88 SONG Xue-ying, YANG Hua. Selection and application of chromatographic column [J]. Analytical Instrumentation, 2016,6: 84-88
[51]郑伟,孙东方.高效液相色谱柱的选择、使用与维护[J].口腔护理用品工业,2011,6:37-39 ZHENG Wei, SUN Dong-fang. High performance liquid chromatographic column selection, use and maintenance [J].Toothpaste Industry, 2011, 6: 37-39
[52]李瑞萍,袁琴,黄应平.硅胶色谱柱的亲水作用保留机理及其影响因素[J].色谱,2014,32(7):675-681 LI Rui-ping, YUAN Qin, HUANG Ying-ping. Hydrophilic interaction chromatography on silica column: retention mechanism and its influential factors [J]. Chinese Journal of Chromatography, 2015, 32(7): 675-681
[53]毛玉涛,张洪,王明力.HPLC 法测定豆浆中的嘌呤含量[J].食品与发酵工业,2015,41(2):207-211 MAO Yu-tao, ZHANG Hong, WANG Ming-li. Determination of purine in soybean milk by HPLC [J]. Food and Fermentation Industries, 2015, 41(2): 207-211
[54]刘成梅,游海.天然产物有效成分的分离与应用[M].北京:化学工业出版社,2003 LIU Cheng-mei, YOU Hai. Separation and application of the effective components of natural products [M]. Beijing:Chemical Industry Press, 2003
[55]Inazawa K, Sato A, Kato Y, et al. Determination and Profiling of Purines in Foods by Using HPLC AND LC-MS [J].Nucleosides Nucleotides & Nucleic Acids, 2014, 33(4-6):439-444
