鹿茸抗氧化多肽高压脉冲电场辅助酶法提取及纯化工艺优化
2018-05-31薇JIANGWei金声琅殷涌光
姜 薇JIANG Wei 金声琅 - 殷涌光 -
(1. 黄山学院旅游学院,安徽 黄山 245041; 2. 吉林大学生物与农业工程学院,吉林 长春 130022)
目前,抗氧化剂及其化学性质引起了很多科学家研究的热潮。由于体内外的氧化压力使人体产生一系列问题,引发很多的致命性疾病,如癌症、动脉硬化、心血管疾病、糖尿病、神经紊乱等[1]。蛋白质经酶降解后释放出的生物活性肽能有效清除体内过剩的自由基、螯合金属离子、抑制脂质过氧化的发生等避免机体被氧化产生损伤[2]。消费者以及生产厂商更倾向于“天然”食品的抗氧化剂对人体的低损害性,因此从安全无污染的食品中提取天然抗氧化活性多肽已成为研究热点。
中国是世界上的鹿产业大国,鹿茸是绝大多数雄性鹿科动物生长的一种尚未骨化的幼角,也是一种珍贵的具有滋补作用的中药,主要被加工成鹿茸精作为药用,且年产量可达20万瓶之多[3]。但是对于生产鹿茸精过程中的副产物——鹿茸渣却没有充分利用。目前,仅有关于鹿茸渣酸解制备氨基酸、酶法提取硫酸软骨素、熬制鹿茸渣胶的研究[4],都存在加工工艺复杂,提取及利用率低的缺点。
高压脉冲电场技术(high intensity pulsed electric fields, PEF)是食品非热加工技术之一,被广泛地应用于食品的杀菌处理[5]、酒的催陈[6]、物料的提取[7]等。在较高电场强度下,大部分的酶均会有不同程度损坏而失活[8],但是少数的几种酶在适宜的电场强度下活性会增加[9],并且能够显著提高酶解反应产物得率,还未见高压脉冲电场促进菠萝蛋白酶解反应的相关报道。
本研究以鹿茸渣蛋白水解度及抗氧化活性为试验指标,选用菠萝蛋白酶为水解用酶,通过单因素试验研究底物浓度、酶浓度、电场强度、脉冲数等对降解鹿茸渣蛋白的影响,并采用响应面分析优化酶解工艺条件,以提高鹿茸渣制备抗氧化肽的酶解效率及缩短反应时间。最后用D201-C大孔树脂对水解液进行除盐和粗分,获得具有高抗氧化活性的鹿茸抗氧化肽组分,从而为利用鹿茸渣生产抗氧化活性多肽提供一定的理论参考和试验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
鹿茸渣:中韩动物研究院;
1,1-二苯基-2-三硝基苯肼(DPPH)、水杨酸、磷酸氢二钠、磷酸二氢钠等:分析纯,北京化工厂;
DA201-C大孔树脂:廊坊淼阳化工有限公司;
菠萝蛋白酶:300 U/mg,上海宝曼生物有限公司。
1.1.2 主要仪器设备
高速离心机:KEN-002-TY4624型,美国Kendro公司;
紫外可见分光光度仪:TU-1810型,北京普析通用仪器有限责任公司;
高压脉冲电场设备:实验室自制(电场操作系统设计详见文献[10]);
喷雾干燥机:SP-1500型,上海顺义实验设备有限公司;
上海雷磁电导率仪:DDS-307型,上海右一仪器有限公司;
水浴恒温振荡器:SHA-C型,金坛市恒丰仪器厂。
1.2 方法
1.2.1 检测方法
(1) 水解度(DH)的测定:根据文献[11]。
(2) DPPH·清除率的测定:根据文献[12]。
(3) ·OH清除率的测定:根据文献[13]。
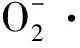
1.2.2 PEF下酶解反应的单因素试验
(1) 固定电场强度5 kV/cm,脉冲数6,酶添加量6 U/mg,用磷酸缓冲溶液调鹿茸渣水溶液pH至7.0,分别考察不同底物浓度(5%,10%,15%,20%,25%)对鹿茸蛋白水解度和水解液抗氧化活性的影响。
(2) 固定电场强度5 kV/cm,脉冲数6,底物浓度15%,用磷酸缓冲溶液调pH至7.0,分别考察不同酶添加量(1,3,5,7,9 U/mg)对鹿茸蛋白的水解度和水解液抗氧化活性的影响。
(3) 固定脉冲数6,底物浓度15%,酶添加量7 U/mg,用磷酸缓冲溶液调pH至7.0,分别考察不同电场强度(0,5,10,15,20,25 kV/cm)对鹿茸蛋白水解度和水解液抗氧化活性的影响。
(4) 固定电场强度15 kV/cm,底物浓度15%,酶添加量7 U/mg,用磷酸缓冲溶液调pH至7.0,分别考察不同的脉冲数(4,6,8,10,12)对鹿茸蛋白水解度和水解液抗氧化活性的影响。
1.2.3 PEF下酶解反应多因素试验 根据中心设计试验原理,综合单因素试验结果,固定底物浓度15%,pH 7.0,考察菠萝蛋白酶浓度、电场强度和脉冲数对酶解液抗氧化活性的影响,根据试验结果确定最佳制备工艺。
1.2.4 大孔吸附树脂脱盐及分离 利用大孔吸附树脂去除酶解反应过程中添加的无机盐,并对鹿茸抗氧化肽进行纯化。将一定体积处理好的湿树脂慢慢装入Φ1.5 cm×50 cm 的玻璃柱中,用去离子水洗至洗脱液在220 nm处的吸光值平稳,用1 BV/h的流速上样,上样体积50 mL。然后用去离子水和不同浓度(25%,50%,75%,100%)乙醇作为洗脱剂,对吸附后树脂进行洗脱。收集洗脱液,用紫外分光光度计在220 nm处测吸光值,用电导率检测洗脱液中的离子强度。
2 结果与分析
2.1 单因素试验
2.1.1 底物浓度对酶解反应的影响 由图1可以看出,随着底物的增加,鹿茸蛋白的水解度先增加后减少,当底物浓度为15%时,鹿茸蛋白的水解度[(14.23±0.11)%]及清除DPPH·的能力[(72.42±0.09)%]均达到最大值,当底物浓度过高时,由于底物浓度超过了蛋白酶能降解的底物量,所以水解度反而降低。这是因为酶解位点是一定的,酶相对于底物的酶切位点不足,且过高的底物浓度降低了水解产物的分子运动速率,从而降低酶与酶切位点的接触几率[15]。这一结果和姜惠敏等[16]制备羊胎盘抗氧化肽的变化趋势相似。
2.1.2 酶添加量对酶解反应的影响 由图2可以看出,酶添加量从1 U/mg增加到7 U/mg时,鹿茸蛋白水解度和水解液的DPPH·清除率呈直线上升趋势,在7 U/mg时达到最大值,随后水解度和水解液的DPPH·清除率反而下降,与唐梦茹等[17]的研究结果相似。这是因为在酶相对于底物达到饱和之前,随着酶添加量的增加,可以使酶与底物的接触机率增高,底物被水解的程度也随之增加,但当底物相对酶浓度达到饱和时,酶的进一步添加反而导致酶分子之间起到竞争性抑制作用,增加试验的操作成本[18]。故酶的最优添加量为7 U/mg。
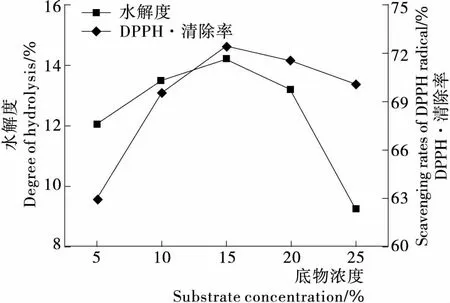
图1 底物浓度对鹿茸蛋白水解度和DPPH·清除率的影响
Figure 1 The influence of substrate concentration on degree of hydrolysis and scavenging rates of DPPH·
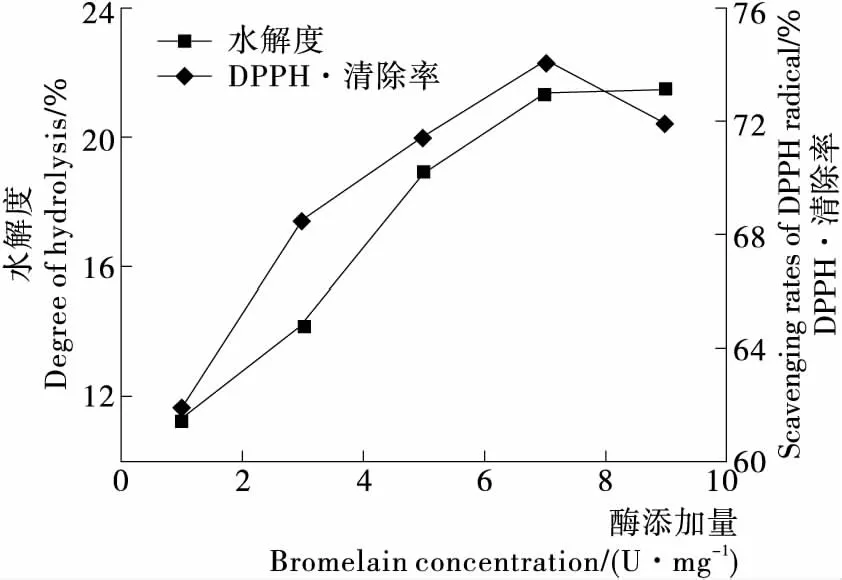
图2 酶添加量对鹿茸蛋白水解度和DPPH·清除率的影响
Figure 2 The influence of enzyme concentration on degree of hydrolysis and scavenging rates of DPPH·
2.1.3 电场强度对酶解反应的影响 由图3可以看出,电场强度对鹿茸蛋白的水解度和水解液抗氧化活性的影响很明显。电场强度为15 kV/cm时鹿茸蛋白的水解度和水解液抗氧化活性最高,与菠萝蛋白酶在此电场条件下的活力最高相一致(图4)。这是因为在适宜的电场强度下,酶的结构被改变,活性中心暴露出来提高了蛋白酶的活性[19];同时物料的细胞膜也可被电场击穿而导致细胞内容物渗出,提高酶与底物的接触机会。
2.1.4 脉冲数对酶解反应的影响 从图5可以看出,随脉冲数从2增加到12,鹿茸蛋白的水解度和水解液抗氧化活性先增加后减少,当脉冲数为8时达到最大值。在相同的流量下,反应时间与脉冲数有关,因此当脉冲数增加时,反应时间增加,酶的活性变得不稳定,所以过高的脉冲数反而不利于酶的溶解反应[20]。这一结果可以从图6中脉冲数对菠萝蛋白酶活力的影响得到验证。
2.2 响应面优化试验
2.2.1 试验设计及结果 试验因素水平设计见表1,试验设计与结果见表2。
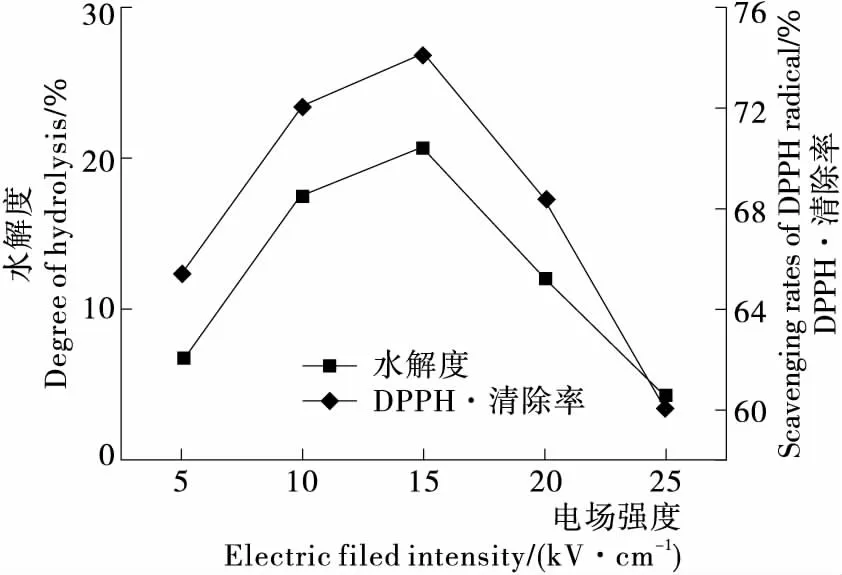
图3 电场强度对鹿茸蛋白水解度和DPPH·清除率的影响
Figure 3 The influence of electric field strength on degree of hydrolysis and scavenging rates of DPPH·
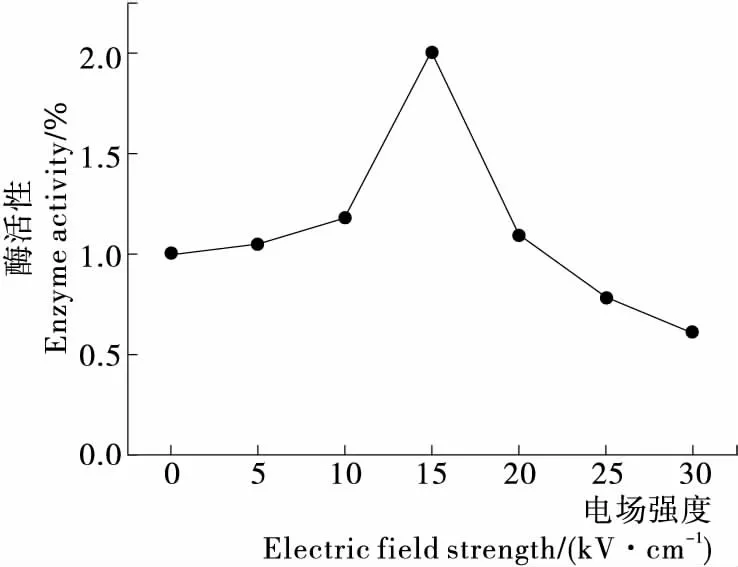
图4 电场强度对菠萝蛋白酶活性的影响Figure 4 The influence of electric field strength on enzyme activity

图5 脉冲数对鹿茸蛋白水解度和DPPH·清除率的影响
Figure 5 The influence of pulses number on degree of hydrolysis and scavenging rates of DPPH·
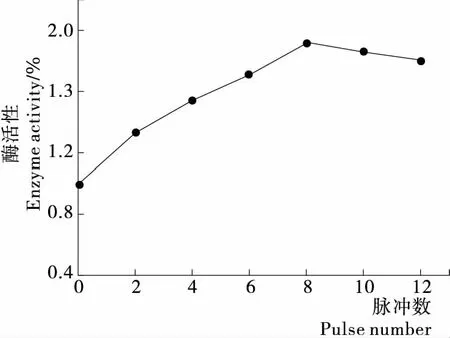
图6 脉冲数对菠萝蛋白酶活性的影响Figure 6 The influence of pulses number strength on enzyme activity

表1 响应面优化试验因素水平编码Table 1 Factors and levels of RSM optimization experiments

表2 响应面法优化方案及试验结果Table 2 Design and experimental results of RSM
2.2.2 模型建立与数据分析 用Design Expert 7.0软件对试验结果进行回归分析,得到鹿茸蛋白水解液对DPPH·清除率与电场强度、酶添加量、脉冲数之间的二次回归方程为:
(1)
去除不显著项后的公式为:
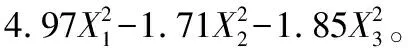
(2)
从方程中可以看出电场强度和脉冲数对水解液清除DPPH·的能力起到正影响,酶添加量对其抗氧化活性起到负面影响,但是电场强度和脉冲数均可以对酶添加量产生负面影响。各项的二次方均为负面影响,即因素值的大量提高都不利于抗氧化活性肽的产生,只能小幅度的调节三者的比例,才能酶解出高抗氧化活性的多肽溶液。
从表3中可以看出,回归模型的P<0.000 1,表明试验设计得出的二次方程模型达到了极显著水平,该模型可以用来分析和预测鹿茸蛋白酶解制备抗氧化多肽的效果。同时模型失拟项(0.172 8)不显著,说明试验误差较小,回归方程与实际值相似度较高。对水解液清除DPPH·的能力影响最显著的是电场强度(P<0.000 1),其次为酶添加量(P<0.05),最后为脉冲数。各因素的二次方值对水解液的抗氧化活性的影响均较显著(P<0.01),电场强度与脉冲数的交互作用较显著(P<0.01),其次为酶添加量与电场强度(P<0.05),最后为酶添加量与脉冲数没有交互作用。说明在设定的脉冲数范围内,酶的活性受电场强度的影响较明显,从而导致水解液抗氧化活性能力的提高。
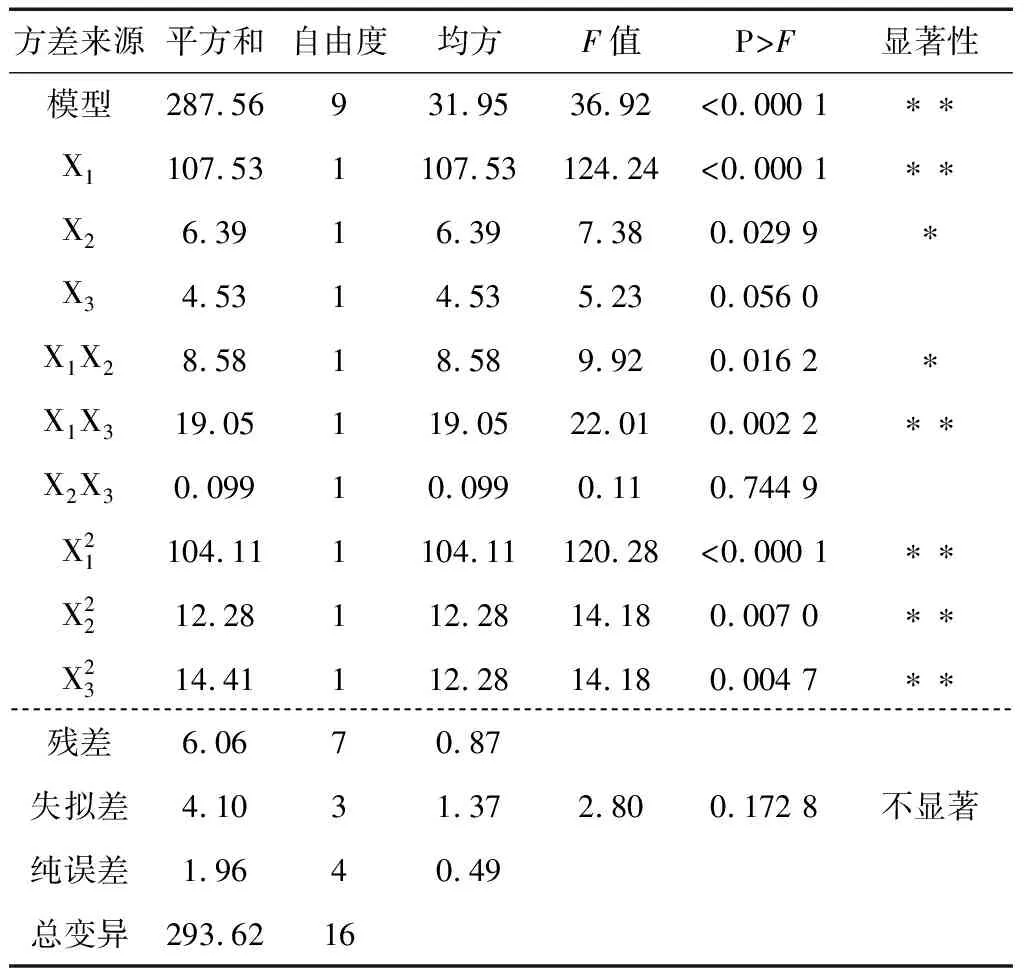
表3 响应面模型方差分析†Table 3 ANOVA for the response surface quadratic model
† P>F的值小于0.05,影响显著(*);P>F的值小于0.01,极其显著(**)。
从图7和8可知,电场强度与酶添加量之间具有显著的交互作用,其次是场强和脉冲数,这与表3结果一致。采用分析软件分析得到鹿茸蛋白酶解制备抗氧化肽的最佳工艺条件:电场强度17.3 kV/cm,脉冲数7.18、酶添加量7.04 U/mg,根据高压脉冲电场实际操作条件,脉冲数调整为7。此时鹿茸酶解液的DPPH·清除率可达74.49%。为了检验模型与实际值的相似性,将试验条件调整为最佳参数值,进行3次平行试验,测定酶解液清除DPPH·的活性为(74.76±2.03)%,理论预测值与实际值非常接近,从而进一步验证了回归模型的合适性。
2.3 鹿茸抗氧化肽的大孔吸附树脂脱盐及纯化
DA201-C大孔树脂对鹿角茸多肽的除盐和粗分洗脱曲线见图9。DA201-C大孔树脂的疏水性能很强,有机物质通过疏水基团可以吸附到大孔树脂的表面上。鹿茸蛋白经菠萝蛋白酶水解后,随着蛋白质中肽键的断裂,蛋白分子的构象发生了改变,蛋白质分子内的疏水氨基酸被暴露出来,从而使蛋白质混合物的疏水性增加,而吸附到树脂上。相反,无机盐不能吸附到大孔树脂上,可以被去离子水洗脱下来,从而与多肽分开,而达到除盐的效果[21-22]。根据乙醇溶液能改变多肽溶液的非极性侧链的排水倾向,从而可以将多肽从树脂上置换到洗脱液中,而被洗脱下来,疏水性越高的多肽,洗脱的乙醇浓度越高[23]。
2.4 纯化多肽抗氧化能力


图7 电场强度和脉冲数交互作用等高线图和响应面图Figure 7 Response surface and contour plots for the interaction effects of electric filed intensity and pulse number

图8 电场强度和酶添加量交互作用等高线图和响应面图Figure 8 Response surface and contour plots for the interaction effects of electric filed intensity and bromelain concentration
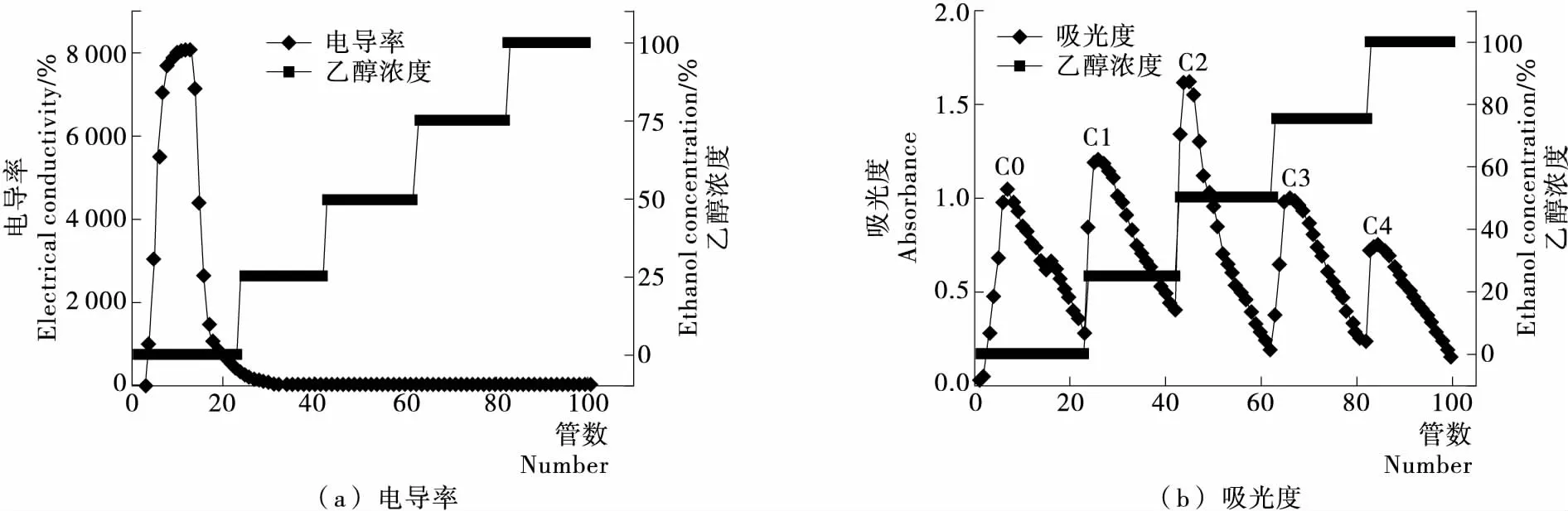
图9 鹿茸多肽除盐和粗分的洗脱曲线Figure 9 The desorption curves of desalination and separation of antler peptides
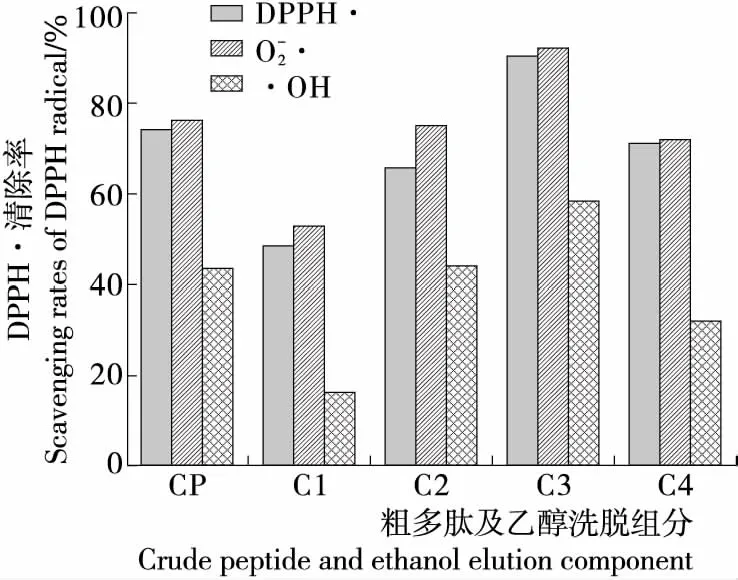
图10 粗多肽及各洗脱部分的抗氧化活性Figure 10 Antioxidant activities of crude peptide and each fraction
3 结论

[1] MILIAUSKAS G, VAN-BEEK T A, VENSKUTONIS P R, et al. Antioxidant activity ofpotentilla fruticosa[J]. Journal of the Science of Food & Agriculture, 2004, 84(15): 1 997-2 009.
[2] JUNG M Y, KIM S K, KIM S Y. Riboflavin-sensitizedphotooxidation of ascorbic acid kinetics and amino acid effects[J]. Food Chemistry, 1995, 53: 397-403.
[3] JIANG Wei, YIN Yong-guang, ZHOU Ya-jun, et al. Fast hydrolysis of antler residue (Comucervipantotrichum) by pulsed electric field assisted pepsin[J]. Journal of Pure and Applied Microbiology, 2013, 7: 621-629.
[4] 庄兰英, 腾欧. 生产鹿茸精副产品——鹿茸渣胶成分分析与利用[J]. 特产科学实验, 1983(2): 50-51.
[5] ANGERSBACH A, HEINZ V, KNORR D. Effects of pulsed electric fields on cell membranes in real food systems[J]. Innovative Food Science & Emerging Technologies, 2000, 1(2): 135-149.
[6] 刘学军, 殷涌光, 范松梅, 等. 高压脉冲电场催陈葡萄酒香气成分变化的GC-MS分析[J]. 食品科学, 2006, 27(12): 654-657.
[7] YIN Yong-guang, HE Gui-dan. A fast high-intensity pulsed electric fields (PEF)-assisted extraction of dissoluble calcium from bone[J]. Separation and Purification Technology, 2008, 61(2): 148-152.
[8] YANG R J, LI S Q, ZHANG Q H. Effects of pulsed electric fields on the activity of enzymes in aqueous solution[J]. Journal of Food Science, 2004, 69(4): 241-248.
[9] OHSHIMA T, TAMURA T, SATO M. Influence of pulsed electric field on various enzyme activities[J]. Journal of Electrostatics, 2007, 65: 156-161.
[10] 赵武奇, 殷涌光, 关伟, 等. 超高压脉冲电场杀菌系统设计与试验[J]. 农业机械学报, 2002, 33(3): 67-69.
[11] SAITO M, KUNISAKI N, URANO N, et al. Collagen as the major edible component of sea cucumber (Stichopusjaponicus) [J]. Journal of Food Science, 2002, 67(4): 1 319-1 322.
[12] MILARDOVIC S, IVEKOVIC D, GRABARIC B S. A novelamperometric method for antioxidant activity determination using DPPH free radical[J]. Bioelectrochemistry, 2006, 68(2): 175-180.
[13] 王运改, 林琳, 李明辉, 等. 鮰鱼皮明胶抗氧化肽的制备工艺研究[J]. 食品科学, 2010, 31(19): 254-258.
[14] 何小庆, 曹文红, 章超桦, 等. 波纹巴非蛤蛋白酶解产物的抗氧活性及分子量分布研究[J]. 现代食品科技, 2014, 30(1): 74-80.
[15] 张杨, 胡磊, 汪少芸, 等. 响应面优化酶解法制备蒲公英籽蛋白抗氧化肽工艺[J]. 食品工业科技, 2016, 37(5): 258-262.
[16] 姜惠敏, 李明, 曹光群, 等. 酶解制备羊胎盘抗氧化肽工艺条件的优化[J]. 食品与生物技术学报, 2017, 36(1): 98-104.
[17] 唐梦茹, 陈涛涛, 汪少芸, 等. 响应面优化酶解法制备韭菜籽蛋白抗氧化肽工艺[J]. 中国食品学报, 2016, 16(4): 159-165.
[18] 毛银, 朱科学, 张士康, 等. 响应面优化酶法制备茶叶蛋白抗氧化肽的工艺研究[J]. 食品工业科技, 2013, 34(7): 169-173.
[19] 韦汉昌, 韦群兰, 韦善清. 高压脉冲电场提取猪皮胶原蛋白[J]. 广西科学, 2011, 18(3): 235-237.
[20] 刘唯佳. 鹿茸中水溶性蛋白质的提取及鹿茸综合利用的研究[D]. 长春: 吉林大学, 2013: 47.
[21] 任清, 张晓平, 赵世峰, 等. 利用大孔吸附树脂DA201-CⅡ对燕麦蛋白水解液脱盐的研究[J]. 食品科学, 2009, 30(10): 118-122.
[22] 孙旭, 肖志刚, 马秀婷, 等. 大孔吸附树脂对玉米蛋白水解液脱盐效果的研究[J]. 食品与机械, 2012, 28(6): 43-46.
[23] ZHANG Feng-xiang, WANG Zhang, XU Shi-ying. Macropor-ous resin purification of grass carp fish (Ctenopharyngodonidella) scale peptides with in vitro angiotensin-I converting enzyme (ACE) inhibitory ability[J]. Food Chemistry, 2009, 117(3): 387-392.
[24] 张周莉, 李诚, 刘爱平, 等. 响应面优化酶解法制备猪肩胛骨抗氧化肽工艺[J]. 核农学报, 2017, 31(12): 2 358-2 366.
[25] 柯勤勤, 罗洋洋, 何林凌, 等. 草鱼鱼鳞抗氧化肽的酶法制备及其抗氧化稳定性研究[J]. 四川农业大学学报, 2017, 35(3): 433-451.
