天麻醇提物对灰树花胞外多糖单糖组成和生物活性的影响
2018-05-31芦红云吴天祥汤庆莉聂文强
芦红云, 吴天祥,2,*, 汤庆莉, 钟 敏, 聂文强
(1.贵州大学 酿酒与食品工程学院, 贵州 贵阳 550025; 2.贵州大学 明德学院, 贵州 贵阳 550025)
目前,绝大多数具有多种生物活性的多糖都来源于真菌,尤其是食用真菌,如香菇、灰树花、革盖菌属、裂褶菌属等[1]。韩建涛[2]对灰树花胞外多糖单糖组成进行分析,发现其单糖组分为甘露糖、葡萄糖和木糖,物质的量比为16.87∶1∶2.99。体内实验研究表明,灰树花多糖对提高免疫力和抑瘤效果显著[3]。Konno[4]利用灰树花胞外多糖与维生素C联用,发现灰树花D-组分对癌细胞表现出生长抑制。
研究表明,药用真菌在发酵转化中药时,中药成分不仅能刺激微生物生长,同时能参与到微生物的代谢之中,增加其次级代谢产物的生物活性[5-6]。本课题组前期研究结果表明,在灰树花液体发酵体系中添加天麻醇提物及其主要成分天麻素、对羟基苯甲醛、对羟基苯甲醇可显著促进灰树花产胞外多糖和菌丝体生长[7-10],其促胞外多糖增产的机理与有效提高灰树花胞外多糖合成酶酶活有关。本文希望通过研究加入了天麻醇提物的灰树花发酵的变化,进一步探明灰树花合成代谢产物胞外多糖变化机理、抑瘤活性、天麻醇提物对灰树花代谢增效等的影响。
1 材料与方法
1.1 材料、试剂及培养基
灰树花菌株(Grifolafrondosa,菌种编号:5.404),中国普通微生物菌种保藏管理中心;天麻(Rhizomagastrodiae),贵州省德江县天麻种植基地。
透析袋,Solarbio公司;甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、岩藻糖单糖标准品,上海源叶生物科技有限公司;其余试剂均为市售分析纯。
斜面培养基:马铃薯葡萄糖琼脂(PDA)培养基。液体种子培养基(g/L):葡萄糖30,蛋白胨2,酵母膏6,KH2PO40.5,MgSO4·7H2O 0.5。发酵培养基(g/L):葡萄糖50,蛋白胨5,酵母膏10,KH2PO42,MgSO4·7H2O 2。
1.2 仪器与设备
BXM-30R型立式灭菌锅,上海博讯实业有限公司医疗设备厂;RE-2000A型旋转蒸发器,上海亚荣生化仪器厂;SW-CJ-1D型净化工作台,苏州净化设备有限公司;TGL-20M型台式高速冷冻离心机,长沙迈佳森仪器设备有限公司;ZWY-C2112B型双层旋转式可编程恒温恒湿摇床,上海智诚分析仪器制造有限公司;Nicolet is50型原位漫反射傅里叶交换红外光谱仪,美国赛默飞世尔科技有限公司;CTFD-12S型真空冷冻干燥机,青岛永合创信电子科技有限公司;Agilent 1100型高效液相色谱仪及检测器、Agilent 5TC-C18型色谱柱,美国Agilent公司。
1.3 实验方法
1.3.1灰树花培养方法
1)灰树花菌株斜面培养。从母种试管中挑取黄豆粒大小菌丝块接种于PDA斜面中部,25 ℃恒温培养,至菌丝长满整个斜面,转置4 ℃保存。
2)灰树花液体种子培养。用接种勺在斜面菌种管中取1勺细小菌丝体,接种于液体种子培养基中,500 mL三角瓶装液量为200 mL,加入少许细小玻璃珠,于25 ℃、150 r/min摇床中培养6 d。
3)灰树花发酵培养。无菌条件下,按10%的接种量,用移液枪取10 mL种子液接于发酵培养基中,250 mL三角锥形瓶装液量为100 mL,150 r/min摇床25 ℃培养。
1.3.2天麻醇提物制备与添加
天麻洗净,55 ℃烘干,粉碎后过80目备用。准确称取上述10 g的天麻粉末,加入100 mL体积分数为75%的乙醇。25 ℃浸提48 h后过滤,60 ℃减压除去乙醇。加25 mL蒸馏水重溶后过滤,即得到2.5 mL/g的天麻醇提物(RG)。向灰树花发酵培养基中添加7 g/L的天麻醇提物,经高压高温灭菌冷却后,接入种子液,发酵培养12 d。
1.3.3灰树花胞外粗多糖制备
取2 mL的去菌丝体发酵液,加入4倍体积95%无水乙醇,于4 ℃冰箱中醇析24 h,取出后4 000 r/min离心15 min,取沉淀物加体积分数95%乙醇沉淀3次后,于60 ℃数显鼓风干燥箱中烘干即为粗多糖(CEPS)。
1.3.4灰树花胞外粗多糖纯化处理
上述醇析出的粗多糖用体积分数3%三氯乙酸脱蛋白,大孔吸附树脂D303脱色,经流水透析2 d,再经蒸馏水透析1 d后,于真空冷冻干燥机中干燥,得到纯化后的灰树花胞外多糖样品(PEPS)。
1.3.5灰树花胞外多糖样品中多糖及蛋白质含量测定
取10 mg多糖样品,用蒸馏水定容至50 mL,利用硫酸苯酚法[9]、考马斯亮比色法[11]分别对样品中多糖及蛋白质含量进行分析。葡萄糖标准曲线线性回归方程为:y=0.554 2x-0.003 5,R2=0.998 7。蛋白质标准曲线为y=8.740 5x+0.009 3,R2=0.999 2。
1.3.6灰树花多糖单糖组成测定
1)多糖样品酸水解。分别称取30 mg多糖样品,用蒸馏水准确配成30 mg/mL的溶液,加入4 mol/L的三氯乙酸1 mL,充氮气后密封,于110 ℃下水解2 h,冷却后,加入甲醇2 mL,混匀后于50 ℃旋转蒸干,重复3次,蒸干后加1 mL去离子水做衍生化反应。
2)多糖样品及单糖标准品1-苯基-3-甲基-5-吡啶碄酮(PMP)衍生化。参照文献[12],称取甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、岩藻糖标准品各2 mg,加入去离子水于5 mL容量瓶中定容,取等体积单糖标准液配成浓度为0.4 mg/mL的单糖标准混合液。
取灰树花多糖水解液及单糖标准品混合液各1 mL于10 mL离心管,加入1 mL 0.3 mol/L的NaOH,混匀后取上述混合液1 mL,添加1 mL 0.3 mol/L的PMP甲醇溶液,旋涡震匀后在70 ℃下反应100 min,冷却后用0.5 mL 0.3 mol/L HCl中和反应液。加2.5 mL氯仿萃取,震摇、静置,小心吸取水相(上层),重复3次除净PMP(此时氯仿层为无色)。0.45 μm滤膜过滤水相反应液后用HPLC检测。
3)多糖样品HPLC检测。色谱柱:Agilent 5TC-C18柱。流动相:0.1 mol/L磷酸盐缓冲溶液(pH值6.7)-乙腈,体积比为83∶17;柱温30 ℃,流速为1 mL/s。进样量20 μL,波长245 nm。
1.3.7红外光谱实验
取1~1.5 mg样品与200~300 mg KBr(样品与KBr质量比约为1∶200)于玛瑙研钵中研磨成混合均匀的粉末,用小药匙转入制片模具中于油压机10 t压力下保持2 min,撤去压力后取出制成的供试片,目视检测,应呈透明状,然后装入样品架上待检。
1.3.8灰树花胞外多糖生物活性检测
抗肿瘤活性物质筛选模型的检测方法采用磺酰罗丹蛋白染色法(SRB法),小鼠脾淋巴细胞增殖模型的检测方法采用四氮唑盐还原法(MTT法)。灰树花胞外多糖生物活性检测实验由贵州省中国科学院天然产物化学重点实验室药理与生物活性研究中心完成。
1.4 统计方法
采用SPSS 17.0软件分析实验数据显著性,Origin 7.5软件作图。在生物活性检测实验中样品每个浓度平行3次,重复2次,结果以M±SD表示。
2 结果与分析
2.1 多糖样品中多糖及蛋白质含量分析
灰树花胞外多糖样品主要由多糖组成(见表1)。经提取纯化后,使多糖成分进一步纯化,其中蛋白质成分无检出,说明纯化工序中脱蛋白彻底。

表1 胞外多糖样品中多糖及蛋白质质量分数Tab.1 Polysaccharide and protein content of exopolysaccharide samples %
2.2 灰树花胞外多糖的结构特征分析


图1 灰树花胞外粗多糖、精多糖红外光谱Fig.1 IR spectrum of CEPS and PEPS from G. frondosa

图2 添加天麻的灰树花胞外粗多糖、精多糖红外光谱Fig.2 IR spectrum of CEPS-RG and PEPS-RG from Grifola frondosa
2.3 单糖混合标准品分析
甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、岩藻糖标准品的HPLC色谱图和相应的保留时间分别见图3和表2。

图3 单糖标准品色谱Fig.3 HPLC spectrum of mixed monosaccharides standards
2.4 灰树花胞外粗多糖、精多糖单糖组成分析
添加天麻醇提物于灰树花发酵体系为实验组,未添加任何外源物的为对照组。添加天麻醇提物后灰树花胞外粗多糖未产生新的单糖组成,但单糖物质的量比改变显著,见图4、图5及表3。样品CEPS、CEPS-RG单糖组成中,葡萄糖含量最多,其次为甘露糖,同时检出含量相对较少半乳糖,或还含有鼠李糖。这也进一步从单糖组成的角度解释了红外光谱中胞外粗多糖未检测出明显的α构型的原因。
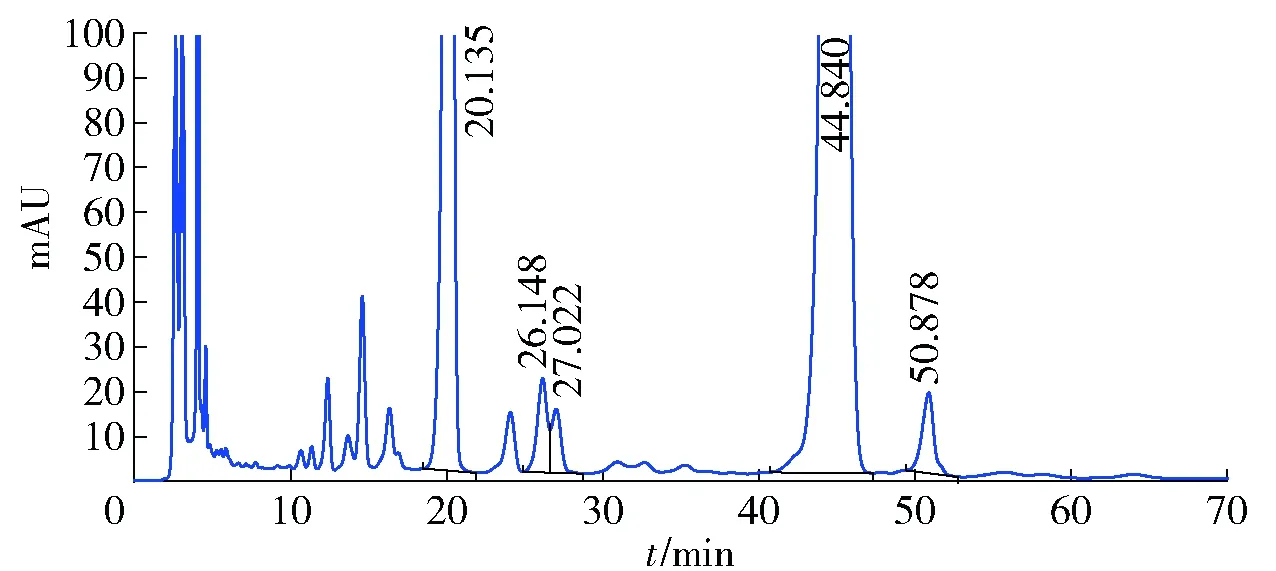
图4 CEPS样品色谱Fig.4 HPLC spectrum of CEPS from Grifola frondosa

图5 CEPS-RG样品色谱Fig.5 HPLC spectrum of CEPS-RG from Grifola frondosa
通过对比胞外多糖纯品实验组和对照组,发现检测得到的灰树花胞外多糖纯品主要由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、岩藻糖等单糖组分构成(见图6、图7)。其中,添加天麻醇提物对灰树花胞外多糖单糖组分产生明显变化,PEPS样品中上述6种单糖物质的量比依次为13.8∶3.9∶5∶3.7∶1∶1.7,而PEPS-RG样品单糖组分物质的量比12.7∶3.2∶5.6∶3.5∶1∶1.6(见表4)。通过对比单糖峰面积可知,天麻醇提物的加入能促进灰树花分泌鼠李糖、半乳糖、阿拉伯糖、岩藻糖等单糖成分。同时,由图7可知,天麻醇提物的加入并未使灰树花多糖产生新单糖组分。

表3 灰树花胞外粗多糖单糖组成物质的量比Tab.3 Monosaccharide mole ratio of crude exopolysaccharide in Grifola frondosa

图6 PEPS样品色谱Fig.6 HPLC spectrum of PEPS from Grifola frondosa
2.5 小鼠巨噬细胞(RAW264.7)活化实验结果
筛选方法:酶联免疫吸附测定法(ELISA法)检测巨噬细胞肿瘤坏死因子(TNF-α)的分泌表达。

图7 PEPS-RG样品色谱Fig.7 HPLC spectrum of PEPS-RG from Grifola frondosa

表4 灰树花胞外精多糖单糖组成物质的量比Tab.4 Monosaccharide mole ratio of pure exopolysaccharide in Grifola frondosa
模型原理:巨噬细胞在相关因素刺激下会活化,并分泌表达TNF-α。将样品或脂多糖(LPS)加入巨噬细胞中培养一定时间后,取细胞上清液测定TNF-α的含量,判断样品对细胞的活化作用,计算公式见式(1)。
活化指数=ρ样品(TNF-α)/ρ正常(TNF-α)。
(1)
PEPS-RG对巨噬细胞有明显的活化作用,PEPS、CEPS-RG对巨噬细胞有一定的活化作用,CEPS对巨噬细胞无明确的活化作用(见表5)。由结果可知,添加天麻醇提物能促进灰树花胞外多糖对巨噬细胞的免疫调节能力,Kim等[17]研究表明添加人参提取物能提高灵芝多糖对巨噬细胞的活化能力。这可能与天麻醇提物改变灰树花胞外多糖单糖组成有关。通过对比经纯化和未经纯化的胞外多糖对小鼠巨噬细胞RAW264.7的作用可知,经纯化后的灰树花胞外多糖对小鼠巨噬细胞有更强的活化作用,这可能与多糖经纯化后,具有生物活性的单糖含量增加有关。有研究表明多糖的单糖组成也与抗肿瘤活性相关,通常含有葡萄糖和甘露糖的多糖抗肿瘤活性较好,这主要是因为在人类巨噬细胞中已发现有葡萄糖和甘露糖受体,因而此种多糖具有高度特异性[18]。

表5 胞外多糖对小鼠巨噬细胞的作用Tab.5 Effect of exopolysaccharide on mouse macrophages cell
LPS为阳性对照。样品标准称量,按送样方要求用生理盐水溶解。
2.6 灰树花胞外多糖抗肿瘤活性筛选实验结果
筛选模型:人肝癌细胞HepG 2。筛选方法:四氮唑盐还原法(MTT法)。
模型原理:活细胞的线粒体中存在与NADP相关的脱氢酶,可将黄色的MTT还原为不溶性的蓝紫色Formanzan;死细胞此酶消失,MTT不被还原。本模型根据MTT的还原程度,来检测样品对肿瘤细胞的作用情况,计算公式见式(2)。
抑制率=[(对照组OD值-样品组OD值)/
对照组OD值]×100%。
(2)
所得的灰树花胞外多糖样品对人肝癌细胞HepG 2无体外抑制作用,见表6。造成该实验结果的原因一方面可能是因为活性多糖的来源、产地、提取方法不同,体外抑瘤的效果会有差别,同一种多糖的不同级分或亚级分也会有不同的抑瘤效果[16];另一方面或是因为与其他真菌多糖制剂类似,灰树花多糖抗癌的机理并非是直接杀死肿瘤细胞,而是通过激活机体免疫系统,增加巨噬细胞的吞噬作用,促进免疫球蛋白的形成,提高淋巴细胞转化率并提高机体本身的抗病能力,从而达到抵抗癌细胞生长,防止肿瘤转移,预防正常细胞癌变的目的[19]。许多动物实验表明抑制肿瘤转移的生物效应调节物与激活免疫有关[20]。一般认为,药用真菌的抗癌机理是多糖类成分,它可以调节免疫系统而间接地抑制肿瘤细胞[21-24]。多糖作为一种免疫增强剂,临床上常与其他化疗药物联用,用于治疗肿瘤,如岩藻多糖与顺钼、泰莫西芬、紫杉醇联用能增强对乳腺癌MCF-7和MDA-MB-231细胞的抗肿瘤活性[25]。Kim等[26]发现在灵芝深层发酵体系中加入人参提取物后分离得到的多糖,能刺激免疫系统抑制肿瘤转移,其体外抑制肿瘤细胞的活性可能与激活巨噬细胞,脾细胞和淋巴集结细胞有关。

表6 灰树花胞外多糖对人肝癌细胞HepG 2的作用Tab.6 Effect of exopolysaccharide on human hepatoma HepG 2 cells
阿霉素为阳性对照,分子质量为579.99。样品准确称量,按送样方要求用生理盐水溶解。
3 结 论
实验对天麻醇提物加入至灰树花液体发酵培养基后,所得到的胞外多糖单糖组成变化及抗肿瘤生物活性开展了研究。利用傅里叶红外光谱对所得到的4种胞外多糖样品进行结构分析,发现与未经纯化的灰树花胞外粗多糖相比,经纯化的胞外精多糖在875 cm-1、805 cm-1处有明显的特征吸收。这可能是灰树花多糖经纯化除杂后具有α构型的单糖增加的缘故。
利用HPLC对4种胞外多糖样品进行单糖组成分析,实验结果表明,未纯化的多糖样品主要由葡萄糖、甘露糖及少量的半乳糖等单糖构成,纯化后的多糖由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、岩藻糖等单糖构成。同时,根据检测结果可知,添加天麻醇提物对灰树花胞外多糖单糖组分含量产生明显变化,但并未使灰树花多糖产生新单糖组分;PEPS样品中其单糖物质的量比甘露糖∶鼠李糖∶葡萄糖∶半乳糖∶阿拉伯糖∶岩藻糖依次为13.8∶3.9∶5∶3.7∶1∶1.7,而PEPS-RG单糖组分物质的量比12.7∶3.2∶5.6∶3.5∶1∶1.6。通过对比单糖峰面积可知,天麻醇提物的加入,能促进灰树花分泌鼠李糖、半乳糖、阿拉伯糖、岩藻糖等单糖成分。
对多糖生物活性进行检测,由小鼠巨噬细胞(RAW264.7)活化实验结果可知,PEPS-RG对巨噬细胞有明显的活化作用,PEPS、CEPS-RG对巨噬细胞有一定的活化作用,CEPS对巨噬细胞无明确的活化作用。通过体外实验检测,发现4种多糖样品对人肝癌细胞HepG 2无抑制作用。
参考文献:
[1] FISHER M, YANG L X. Anticancer effects and mechanisms of polysaccharide-K (PSK): implications of cancer immuno-therapy[J]. Anticancer Research, 2002, 22:1737-1754.
[2] 韩建涛. 灰树花胞外多糖的液体发酵及其硫酸酯的制备[D]. 天津:天津科技大学, 2009:48-49.
[3] LIN C H,CHANG C Y, LEE K R, et al. Cold-water extracts ofGrifolafrondosaand its purified active fraction inhibit hepatocellular carcinomaininvitroandinvivo[J]. Experimental Biology and Medicine,2016,241(13):1374-1385.
[4] KONNO S. Synergistic potentiation of D-fraction with vitamin C as possible alternative approach for cancer therapy[J]. International Journal of General Medicine, 2009(2): 91-108.
[5] LI Y Q, YANG Y L, FANG L, et al. Anti-hepatitis activities in the broth ofGanodermalucidumsupplemented with a Chinese herbal medicine[J]. The American Journal of Chinese Medicine, 2006,34(2):341-349.
[6] KIM H, JEONG J H, HWANG J H, et al. Enhancement of immunostimulation and antimetastasis in submerged culture of bearded tooth mushroom (Hericiumerinaceum) mycelia by addition of ginseng extract[J].Food Science and Biotechnology, 2010, 19(5): 1259-1266.
[7] XU X B,WU T X, TANG Q L. Changes inGastrodiatuber ethanol extracts duringGrifolafrondosafermentation[J].Chemistry of Natural Compounds, 2016, 52(1):74-77.
[8] WU C Y, WU T X. Effect of the main ingredients ofRhizomagastrodiaeon mycelial biomass and exopolysaccharide productions by submerged culture ofGrifolafrondosa[J]. International Journal of Food Science and Techno-logy, 2015, 50(8):1726-1730.
[9] WANG N, WU T X, ZHANG Y, et al.Experimental analysis on the effect of addition ofRhizomagastrodiaeon mycelia and exopolysaccharide productions by submerged culture ofGrifolafrondosa[J]. African Journal of Biotechnology, 2012, 11 (20): 4666-4672.
[10] XU X B, WU T X, WANG F, et al. The effect of exopolysaccharide biosynthesis and related enzyme activi-ties ofGrifolafrondosaby the addition of ethanol extracts from traditional Chinese medicine,Gastrodiatuber[J]. African Journal of Biotechnology, 2012, 11(15): 3656-3662.
[11] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(7): 248-254.
[12] 马定远, 陈君, 李萍, 等. 柱前衍生化高效液相色谱法分析多糖中的单糖组成[J]. 分析化学, 2002, 30(6): 702-705.
MA D Y, CHEN J, LI P, et al. Analysis of monosaccharide composition in polysaccharides by high perfor-mance liquid chromatography (HPLC) [J]. Analytical Chemistry, 2002, 30(6): 702-705.
[13] 张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州:浙江大学出版社, 1994.
[14] ZHAO M M,YANG N,YANG B, et al. Structural characterization of water-soluble polysaccharides fromOpuntiamonacanthacladodes in relation to their anti-glycated activities[J]. Food Chemistry, 2007, 105(4): 1480-1486.
[15] 史宝军,张家骊,杨平平,等. 灰树花胞外多糖的分离纯化及其性质研究[J]. 药物生物技术, 2003, 10(5): 312-316.
SHI B J, ZHANG J L, YANG P P, et al. Studies on the isolation, purification and characterization of an extracellular polysaccharide fromGrifolafrondosa[J]. Pharmaceutical Biotechnology,2003,10(5):312-316.
[16] 李小定.灰树花多糖的结构及其生物活性[D]. 武汉:华中农业大学, 2002:78-90.
[17] KIM H, RA K S, HWANG J H, et al. Immune enhancement ofHericiumerinaceummycelium cultured in submerged medium supplemented with ginseng extract[J]. Korean Journal of Food & Nutrition, 2012, 25(4):737-746.
[18] 张琪琳. 香菇多糖的结构鉴定及抗肿瘤作用机制研究[D]. 武汉:华中科技大学, 2015: 45-60.
[19] MUKAI S, KATO H, KIMURA S, et al. Adoptive immunotherapy of poorly immunogenic tumors withinvitrosensitized cells generated by intratumoral administration of biological response modifiers[J]. International Journal of Immunopharmacology,1995, 17(12): 963-971.
[20] HISHIDA I.Antitumor and immunomodulating activity of the polisac-charide from body fruit ofGrifolafrondosa[J]. Chemical and Pharmaceutical Bulletin, 1988,36(5):18-19.
[21] 林志彬. 灵芝的现代研究[M]. 北京:北京医科大学出版社, 2001:225-233.
[22] KIM H Y,KIM J H,YANG S B, et al. A polysaccharide extracted from rice bran fermented withLentinusedodesenhances natural killed cell activity and exhibits anticancer effect[J]. Journal of Medicinal Food, 2007,10(1): 25-31.
[23] GIAVASIS L. Bioactive fungal polysaccharides as potential functional ingredients in food and nutracticals[J]. Current Opinion in Biotechnology, 2014, 26(7):162-173.
[24] XU Z T, CHEN X P, ZHONG Z F, et al.Ganodermalucidumpolysaccharides: immunmodulation an and potential antitumor activities[J]. American Journal of Chinese Medicine, 2011,39(1): 15-27.
[25] ZHANG Z, TERUYA K, YOSHIDA T, et al. Fucoidan extract enhances the anticancer activity of chemotherapeutic agents in MDA-MB-231 and MCF-7 breast cancer cells[J]. Marine Drugs, 2013, 11(1): 81-98.
[26] KIM H, PARK C K, JEONG J H. Immune stimulation and anti-metastasis of crude polysaccharide from submerged culture ofHericiumerinaceumin the medium supplemented with Korean ginseng extracts[J].Journal of Korean Society of Food Science and Nutrition,2009,38(11):1535-1542.
