我国市售食用菌中金黄色葡萄球菌污染调查、耐药性及其肠毒素基因检测
2018-05-31黄嘉慧张菊梅吴清平
黄嘉慧, 吴 诗, 张 峰,2, 张菊梅, 吴清平,*
(1.广东省微生物研究所/省部共建华南应用微生物国家重点实验室/广东省菌种保藏与应用重点实验室/广东省微生物应用新技术公共实验室, 广东 广州 510070;2.华南理工大学 生物科学与工程学院, 广东 广州 510006)
金黄色萄球菌(Staphylococcusaureus)(简称金葡菌)是引起细菌性食物中毒的重要食源性致病菌之一。在美国,金葡菌每年大约引起241 000例食物中毒[1];在我国,20%~25%的细菌性食物中毒病例是由金葡菌引起的[2]。金葡菌的肠毒素(Staphylococcalenterotoxins,SEs)是引发细菌性食物中毒最主要的因素。这些肠毒素可耐高温,不易失活,人体摄入几微克便可导致食物中毒[3-4]。伴随着抗生素的大量使用,细菌耐药性问题日趋严重,成为全球公共卫生体系面临的一个严峻挑战。研究表明,食品中的耐药菌、耐药基因可以通过食物链传播到人,从而对食品安全和人类健康造成严重危害。食用菌是我国主要的农产品,含有丰富的人体所需的营养物质,广受人们的青睐,然而,在食用菌培植、加工、贮藏、运输、销售等过程中,均可能受到各种微生物的污染[5]。此前,国内外并没有食用菌中金葡菌污染情况等相关调查研究。为全面了解我国市售食用菌中金葡菌的污染情况,本研究拟对全国39个城市市售食用菌的金葡菌污染情况进行系统调查,并在此基础上对分离到的金葡菌进行耐药性和肠毒素基因分析,了解和掌握我国市售食用菌源中金葡菌的遗传特性,希望为预防和控制我国食用菌中金葡菌的污染研究提供借鉴和参考。
1 材料与方法
1.1 样品采集
2011年7月至2016年6月,从全国39个城市的超市和集贸市场采集699份食用菌样品,包括220份金针菇,114份平菇,110份香菇,95份杏鲍菇,160份其他类型的食用菌样品(见表1)。采样地点覆盖我国大部分的省会城市和直辖市。采样方法严格参考GB 4789.1—2010[6]中:4“样品的采集规则”进行。所有样品在采集后立即放入无菌采集袋中,并用低温采样箱进行保存,在24 h内(依据距离的长短)运回实验室后立即进行样品处理。
1.2 试剂与材料
10%氯化钠胰酪胨大豆肉汤、生理盐水、金葡菌显色培养基、营养琼脂(NA)培养基、Muller-Hinton(MH)培养基、脑心浸液营养肉汤(BHI)、冻干血浆,广东环凯微生物有限公司;微球菌、葡萄球菌和相关菌属鉴定试剂盒(比色法)API Staph20500,法国梅里埃公司;药敏纸片,英国Oxoid公司;细菌核酸DNA小量提取试剂盒,广州迈宝生物科技有限公司;Dream TaqTMGreen PCR Master Mix(2x),美国Fermentas公司;Taq酶及PCR所需试剂,赛默飞世尔科技(中国)有限公司;Biowest 电泳级琼脂糖,西班牙Biowest公司;Goldview®核酸染料,生工生物工程(上海)有限公司;PCR纯化试剂盒,德国Qiagen公司;DNA引物合成,北京六合华大基因科技有限公司。各试剂均在有效期内使用。

表1 中国采样分布Tab.1 Locations of sampling sites for this study in China
1.3 实验方法
1.3.1金黄色葡萄球菌的分离和鉴定
对采集的样品同时进行定性和定量检测,检测方法在GB 4789.10—2010的基础上略做调整。将食用菌样品用无菌的剪刀剪碎,搅拌均匀后取样25 g加入225 mL生理盐水的无菌均质袋中均质摇匀,制成1∶10的样品液,并从中取1 mL加入到装有9 mL 10% 氯化钠胰酪胨大豆肉汤的试管中,制成1∶100的样品液,按照此方法制成1∶1 000的样品液。每个梯度3个平行,将样品液放置于恒温培养箱中37 ℃培养48 h后,将每个梯度浓度的样品液分别划线于金葡菌显色板培养基上,37 ℃中培养24~48 h。金葡菌的典型菌落在显色平板上为粉色湿润边缘平整,挑取3~4个疑似典型菌落划线于营养琼脂平板中,37 ℃培养(24±1)h。挑取单菌落进行血浆凝固酶实验,对其阳性菌株进行API Staph生化鉴定,鉴定结果显示为Staphylococcusaureus,且鉴定率≥70%的,即可记为阳性。
1.3.2耐药性实验
金葡菌抗生素敏感性实验参照Kirby-Bauer法[7]进行。所有菌株经NA平板活化后加入生理盐水稀释至终浓度为1×107cfu/mL,涂布于MH平板上,待菌液干后将抗生素纸片贴在培养基表面,37 ℃培养24 h。选取目前临床上常用于治疗金葡菌感染的14类24种抗生素,其中包括:阿莫西林克拉维酸(AMC,30 μg)、氨苄西林(AMP,10 μg)、头孢吡肟(FEP,10 μg)、头孢西丁(FOX,30 μg)、青霉素(P,10 μg)、头孢他啶(CAZ,30 μg)、阿米卡星(AK,30 μg)、庆大霉素(CN,10 μg)、卡那霉素(K,30 μg)、链霉素(S,25 μg)、氯霉素(C,30 μg)、克林霉素(DA,2 μg)、红霉素(E,15 μg)、泰利霉素(TEL,15 μg)、环丙沙星(CIP,5 μg)、诺氟沙星(NOR,10 μg)、四环素(TE,30 μg),利奈唑胺(LZD,30 μg)、利福平(RD,5 μg)、复方新诺明(SXT,25 μg)、喹奴普汀/达富普汀(QD,15 μg)、替拉考宁(TEC,30 μg)、呋喃妥因(F,300 μg)和褐霉素(FD,10 μg)。StaphylococcusaureusATCC25923和EscherichiacoliATCC25922作为质控菌株。采用游标卡尺测定抑菌圈大小,精确到0.01 mm。具有3种或3种以上类型抗生素抗性的菌株定义为多重耐药菌株,其中,对头孢西丁(FOX)产生耐药的菌株,初步认定为耐甲氧西林金葡菌(methicililin-resistantStaphylococcusaureus,MRSA),继而进行mecA/C基因检测[8-9],确定为MRSA。对于利奈唑胺耐药的菌株,经梯度浓度稀释法(MIC法)[10-12]进行再次验证。
1.3.3肠毒素基因检测
利用PCR扩增技术检测所有金葡菌分离株的18种肠毒素基因(sea,seb,sec,sed,see,seg,seh,sei,sej,sek,sel,sem,sen,seo,sep,seq,ser,seu)。引物及扩增条件参考Varshney等[7]的方法。经PCR扩增后,取5 μL PCR产物上样于1.5%琼脂糖凝胶(含Goldview染料)进行电泳分离,电压120 V电泳25 min,利用UV 凝胶成像系统(GE Healthcare,WI,USA)进行图片采集,图片保存为TIFF格式以备进一步研究。
1.3.4统计学分析
细菌的MPN值的平均计数基于basic-10 logarithms方法计算。当MPN值小于0.3 MPN/g时,设定值为0.15,当MPN值大于110 MPN/g时,则取最大值。卡方检验用于金葡菌阳性样品的污染率和污染水平的检验。所有的数据都运用SPSS V21.0软件进行分析。
2 结果与分析
2.1 金黄色葡萄球菌在我国食用菌中的污染情况
本次调查,从39个城市中采集699份食用菌样品,检出33份金葡菌阳性样品,平均污染率为4.72%,平均污染水平9.75 MPN/g,具体结果如表2。33份阳性样品分别包括金针菇18份(8.18%),平菇3份(2.63%),香菇4份(3.64%),杏鲍菇4份(4.21%),其他菇类4份(4.72%)。从污染程度来看,金针菇、平菇的平均污染水平高于10 MPN/g,而香菇、杏鲍菇和其他菇类的污染水平则低于1 MPN/g。39个城市中,有20个城市的食用菌检出金葡菌阳性样品,阳性率最高的城市是拉萨(15.15%,5/33),其次为海口(12.12%,4/33),汕头(9.09%,3/33,),广州(6.06%,2/33),湛江(6.06%,2/33),北海(6.06%,2/33),西宁(6.06%,2/33),香港(3.03%,1/33),厦门(3.03%,1/33),三亚(3.03%,1/33),郑州(3.03%,1/33),合肥(3.03%,1/33),西安(3.03%,1/33),武汉(3.03%,1/33),北京(3.03%,1/33),上海(3.03%,1/33),杭州(3.03%,1/33),长春(3.03%,1/33),哈尔滨(3.03%,1/33),银川(3.03%,1/33)。5大类食用菌中,金针菇的污染率最高,平均污染水平相对较高。同时,金葡菌污染食用菌没有明显的地区分布规律,这暗示着食用菌在给人们提供丰富营养物质的同时,也可能带来一定的食品安全风险。
2.2 食用菌源金黄色葡萄球菌的耐药性分析
本次调查,共分离出39株金葡菌阳性菌株,其中23株分离自金针菇样品,4株分离自平菇样品,4株分离自香菇样品,4株分离自杏鲍菇样品,4株分离自其他类型的食用菌样品。对39株食用菌源金葡菌均进行了耐药性实验,药敏结果如表3。我国食用菌源金葡菌分离株对22种抗生素均产生不同程度的耐药或中度耐药,对利奈唑胺、利福平敏感。22种抗生素中,耐药情况最严重的是氨苄西林和青霉素,耐药率高达92.31% ,其次是红霉素(56.41%)、四环素(51.28%)、卡那霉素(46.15%)、泰利霉素(35.90%)、克林霉素(30.77%)、链霉素(25.64%)、褐霉素(20.51%)及其他(<20%)。39株分离菌株中,有7株对头孢西丁产生耐药,PCR结果显示7株分离株均携带mecA基因,确定为MRSA。39株分离株中,16株对1~3种的抗生素发生耐药,16株对4~10种抗生素发生耐药,7株对10种以上的抗生素发生耐药(高度耐药)。7株高度耐药菌株中,6株为MRSA,1株为MSSA。对3类或3类以上的抗生素同时耐药的微生物,被定义为多重耐药菌。本研究中,33株(84.61%)分离株对3类或以上的抗生素发生中度耐药或耐药。由此可以看出,本研究中食用菌源分离株出现的耐药问题较为严重。值得关注的是,7株高度耐药菌株中的MRSA几乎对所有β-内酰胺类药物发生耐药,对氟喹诺酮类药物敏感,MSSA则与之相反。
2.3 金黄色葡萄球菌分离株肠毒素基因分布情况
通过PCR方法对分离得到的39株食用菌分离株的18种肠毒素基因携带情况进行检测,结果如表4。表4显示,sea,seb,sec,sed,see,seg,seh,sei,sej,sek,sel,sem,sen,seo,sep,seq,ser以及seu的检出率分别为17.95%,28.21%,35.90%,0%,15.38%,51.28%,100%,71.79%,25.64%,5.13%,7.69%。所有分离株至少携带1种肠毒素基因,其中有1株平菇样品的分离株同时携带9种肠毒素基因(sea-seb-sec-seh-sei-sek-sem-seq-seu),这可能与大部分肠毒素基因定位在可移动基因元件上有关。本研究中传统肠毒素基因(sea,seb,sec,sed,see)的检出率为19.79%(38/192),以sec基因为主,未检出sed基因。新型肠毒素(seg,sei,sem,sen,seo,seu)的检出率为53.13% (102/192),其中,sei基因为金葡菌分离株的主要携带基因(见图1)。

表2 金黄色葡萄球菌在不同食用菌中的分布情况Tab.2 Contents of Staphylococcus aureus in different retail edible mushrooms

表3 全国食用菌金黄色葡萄球菌分离株药敏实验结果Tab.3 Antimicrobial susceptibility tests of Staphylococcus aureus isolates obtained from retail edible mushrooms in China
a.耐药菌株数,b.中度耐药菌株数,c.敏感菌株数,n.菌株总数量。
2.4 讨 论
本研究在2011—2016年,对全国39个城市699份食用菌进行污染调查,研究其污染情况和污染水平,并检测到金葡菌阳性样品33份,平均污染率达到了4.72%,平均污染水平9.75 MPN/g。这一结果显示,我国市售食用菌中金葡菌的污染情况不容乐观。相较于食用菌样品,肉、鸡蛋和奶制品更适宜金葡菌的生长[13-14],然而,本研究中的食用菌同样受到金葡菌的污染,这很有可能是食用菌与其他类型产品发生了交叉污染;因此,需特别重视食用菌的培植环境、运输及销售中的交叉污染情况。

表4 全国食用菌源金黄色葡萄球菌肠毒素基因分布情况Tab.4 Distributions of 18 types of SE genes of Staphylococcus aureus isolates edible mushrooms obtained from retail in China
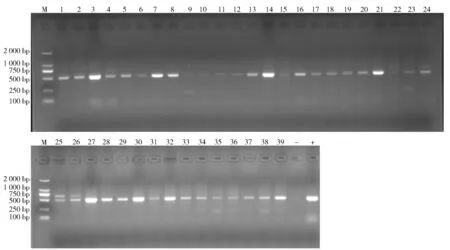
图1 全国食用菌金黄色葡萄球菌sei基因分布情况Fig.1 Distributions of sei gene in edible mushrooms Staphylococcus aureus isolates in China
一般来说,动物源金葡菌的耐药性较为严重,这与动物在养殖过程中长期使用亚治疗量的抗菌药物有关。亚治疗量的抗菌药物会诱导动物肠道内正常菌群和寄居的病原菌产生耐药性,导致动物源性食品中病原菌耐药株的产生且迅速蔓延引起环境或食品的污染;然而,本研究从食用菌中分离的金葡菌耐药性率也很高,其中,β-内酰胺类、大环内酯类以及四环素类等药物耐药情况甚至达到50%以上,该结果与汪永禄等[15]和周臣清[16]研究结果一致。Vitale等[17]对金葡菌分离株进行了耐药性研究,结果发现其分离株同样对β-内酰胺类(35.7%)、四环素类(20.2%)两类药物发生耐药,但其耐药率稍低于本研究结果,这表明,食用菌源金葡菌的耐药性同样严重。本研究还分离到了7株MRSA,显示在分离菌中的阳性率为17.9%,这一水平明显高于其他食品源MRSA中的阳性比例[18-19]。MRSA传染性强、致病性高且耐药现象严重,不仅可产生多种分泌性毒素,还可以通过质粒、转座子等将耐药性基因转移到其他菌株中[20],能使原本对药物敏感的菌株成为高度耐药菌;因此,对于本研究中分离到17.9%的MRSA菌株应特别引起关注。
与Fursova等[21]以及Vitale等[17]报道的不同,本研究的分离株主要携带sei、sem肠毒素基因。18种肠毒素基因检测结果显示,seg、sei、sem、sen、seo、seu等新型肠毒素的携带率(53.13%,102/192)要明显高于sea~see五种传统的肠毒素 (19.79%,38/192)基因。此外,本研究中的金葡菌传统肠毒素的携带率远低于刘伟等[22]和刘杰等[23]报道的日常食品中的传统肠毒素携带率(≥70%)。本研究中分离株的肠毒素携带情况有别于国内外的报道,这可能与采集样品的种类数量及类型有关。
3 结 论
我国市售食用菌中存在金黄色葡萄球菌的污染风险,且相关分离株在耐药性、肠毒素基因携带方面的情况较为严重,在食品安全中存在一定的威胁。因此,建议相关食品企业严格把控从食品原料到成品的各个生产环节,安排专门的化验员对成品进行检验,以保证产品的质量,将可能引起的食物中毒风险降到最低。同时,相关生产及其他有关部门应加强对食源性致病菌耐药性的检测,及时掌握病原菌的耐药状况,减低耐药危害的发生,指导临床合理选择有针对性的抗菌药物。
参考文献:
[1] KADARIYA J, SMITH T C, THAPALIYA D.Staphylococcusaureusand staphylococcal food-borne disease: an ongoing challenge in public health[J]. Biomed Research International, 2014(2014):827965.
[2] 徐振波, 刘晓晨, 李琳, 等. 金黄色葡萄球菌肠毒素在食源性微生物中的研究进展[J]. 现代食品科技, 2013(9):2317-2324.
XU Z B, LIU X C, LI L, et al. Development ofStaphylococcalaureusenterotoxin in food-borne bacteria [J]. Modern Food Technology, 2013(9):2317-2324.
[3] HENNEKINNE J A, BUYSER M L D, DRAGACCI S.Staphylococcusaureusand its food poisoning toxins: characterization and outbreak investigation[J]. Fems Microbiology Reviews, 2012,36(4):815-836.
[4] KUZMA K, MALINOWSKI E, LASSA H, et al. Entertoxin and tonic shock syndrome toxin-1 production byStaphylococcusaureusisolated from bovine mastitis[J]. Medycyna Weterynaryjna, 2005, 61(3): 282-285.
[5] 向晶晶.食用菌种植中污染菌青霉的拮抗菌筛选与应用研究[D]. 成都:四川大学, 2007.
[6] 中华人民共和国卫生部, 中国国家标准化管理委员会. GB 4789.1—2010: 食品微生物学检验总则[S]. 北京: 中国标准出版社, 2010.
[7] VARSHNEY A K, MEDIAVILLA J R, ROBIOU N, et al. Diverse enterotoxin gene profiles among clonal complexes ofStaphylococcusaureusisolates from the Bronx, New York[J]. Applied & Environmental Microbiology, 2009,75(21):6839.
[8] LEEKITCHAROENPHON P, SONDA T, KUMBURU H H, et al. Hospital epidemiology of methicillin-resistantStaphylococcusaureusin a tertiary care hospital in Moshi, Tanzania, as determined by whole genome sequencing[J]. BioMed Research International,2018(2):1-12.
[9] 王敏, 范婧, 李先平. PCR扩增法检测耐甲氧西林金黄色葡萄球菌的mecA基因[J]. 广东医学, 2008,29(4):566-568.
WANG M, FAN J, LI X P. PCR amplification method for detection ofmecAgene of methicillin-resistantStaphylococcusaureus[J]. Guangdong medicine, 2008,29(4):566-568.
[10] SMITH J R, BARBER K E, HALLESY J, et al. Telavancin demonstrates activity against methicillin-resistantStaphylococcusaureusisolates with reduced susceptibility to vancomycin, daptomycin, and linezolid in broth microdilution MIC and one-compartment pharmacokinetic/pharmacodynamic models[J]. Antimicrob Agents Chemother, 2015,59(9):5529-5534.
[11] 陈栎江, 周铁丽, 吴庆, 等. 耐甲氧西林金黄色葡萄球菌对万古霉素、替考拉宁、利奈唑胺的MIC值的5年监测[J]. 浙江检验医学, 2009(1):32-34.
CHEN L J, ZHOU T L, WU Q, et al. 5 years monitoring of the MIC value of methicillin-resistantStaphylococcusaureusin vancomycin, teicoplanin, and linneazolamide [J]. Zhejiang Laboratory Medicine, 2009(1):32-34.
[12] PEYRUSSON F, TULKENS P M, VAN F B. Cellular pharmacokinetics and intracellular activity of gepotidacin againstStaphylococcusaureuswith different resistance phenotypes in models of cultured phagocytic cells[J]. Antimicrobial Agents & Chemotherapy, 2018,62(4): 2217-2245.
[13] 索玉娟.食品中金黄色葡萄球菌的分布及其肠毒素基因的研究[D]. 保定:河北农业大学, 2008.
[14] 黄冰, 邓志爱, 谭铭雄, 等. 食品中金黄色葡萄球菌污染状况、产肠毒素特性及耐药性研究[J]. 中国卫生检验杂志, 2009(6):1380-1382.
HUANG B, DENG Z A, TAN M X, et al. Contamination status, staphylococcal enterotoxin-producing property and drug resistance ofStaphylococcusaureusisolated from food products [J]. Chinese Journal of Health Inspection, 2009(6):1380-1382.
[15] 汪永禄, 张萍, 陶勇, 等. 不同来源金黄色葡萄球菌肠毒素及耐药性检测分析[J]. 实用预防医学, 2014,21(4):488-491.
WANG Y L, ZHANG P, TAO Y, et al. Analysis on enterotoxin and antibiotic resistance inStaphylococcusaureusisolated from different sources [J]. Practical Preventive Medicine, 2014,21(4):488-491.
[16] 周臣清.生猪肉中金黄色葡萄球菌的检测及耐药机制研究[D]. 广州:华南理工大学, 2014.
[17] VITALE M, GAGLIO S, GALLUZZO P, et al. Antibiotic resistance profiling, analysis of virulence aspects and molecular genotyping ofStaphylococcusaureusisolated in Sicily, Italy[J]. Foodborne Pathog Dis, 2018,15(3):177-185.
[18] GE B, MUKHERJEE S, HSU C H, et al. MRSA and multidrug-resistantStaphylococcusaureusin U.S. retail meats, 2010-2011[J]. Food Microbiology, 2017,62:289-297.
[19] PAPADOPOULOS P, PAPADOPOULOS T, ANGELIDIS A S, et al. Prevalence ofStaphylococcusaureusand of methicillin-resistantS.aureus(MRSA) along the production chain of dairy products in north-western Greece[J]. Food Microbiology, 2018,69:43.
[20] 王艳, 周丽萍, 巢国祥, 等. 金黄色葡萄球菌MRSA分型及分子溯源研究[J]. 中国卫生检验杂志, 2014(20):2899-2904.
WANG Y, ZHOU L P, CHAO G X, et al. Study on MRSA typing and molecular traceability ofStaphylococcusaureus[J]. Chinese Journal of Health Inspection, 2014(20):2899-2904.
[21] FURSOVA K K, SHCHANNIKOVA M P, LOSKUTOVA I V, et al. Exotoxin diversity ofStaphylococcusaureusisolated from milk of cows with subclinical mastitis in central Russia[J]. Journal of Dairy Science, 2018(101):1-7.
[22] 刘伟, 王菊光, 孙晓华, 等. 日常食品及食物中毒样本中金黄色葡萄球菌肠毒素的分型检测分析[J]. 中国预防医学杂志, 2013(8):608-611.
LIU W, WANG J G, SUN X H, et al. Analysis of enterotoxin of staphylococcal isolated from food and food poisoning samples [J]. China Journal of Preventive Medicine, 2013(8):608-611.
[23] 刘杰, 陈磊, 黄淑华, 等. 22株不同来源金黄色葡萄球菌肠毒素及耐药性检测分析[J]. 公共卫生与预防医学, 2017,28(1):133-134.
LIU J, CHEN L, HUANG S H, et al. Analysis on the detection of staphylococcal enterotoxin and drug resistance in 22 different strains [J]. Public Health and Preventive Medicine, 2017,28(1):133-134.
Abstract: This study investigated the contamination level ofStaphylococcusaureusof retail edible mushrooms in China. 699 retail edible mushroom samples were collected from 39 cities in China during 2011 to 2016, 33 samples (4.72%) were positive forStaphylococcusaureusand the geometric mean was 9.75 MPN/g. A total of 39 isolates were analyzed.For antibiotics susceptibility tests, all isolated strains were resistant to 22 kinds of different antibiotics, such as ampicillin, and only sensitive to linezolid and rifampicin. Seven isolates were resistant to cefoxitin and carriedmecAgene, confirmed as methicililin-resistantStaphylococcusaureus(MRSA).Polymerase chain reaction(PCR) analysis of 18 SE genes showed that 4-6 kinds of enterotoxin genes carried by 60% isolated strains, andseigene was the most frequently detected, followed bysem,seg,seq,sec,seb,sen.This study reflects the potential risk ofStaphylococcusaureuscontamination of retail edible mushrooms in China and these isolate strains had virulence potential and drug tolerance, which should be drawn public attention.
Keywords:Staphylococcusaureus; edible mushrooms; pollution level; enterotoxin gene; drug tolerance
(责任编辑:叶红波)
