黄秋葵花提取物不同极性部位抗氧化活性的研究
2018-05-30郭溆李文刚田硕曹宏杰王维婷刘超程安玮王新坤孙金月
郭溆,李文刚,田硕,曹宏杰,王维婷,刘超,程安玮,王新坤,孙金月,*
(1.山东省农业科学院农产品研究所/山东省农产品精深加工技术重点实验室/农业部新食品资源加工重点实验室,山东济南250100;2.山东省农业科学院试验基地服务中心,山东济南250100;3.济南市畜产品质量安全监测中心,山东济南250000)
黄秋葵(Abelmoschus esculentus L.)属于锦葵科(Malvaceae)秋葵属(Abelmoschus Medic)一年生草本植物,是一种具有较高营养价值的新型保健蔬菜,抗疲劳效果佳[1]。自引入我国后,在山东、浙江、福建、江西、广州、北京等多省市种植,选种的品种也较多。黄秋葵的花具有花期短、产量大的特点,因此具有很强的开发应用潜能,现在已经有大量的黄秋葵花茶在售,市场前景较好。
自由基与活性氧是机体在正常有氧呼吸过程中产生的物质,若不及时清理,就会破坏人体内的动态平衡,使人体处于氧化应激状态,易引发疾病与衰老[2]。开发自由基清除剂和抗氧化剂已经受到了人们的重视,但化学合成抗氧化剂因具有潜在的毒、副作用,因此从植物中寻找天然抗氧化剂已经成为研究热点[3]。黄秋葵花中富含黄酮、多酚、多糖、氨基酸等多种物质[4],其中黄酮和多酚类化合物是植物抗氧化活性的主要物质基础[5-6]。目前对黄秋葵抗氧化活性的研究主要集中在果实中,对黄秋葵花的研究还很少。李孟秋等实验证明黄秋葵花水提物的抗氧化活性较好[7]。本研究以黄秋葵花乙醇提取物为研究对象,采用萃取法将黄秋葵花乙醇提取物分为乙酸乙酯相和水相两个部位,对两个不同极性部位中的总酚和黄酮含量进行了测定,并分别对其抗氧化活性进行分析,为黄秋葵花的合理开发利用提供理论依据,也为天然抗氧化剂和功能性食品开发提供新的资源。
1 材料与方法
1.1 原料
黄秋葵品种卡里巴:2016年春播种于山东省农科院农产品研究所章丘龙山试验基地,采集其盛开的花器官作为试验材料,经干燥脱水后,粉碎过80目筛,置常温干燥处备用;采用有机溶剂萃取法将黄秋葵花乙醇提取物分为乙酸乙酯相和水相部位。
1.2 试剂与仪器
芦丁标准品、没食子酸标准品、1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):上海源叶生物科技有限公司;铁氰化钾、三氯乙酸、磷酸盐缓冲液(pH6.6)、三氯化铁、水杨酸、硫酸亚铁、双氧水、乙醇、Tris-HCl-EDTA缓冲液、邻苯三酚:国药集团化学试剂有限公司。
UV-1800型紫外分光光度计:日本岛津公司;FE20K型台式酸度计:美国梅特勒-托利多公司;AR423CN型电子天平:美国奥豪斯公司;DK-S24型电热恒温水浴锅:上海精宏公司;Allegra 25R型高效冷冻离心机:美国贝克曼公司。
1.3 方法
1.3.1 黄秋葵花不同极性溶剂提取物制备
在乙醇体积分数80%、料液比1∶50(g/mL)、温度60℃条件提取1 h,提取2次,过滤;将滤液低压浓缩至膏状物质,取部分冷冻干燥,得到醇提物干样;加入定量的水将上述剩余的膏状物质溶解后,充分摇匀,转入分液漏斗中。用乙酸乙酯进行萃取3次,得到乙酸乙酯部位和水提部位的萃取物。将各组萃取物减压浓缩后,真空冷冻干燥至恒质量,密封置于冰箱冷藏备用。
1.3.2 芦丁标准曲线的制作
采用Al(NO3)3法测定[8]。准确称取经120℃烘干至恒质量的芦丁标准品1 g,80%乙醇溶解后定容至100 mL,摇匀,得0.5 mg/mL芦丁标准溶液。分别精密量取芦丁标准溶液 0、1、2、3、4、5、6 mL,各加 80%乙醇溶液至10 mL,再加入0.7 mL 5%亚硝酸钠溶液,摇匀,避光静置反应6 min后,加入0.7mL的10%硝酸铝,摇匀,静置6 min,加入5.0 mL的4%氢氧化钠,用25%乙醇定容至25 mL后摇匀放置15 min后,于波长510 nm处测定其吸光值。以芦丁浓度为横坐标,吸光值为纵坐标,绘制芦丁标准曲线,标准方程Y=1.410 6x+0.007 3,R2=0.997 6。式中:Y为吸光度;x为黄酮质量浓度,mg/mL。
1.3.3 没食子酸标准曲线的制作
采用Folin-Ciocalteu方法测定[9]。准确称取经120℃烘干至恒质量的没食子酸标准品0.05 g,80%乙醇溶解定容至50 mL,得到1 mg/mL没食子酸标准溶液。分别精密量取没食子酸标准溶液 1、2、3、4、5 mL,各加80%乙醇溶液至10 mL,各吸取200 μL后加入1.0 mL蒸馏水、福林酚试剂0.2 mL混匀,静置3 min后,加入7.5%碳酸钠溶液0.6 mL后混匀,室温静置40 min后,于波长765 nm下测定器吸光值。以没食子酸浓度为横坐标,吸光值为纵坐标,绘制没食子酸标准曲线,标准方程Y=2.151x-0.032 6,R2=0.992 5。式中:Y为吸光度;x为多酚质量浓度,mg/mL。
1.3.4 黄秋葵花不同极性部位中总黄酮、多酚含量测定
准确称取黄秋葵花萃取物0.01 g,溶于10 mL 80%乙醇中,配制成1 mg/mL溶液,代入到各标准曲线中,测定萃取物中总黄酮、多酚含量。
1.3.5 还原力的测定
将水相和乙酸乙酯相分别稀释为0.01、0.02、0.04、0.06、0.08、0.1 mg/mL的浓度,用相同浓度的VC溶液做对照。取各浓度的样品液1 mL于试管中,分别加0.2 mol/L pH6.6的磷酸盐缓冲液和1%的K3Fe(CN)6溶液各2.5 mL,混匀后将试管在50℃水浴锅中反应20 min,取出放置室温,再加入2.5 mL 10%三氯乙酸,混匀后静置10 min,取出2.5 mL,再加入2.5 mL蒸馏水和0.5 mL 0.1%的 FeCL3,混匀后反应 10 min,在700 nm处测定吸光度。
1.3.6 清除DPPH自由基活性的测定
配制浓度为1×10-4mol/L的DPPH溶液。量取配制好的 DPPH 溶液 2、4、6、8、10 mL 于 10 mL 容量瓶之中,用无水乙醇定容后在517 nm波长下测吸光度并记录,制作标准曲线。将VC、水相和乙酸乙酯相分别配制成浓度为 0.002、0.004、0.006、0.008、0.01、0.012 mg/mL的溶液。各取1.00 mL溶液,分别加入1mL DPPH溶液,室温避光反应15 min,在517 nm波长下下测定吸光度A样品,用1 mL无水乙醇与1.00 mL样品溶液调零,消除样品本身的颜色对吸光度的影响。向1 mL DPPH溶液中加入1 mL相应样品溶剂,记录吸光度为A空白,用1 mL无水乙醇与1 mL相应样品溶剂调零,以扣除溶剂的影响。
清除率计算公式:DPPH自由基清除率/%=(A空白-A样品)/A空白×100。
1.3.7 清除羟自由基的测定
将水相和乙酸乙酯相分别稀释为0.02、0.04、0.06、0.08、0.1 mg/mL的溶液,相同浓度的VC溶液做对照。取1 mL样品,分别加入1.8mmol/LFeSO42mL和1.8mmol/L水杨酸-乙醇1.5 mL,再加入0.03%H2O20.1 mL在37℃反应 30 min,8 000 r/min离心 10 min,510 nm 测定吸光度Ax。另用1 mL蒸馏水代替样品溶液做空白对照测定吸光值A0,1 mL的蒸馏水代替双氧水测定吸光度AX0。
清除率计算公式为:羟自由基清除率/%=[(A0-(AX-AX0))/A0]×100
1.3.8 清除超氧阴离子自由基的测定
将水相和乙酸乙酯相分别稀释为0.000 5、0.001 1、0.005.、0.01、0.021、0.04、0.06、0.08、0.1 mg/mL 的溶液,相同浓度的VC溶液做对照。取4.5 mL pH值为8.2的Tris-HCl-EDTA缓冲液加入0.5 mL蒸馏水25℃反应10 min,再加入10 μL 45 mmol/L邻苯三酚溶液,混合均匀在325 nm波长下测定吸光度,每隔1 min测一次,共测4 min,计算未加入样品时邻苯三酚自氧化速率△A0。用样品替代蒸馏水重复上述试验,计算入样品后邻苯三酚自氧化速率△A。
清除率计算公式:超氧阴离子自由基清除率/%=(△A0-△A)△A0×100
2 结果与分析
2.1 黄秋葵花提取物不同极性部位总黄酮和多酚含量
黄秋葵花水提部位总黄酮含量为(43.14±1.46)mg/g,总酚含量为(66.42±2.63)mg/g。乙酸乙酯提取部位总黄酮含量为(352.78±20.73)mg/g,总酚含量为(405.2±23.02)mg/g。乙酸乙酯部位的总黄酮和多酚含量要多于水提部位。
2.2 还原力的测定结果
采用铁离子还原能力(ferric ion reducing antioxidant power,FRAP)法测定,其作用机理是抗氧化物质在较低pH值条件下可将Fe3+还原为Fe2+,在700 nm处检测吸光值,值越大还原能力越强即抗氧化能力越强[10]。还原力的测定结果见图1。
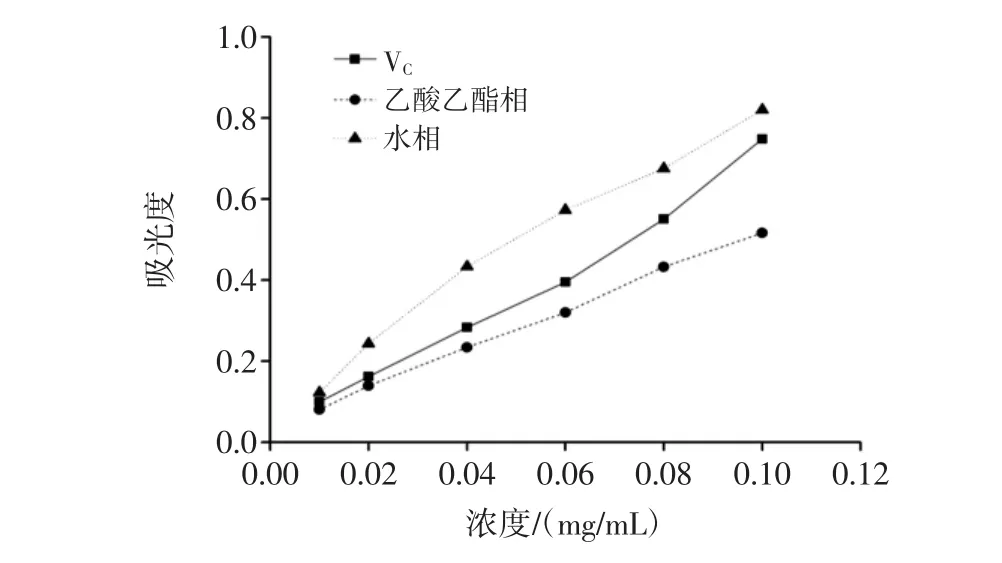
图1 黄秋葵花不同极性部位提取物的还原能力Fig.1 Reducing power abilities of different polarity fractions from okra flowers
如图1所示,黄秋葵花乙酸乙酯相和水相提取物均表现出不同程度的还原能力,具有明显的量效关系,水提部位提取物的还原力要大于阳性对照,乙酸乙酯部位提取物的还原力要弱于阳性对照。
2.3 对DPPH自由基清除能力
DPPH自由基清除能力的作用机理是在抗氧化剂的作用下,紫色的DPPH自由基可被还原为黄色的非自由基DPPH-H,在517 nm处检测吸光值,一定范围内吸光值变化程度与自由基清除程度呈线性关系[11]。对DPPH自由基清除能力见图2。
由图2可以看出,样品对DPPH自由基的清除作用随着浓度的增加而增强,水提部位清除DPPH自由基活性明显优于乙酸乙酯提取部位和VC。
为了便于比较不同物质的抗氧化能力,常用IC50值表示抗氧化物质对DPPH自由基的清除能力,即对自由基清除率为50%时所对应抗氧化剂的质量浓度。IC50值越小,表明该物质清除自由基的能力越强。黄秋葵花不同极性部位提取物清除DPPH自由基的IC50见表1。
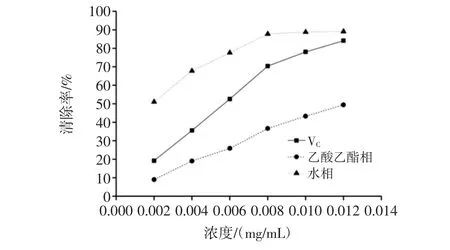
图2 黄秋葵花不同极性部位提取物清除DPPH能力Fig.2 DPPH scavenging abilities of different polarity fractions from okra flowers
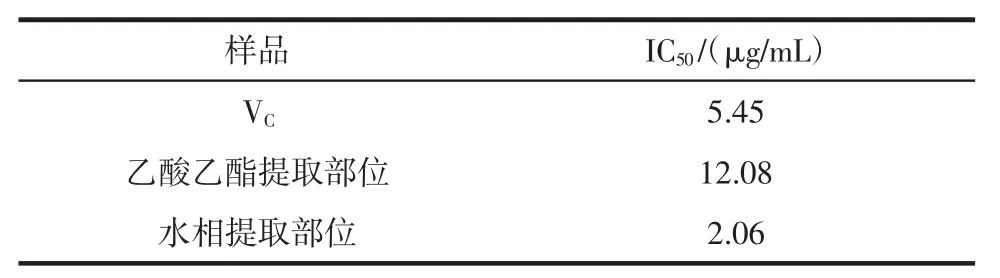
表1 黄秋葵花不同极性部位提取物清除DPPH自由基的IC50Table 1 IC50of DPPH scavenging capacities of different polarity fractions from okra flowers
由表1可知,黄秋葵花水提部位IC50值最小,而乙酸乙酯相值最大,表明它们的DPPH自由基清除能力大小依次为水相>VC>乙酸乙酯相。
2.4 对羟自由基的清除能力
清除羟自由基的作用机理是羟基自由基可与水杨酸分子上的苯环作用产生2,3-二羟基苯甲酸,在510 nm处可检测吸光值,若反应体系中存在抗氧化剂,吸光值就会降低[12]。对羟自由基的清除能力见图3。
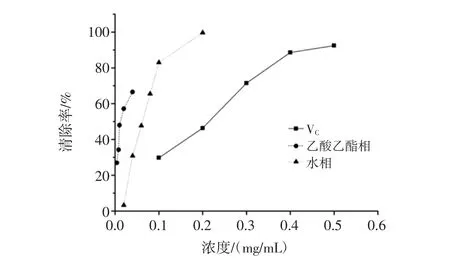
图3 黄秋葵花不同极性部位提取物清除羟自由基能力Fig.3 Hydroxyl free radical scavenging abilities of different polarity fractions from okra flowers
由图3可知,在考察浓度范围内,随着浓度的逐渐增大,VC、水相和乙酸乙酯相表现出清除羟自由基的能力越来越强,量效关系非常明显,尤其是乙酸乙酯相,很小的浓度变化就对清除率产生很大的影响。
黄秋葵花不同极性部位提取物清除羟自由基的IC50见表2。

表2 黄秋葵花不同极性部位提取物清除羟自由基的IC50Table 2 IC50of hydroxyl free radical scavenging capacities of different polarity fractions from okra flowers
由表2可知,乙酸乙酯提取部位清除羟自由基的IC50值最小,为14.04 μg/mL,因此清除羟自由基的能力的大小顺序为:乙酸乙酯提取部位>水相提取部位>VC。
2.5 清除超氧阴离子自由基的能力
邻苯三酚自氧化法清除超氧阴离子自由基的作用机理是邻苯三酚在弱碱性条件下会发生自氧化反应会产生有色中间物质,若加入抗氧化物质会阻断有色物质的积累,限制邻苯三酚的自氧化,可在325 nm处检测吸光度值变化情况[13]。由清除超氧阴离子自由基的能力见表4。
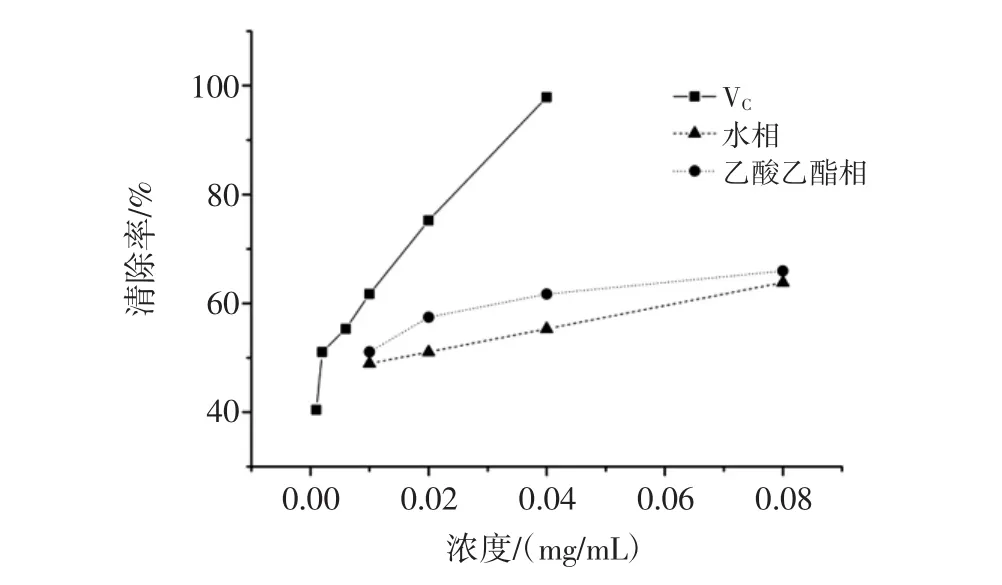
图4 黄秋葵花不同极性部位提取物清除超氧阴离子自由基的能力Fig.4 Superoxide anion scavenging abilities of different polarity fractions from okra flowers
图4所知,在考察浓度范围内,VC的清除能力最强,乙酸乙酯提取部位的清除能力略优于水提部位,且随着浓度的增加,其清除超氧阴离子自由基的能力增强。
黄秋葵花不同极性部位提取物清除超氧阴离子自由基的IC50见表3。
由表3可知,对照品VC清除50%的超氧阴离子自由基所需浓度为3.65 μg/mL,乙酸乙酯提取部位清除50%的超氧阴离子自由基所需浓度为6.19 μg/mL,水相提取部位清除50%的超氧阴离子自由基所需浓度为15.00 μg/mL。说明乙酸乙酯提取部位清除超氧阴离子自由基的能力强于水相提取部位。

表3 黄秋葵花不同极性部位提取物清除超氧阴离子自由基的IC50Table 3 IC50of superoxide anion scavenging capacities of different polarity fractions from okra flowers
3 结论与讨论
不同抗氧化能力检测方法有不同的反应机理,本研究为了获得更加可靠的结果,分别采用还原能力测定、清除DPPH自由基、清除羟自由基和清除超氧阴离子自由基4种不同方法对黄秋葵花不同极性部位提取物的抗氧化能力进行评价。研究发现黄秋葵花不同极性部位提取物对Fe3+、DPPH自由基、羟自由基和超氧阴离子自由基均具有不同程度的抗氧化能力,且随着浓度的升高抗氧化能力不断提高,说明总黄酮和多酚含量与抗氧化活性之间具有良好的量效关系。由于不同抗氧化评价方法的测定原理不同,不同极性部位抗氧化能力的强弱顺序有可能不一致,本研究中水相的还原能力和清除DPPH自由基的能力较强,强于VC,乙酸乙酯相最弱;水相和乙酸乙酯相对羟自由基的清除能力均较强,极低的浓度就具有较高的清除羟自由基活性且强于VC;水相和乙酸乙酯相清除超氧阴离子自由基的能力均弱于VC。
[1]李军民.黄秋葵的药用营养价值及露地栽培技术[J].现代农业科技,2015(2):118-119
[2]Prior R L,Wu X.Diet antioxidant capacity:Relationships to oxidative stress and health.[J].American Journal of Biomedical Sciences,2013,5(2):126-139
[3]I˙nanç T,Maskan M.Testing the Antioxidant Effect of Essential Oils and BHT on Corn Oil at Frying Temperatures:a Response Surface Methodology[J].Journal of the American Oil Chemists Society,2013,90(12):1845-1850
[4]王维婷,郭溆,刘超,等.黄秋葵生物活性物质及加工研究进展[J].山东农业科学,2015(11):134-136
[5]Riceevans C A,Miller N J.Antioxidant activities of flavonoids as bioactive components of food.[J].Biochemical Society Transactions,1996,24(3):790-795
[6]Sultana B,Anwar F,Przybylski R.Antioxidant activity of phenolic components present in barks of Azadirachta indica,Terminalia arjuna,Acacia nilotica,and Eugenia jambolana Lam.trees[J].Food Chemistry,2007,104(3):1106-1114
[7]李孟秋,翟俊乐,田欢,等.黄秋葵提取物体外抗氧化活性的研究[J].中国食品添加剂,2015(10):65-69
[8]Hossain M A,Kalbani M S A A,Farsi S A J A,et al.Comparative study of total phenolics,flavonoids contents and evaluation of antioxidant and antimicrobial activities of different polarities fruits crude extracts of Datura metel L[J].Asian Pacific Journal of Tropical Disease,2014,4(5):378-383
[9]Ghimeray A K,Sharma P,Hu W,et al.Far infrared assisted conversion of isoflavones and its effect on total phenolics and antioxidant activity in black soybean seed[J].Journal of Medicind Plants Research,2013,7(17):1129-1137
[10]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin[J].Journal of Agricultural&Food Chemistry,1992,40(6):945-948
[11]MilardoviS,IvekoviD,Grabari cB S.A novel amperometric method for antioxidant activity determination using DPPH free radical[J].Bioelectrochemistry,2006,68(2):175-180
[12]颜军,苟小军,邹全付,等.分光光度法测定Fenton反应产生的羟基自由基[J].成都大学学报(自然科学版),2009,28(2):91-93,103
[13]李永利,张焱.邻苯三酚自氧化法测定SOD活性[J].中国卫生检验杂志,2000,10(6):673-673
