奶牛隐性乳房炎志贺氏菌16S rRNA的扩增及序列分析
2018-05-30蒋成砚李桥善周文树唐秀华
谢 昆, 蒋成砚, 刘 杰, 李桥善, 周文树, 唐秀华, 汪 镜
(1.红河学院生命科学与技术学院,云南蒙自 661199; 2.云南省高校农作物优质高效栽培与安全控制重点实验室,云南蒙自 661199)
奶牛乳房炎是困扰牛奶业经济效益及迅速发展的重要原因之一,不仅严重影响患病牛的产乳量、乳的品质、延长产后发情和妊娠的时间,易在牛群中传播流行,对奶牛业的危害极大,而且危及人类健康[1]。奶牛乳房炎根据临床表现可分为临床型和隐性型2种,其中隐性乳房炎(subclinic mastitis)乳汁无肉眼可见变化,临床症状不明显,诊断困难,疗效较差,造成奶品质量下降,最终危及人类健康[2]。
奶牛乳房炎是奶牛乳腺受到物理、化学、微生物等因素刺激所引起的奶牛乳房的炎症,表现为乳汁发生理化性质及细胞学性质的变化、乳腺组织发生病理学变化[3]。志贺氏菌大多存在肠道中,由于饲养员的不卫生操作或饲养管理水平较低,挤奶员的素质不高出现不能正确使用挤奶器或对挤奶系统没有进行很好的保养等问题导致志贺氏菌的感染。志贺氏菌从损伤的生殖道进入血液或淋巴而引起感染,多感染舍饲牛,严重的可引起乳房坏疽,志贺氏菌性乳房炎多见于高产奶牛及产后泌乳高峰时期,临床症状明显,乳房肿胀、高热,食欲废绝,并伴有胃肠道症状,乳汁水样黄色,泌乳量急剧下降,表现出急性发病,少数动物可死于内毒素血症[4]。
本研究从牛奶中分离出引起乳房炎的1种病原菌,通过细菌培养和生理生化试验[5]初步鉴定病原菌为志贺氏菌,利用PCR技术扩增其16S rRNA序列,并与GenBank上发布的志贺氏菌16S rRNA核苷酸序列进行同源性比较,以期为志贺氏菌导致的奶牛隐性乳房炎的分子生物学诊断提供依据。
1 材料与方法
1.1 试验材料
新鲜奶样,采自云南省红河州个旧市乍甸奶牛场,由红河学院生命科学与技术学院动物免疫实验室4 ℃保存。
1.2 培养基
普通肉汤培养基:取瓶内干粉39.6 g,加入蒸馏水或去离子水1 L,搅拌加热煮沸至完全溶解,分装三角瓶,121 ℃高压灭菌15 min;冷却至50 ℃,摇匀倒平板。在室温可保存1 d或在冰箱里贮存数天。
1.3 细菌分离培养及生理生化鉴定
取新鲜奶样200 μL接种在普通肉汤培养基,在37 ℃条件下无氧培养24 h,待菌落长出后,挑出单菌落,划线分离,直至菌落较纯化,待菌株生长良好后,仔细观察菌落形态。挑选形态典型的单个菌落,进行革兰氏染色,镜检。将分离得到的革兰氏染色阴性的细菌做过氧化氢酶试验。凡是革兰氏染色为阴性、过氧化氢酶产生气泡的细菌均暂定为葡萄球菌属。再进一步做甲基红试验、各种发酵糖试验、硝酸还原试验、血凝固酶试验。根据《常见细菌系统鉴定手册》来确定所属的种。
1.4 16S rRNA的PCR扩增及测序
采用CTAB法提取经过生理生化鉴定的细菌DNA,根据GenBank上发表的志贺细菌16S rRNA序列(GU444081.1),设计1对特异性引物如下:P1:5′-AATGGGACGCTGGCGGC AGGCCTC-3′,P2:5′-GCGCATATGCATACGGCTACCT-3′。
以细菌DNA为模板进行PCR扩增,反应条件如下:94 ℃预变性5 min;94 ℃变性30 s,49 ℃退火30 s,72 ℃延伸 2 min,35个循环;72 ℃ 延伸10 min。反应结束后取5 μL扩增产物电泳检测。将检测正确的PCR产物送交上海生工生物工程有限公司测序。将测序结果与GenBank上发表的志贺氏菌16S rRNA序列进行同源性比较。
2 结果与分析
2.1 分离菌的形态特征
在普通肉汤培养基上,菌落为圆形半透明,平板形成湿润,表面光滑,边缘有些不整齐,呈白色,中央有凸起的菌落(图1)。分离菌的菌体都是圆形的,在显微镜下一般观察到的是呈短小杆菌状,革兰氏染色阴性(图2)。
分离菌的形态特征:菌落直径在0.5~1.5 mm之间,凸起、圆形、光滑、半透明、白色,细菌为圆形,通常是以串状存在,偶尔有单个,缺乏鞭毛。

2.2 分离菌特性的分析与鉴定
本试验对牛奶中分离得到的细菌进行生理生化鉴定,由表1可知,革兰氏染色试验,过氧化氢试验和甘露醇、赖氨酸脱羧酶、β-半乳糖苷酶、尿素试验等均为阴性;甲基红试验、葡萄糖为阳性,根据形态特征和常规的生理生化鉴定结果,试验分离出的细菌初步确定为志贺氏菌属。

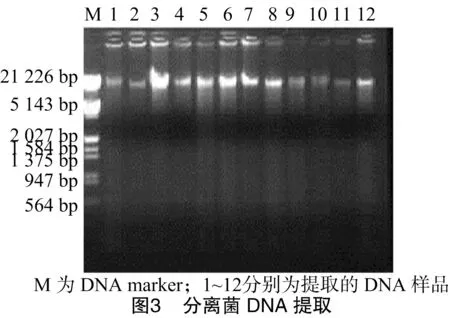
2.3 分离菌DNA提取结果
由图3可知,分离菌的DNA提取结果可见分离菌DNA提取了12个样,而3、4、5、6、7、8泳道几个样效果较好,可以用来做16S rRNA的扩增。

表1 分离细菌的生理生化试验结果
注:+为阳性反应,-为阴性反应。
2.4 分离菌16S rRNA的扩增结果
由图4可知,经PCR扩增后得到16S rRNA片段,一共扩增了10个样,每个条带都很清晰,说明PCR反应体系和扩增程序都正确,其大小约为1 500 bp。

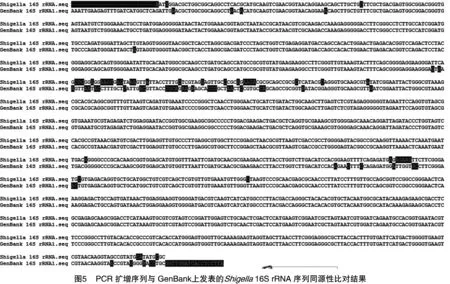
2.5 同源性比较
PCR产物送交上海生工生物工程有限公司测序后,结果表明序列大小与预期结果一致,将测序结果与GenBank上发表的志贺氏菌16S rRNA序列进行同源性比较。结果表明,PCR扩增的核苷酸序列与GenBank上发表的Shigella16S rRNA序列同源性达到99.9%(图5)。
3 讨论
志贺氏菌属(Shigella)是人类细菌性痢疾最为常见的病原菌,通称痢疾杆菌[6-8]。志贺氏菌是一类兼性厌氧、不产生芽孢的革兰氏阴性杆菌[9]。志贺氏菌属细菌杆状或短杆状,没有成荚膜,无鞭毛,一般有菌毛的形态与一般肠道杆菌无明显区别,长 2~3 μm、宽 0.5~0.7μm,对营养要求不高,能在普通培养基上生长[10];最适生长温度为 37 ℃,最适 pH 值为 6.4~7.8。志贺氏菌可分解葡萄糖,产酸不产气,不分解尿素,不形成硫化氢,不能利用柠檬酸盐或丙二酸盐作为唯一碳源[11-12]。
志贺氏菌的分离也受到人们的关注,现在关于志贺氏菌的分离多数是在临床上进行的,而在动物方面的分离应用还较少,对该细菌的分离手段越来越多[13],由于现在技术的发达,在很多试验室已经使用全自动的微生物检定仪、分子鉴定方法等对细菌进行分离及鉴定[14]。
隐性乳房炎是危害奶牛产业发展的重要疾病之一。造成隐性乳房炎的主要病原微生物包括来源于环境污染的大肠埃希氏菌、乳房链球菌、化脓性棒状杆菌等,以及通过接触性传染的无乳链球菌、停乳链球菌、金黄色葡萄球菌和志贺氏菌等,但以大肠杆菌、链球菌和金黄色葡萄球菌为主,引起我国奶牛乳房炎的病原菌中金黄色葡萄球菌分离率达到了约40%,大肠埃希氏菌分离率约为30%,停乳链球菌、无乳链球菌及其他细菌所占比例较低[15]。对这些病原菌的鉴定主要以生理生化鉴定为主,借助于分子生物学鉴定奶样中志贺氏菌的相关文献还未见报道[16-17]。本研究根据GenBank中登录的志贺氏菌16S rRNA序列,设计特异性引物,通过PCR技术从经过生理生化鉴定的细菌DNA中扩增16S rRNA,并对PCR产物进行测序与同源性对比,结果表明分离的病原菌经PCR鉴定为志贺氏菌, 为隐性乳房炎中志贺氏菌的分子生物学检测奠定基础,为隐性乳房炎中志贺氏菌的检测提供了新的方法和参考依据,该研究具有重要的意义。
细菌的分离鉴定方法很多,可以是常规的生化鉴定,也可以是分子生化鉴定,包括DNA测定、PCR技术、血清鉴定等[18-20]。随着分子生物学的快速发展,越来越多的人采用分子生物学鉴定方法,利用分子生物学鉴定能更快速便捷地检测出隐性乳房炎中的病原微生物[21-23]。本试验应用常规生化鉴定方法和分子生物学鉴定相结合,虽然该方法所需的时间较长,耗费的人力物力较多,但是最终鉴定的结果准确性和灵敏度高,是其他检测方法无法比拟的。
:
[1]李明杰. 奶牛乳房炎的危害及综合防治措施[J]. 畜牧与饲料科学,2009,30(3):172-172.
[2]马庆辉,余 州,李 峰,等. 奶牛隐性乳房炎研究进展[J]. 动物医学进展,2008,29(1):91-95.
[3]李 勇,葛秀国,窦忠英. 奶牛隐性乳房炎的研究进展[J]. 黄牛杂志,2003,29(3):38-41.
[4]游勇来,陈 文. 动物源性食品中志贺氏菌的分离与鉴定[J]. 检验检疫学刊,2010,20(5):35-37.
[5]王建昌,陈志敏,李 静,等. 4种分离培养基检测志贺氏菌效果比较[J]. 中国酿造,2014,33(3):113-116.
[6]胡建华,李洁莉,马兆飞,等. 牛奶样品中志贺氏菌的快速PCR检测技术研究[J]. 食品科学,2007,28(8):433-437.
[7]刘 慧. 现代食品微生物学[M]. 北京:中国轻工业出版社,2004:412-413.
[8]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:78-79.
[9]赵 斌,何绍红. 微生物学实验[M]. 北京:科学出版社,2009:141-143.
[10]康静静,杨玉荣,梁宏德. 志贺氏菌病发病机制的研究进展[J]. 中国农业科学,2011,44(9):1939-1944.
[11]刘均风,郁丙芝,孙天梅,等. 6株鲍氏志贺氏菌的分离与鉴定[J]. 临床检验杂志,1991,9(1):34.
[12]杨永珍,许兰菊,张丹鹤,等. 河南省部分地区鸡志贺氏菌病病原分离鉴定及药敏试验[J]. 河南农业科学,2011,40(3):134-139.
[13]王 芳,余 滨,陈 智,等. 武汉市2010年志贺氏菌菌株情况分析[J]. 公共卫生与预防医学,2011,22(2):42-44.
[14]林晓丽,赖卫华,张莉莉. 志贺氏菌检测方法的最新研究进展[J]. 食品科学,2009,30(15):271-275.
[15]金兰梅,伍清林,马高民,等. 规模化奶牛场奶牛乳房炎病原菌的分离与药敏试验[J]. 黑龙江畜牧兽医(科技版),2010(23):101-103.
[16]Sharma N,Rho G J,Hong Y H,et al. Bovine mastitis:an Asian perspective[J]. Asian Journal of Animal and Veterinary Advances,2012,7(6):454-476.
[17]Saidi R,Khelef D,Kaidi R. Bovine mastitis:prevalence of bacterial pathogens and evaluation of early screening test[J]. Afr J Microbiol Res,2013,7(9):777-782.
[18]邵 锴,邱业先,徐 婧. 高效溶磷菌的筛选、鉴定及其溶磷特性[J]. 江苏农业科学,2017,45(8):253-257.
[19]李梦茜,张振旺. 罗非鱼细菌性败血症病原菌嗜水气单胞菌拮抗菌株的筛选和鉴定[J]. 江苏农业科学,2017,45(3):129-131.
[20]张 蕾,蒋继志,于永昂. 拮抗细菌TD-12菌株发酵条件的优化及鉴定[J]. 江苏农业科学,2016,44(2):143-146.
[21]黄宝华,陈庆森,庞广昌. 志贺氏菌研究及其快速检测技术发展现状[J]. 食品科学,2004,25(11):333-336.
[22]姜 铮,王 芳,何 湘,等. 志贺氏菌致病机制研究进展[J]. 中国热带医学,2009,9(7):1372-1374.
[23]马庆辉,余 州,李 峰,等. 奶牛隐性乳房炎研究进展[J]. 动物医学进展,2008,29(1):91-95.
