木薯MeTPS1基因克隆、表达及生物信息学分析
2018-05-30丁泽红付莉莉吴春来
丁泽红, 付莉莉, 吴春来, 胡 伟
(中国热带农业科学院热带生物技术研究所,海南海口 571101)
海藻糖是由2个葡萄糖分子通过α-1,1糖苷键结合而成的非还原性双糖[1]。海藻糖具有生物抗逆性,其含量在干旱、低温、氧化和热胁迫等条件下被大量积累[2],可以在非生物胁迫下保护核酸、蛋白质、细胞膜等生物大分子物质,从而增强植物的抗逆性[3-4]。海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase,简称TPS)是海藻糖生物合成途径中的一个关键酶,即尿苷二磷酸葡萄糖和6-磷酸葡萄糖在TPS催化作用下生成6-磷酸海藻糖,之后在海藻糖-6-磷酸酯酶的水解作用下生成海藻糖[5]。在大多数植物中,海藻糖的含量非常低(鲜质量含量<10 μmol/g),但是通过调节TPS基因的表达可以提高海藻糖的含量并且不影响植株生长[6]。将拟南芥AtTPS1基因转入烟草后,转基因植株体内海藻糖含量显著增加,其耐受盐胁迫的能力显著增强[4]。在干旱、低温和高盐条件下,水稻OsTPS1转基因植株抗性明显增强,与对照相比,转基因植株体内海藻糖含量约增加了2倍[3,7]。TPS基因的表达受到干旱、低温、遮阴等非生物胁迫的调控。在低温胁迫条件下,茶树CsTPS、辣椒CaTPS、小麦TaTPS的表达量显著增加[8-10];在干旱胁迫条件下,棉花GhTPS和海带SjTPS的表达量显著增加[11-13];在遮阴胁迫条件下,玉米TPS基因的表达量也发生了显著变化[14]。此外,TPS基因的表达量在植物的不同组织中也不尽相同,呈现出差异表达的特点[8-9]。这些研究充分表明,TPS是一个重要的抵御干旱、低温等非生物胁迫的候选基因,提高其表达水平可以增强植物的抗逆性。
木薯是大戟科块根植物,是热带、亚热带地区重要的经济作物和粮食作物。木薯具有较好的抗旱特性,然而在长时间或较为严重的干旱条件下,其块根产量会显著下降[15-16]。除了干旱,木薯产量还常常受到低温、遮阴等环境因素的影响。作为典型的热带作物,木薯对低温胁迫非常敏感,极端的低温天气可造成木薯产量大幅减少甚至绝收[17]。此外,由于长期受耕作方式的影响,在某些经济落后的地区(如拉丁美洲),农民常常将木薯和橡胶树、玉米等作物间作在一起,以达到土地使用效率的最大化。在这种情况下,木薯经常会受到不同程度的遮阴,其产量也会显著减少[18-19]。因此,提高木薯对干旱、低温、遮阴等非生物胁迫的耐受性,使其在恶劣环境下维持原有块根产量,或是减少产量的损失具有重要意义。
至今,尚没有关于木薯TPS基因克隆及其参与非生物胁迫调控的报道。本研究采用同源基因克隆的方法从木薯叶片中克隆了1个海藻糖合成酶基因(命名为MeTPS1),之后从进化树、保守结构域和启动子元件等方面对其进行初步的生物信息学分析,同时研究其在不同组织之间,以及在干旱、低温、遮阴和脱落酸(ABA)胁迫处理下的表达模式,为进一步研究MeTPS1的功能奠定了理论基础。
1 材料与方法
1.1 试验材料
本研究所用木薯材料为木薯栽培品种Ku50,它具有高产、高淀粉含量的特性,由中国热带农业科学院热带生物技术研究所提供。RNA提取试剂盒(货号:DP437),购自天根生化科技(北京)有限公司;cDNA反转录试剂盒(货号:K1622),购自Fermentas公司。
1.2 木薯种植与处理
木薯种植按照Ding等的方法[19-20]进行:在木薯种植季节(2013年5月),将木薯种茎切成长度约15 cm的茎段,挑选粗细均匀一致且具有3~4个芽眼的茎段扦插于塑料盆(高18.8 cm,上直径18.5 cm,下直径14.8 cm)中,每盆1个茎段。基质采用营养土与蛭石以体积比1 ∶1进行混合。木薯种植约10 d后进行间苗,保留1株/盆。试验地点为中国热带农业科学院热带生物技术研究所。
PEG处理:种植60 d后,选取长势一致的植株,用20% PEG 6000溶液进行模拟干旱处理,同时以不施PEG(浇灌自来水)的植株为对照。在处理0、3、24 h后,分别收集未展开叶、第1张完全展开叶、老叶和根的样品,液氮速冻,-80 ℃保存备用。
低温处理:种植60 d后,选取长势一致的植株放置于光照培养箱内,进行4 ℃低温胁迫处理。在处理0、6、24 h后,分别收集未展开叶、第1张完全展开叶和根的样品,液氮速冻,-80 ℃保存备用。
ABA处理:种植60 d后,选取长势一致的植株,采用 100 μmol/L ABA溶液进行浇灌处理,在处理0、3、5、7 d后收集第1张完全展开叶的样品,液氮速冻,-80 ℃保存备用。
遮阴处理:将遮阴处理的木薯种植于橡胶树下,将对照处理的木薯种植于室外。种植60 d后,选择生长状况较一致的植株,收集未展开叶、第1张完全展开叶和老叶的样品,液氮速冻,-80 ℃保存备用。
为了比较不同组织中MeTPS1基因的表达情况,笔者还收集了木薯Ku50叶片、叶柄、茎、须根和储藏根的样本,用于实时荧光定量PCR(quantitative real-time polymerase chain reaction,简称qRT-PCR)分析。
1.3 引物合成及qRT-PCR
采用Primer 6.0软件设计引物,由生工生物工程(上海)股份有限公司合成,包括actin基因引物(L1:5′-TGATGAGTCTGGTCCATCCA-3′;R1:5′-CCTCCTACG ACCCAATCTCA-3′)[21]、MeTPS1基因qRT-PCR引物(L2:5′-TAGACACTCCTGGGCGAAGA-3′;R2:5′-CTGCC AGCCACATGTCAAAC-3′)和MeTPS1基因全长扩增引物(L3:5′-ATGCCTGGAAACC AGTACAACA-3′;R3:5′-TCAAGGAGATGCATTGGCT-3′)。采用RNA提取试剂盒抽提木薯总RNA,之后用cDNA反转录试剂盒将总RNA反转录成cDNA,-20 ℃储存备用。用SYBR Green Ⅰ试剂盒(TaKaRa公司),按照操作说明在Mx 3005P荧光定量PCR仪(Stratagene,美国)上进行qRT-PCR分析。每个样品设3次生物学重复,表达量按照2-ΔΔCT计算[22]。
1.4 生物信息学分析
用ExPASy ProtParam软件分析蛋白质的分子量和等电点;用Plant-mPLoc软件预测亚细胞定位情况;用NCBI-CDD数据库分析保守结构域;用BLASTp搜索Phytozome数据库,获取其他物种与MeTPS1同源的蛋白质序列;用ClustalX进行序列比对;用MEGA5.2软件构建进化树;用PlantCARE进行启动子元件分析。
2 结果与分析
2.1MeTPS1基因克隆
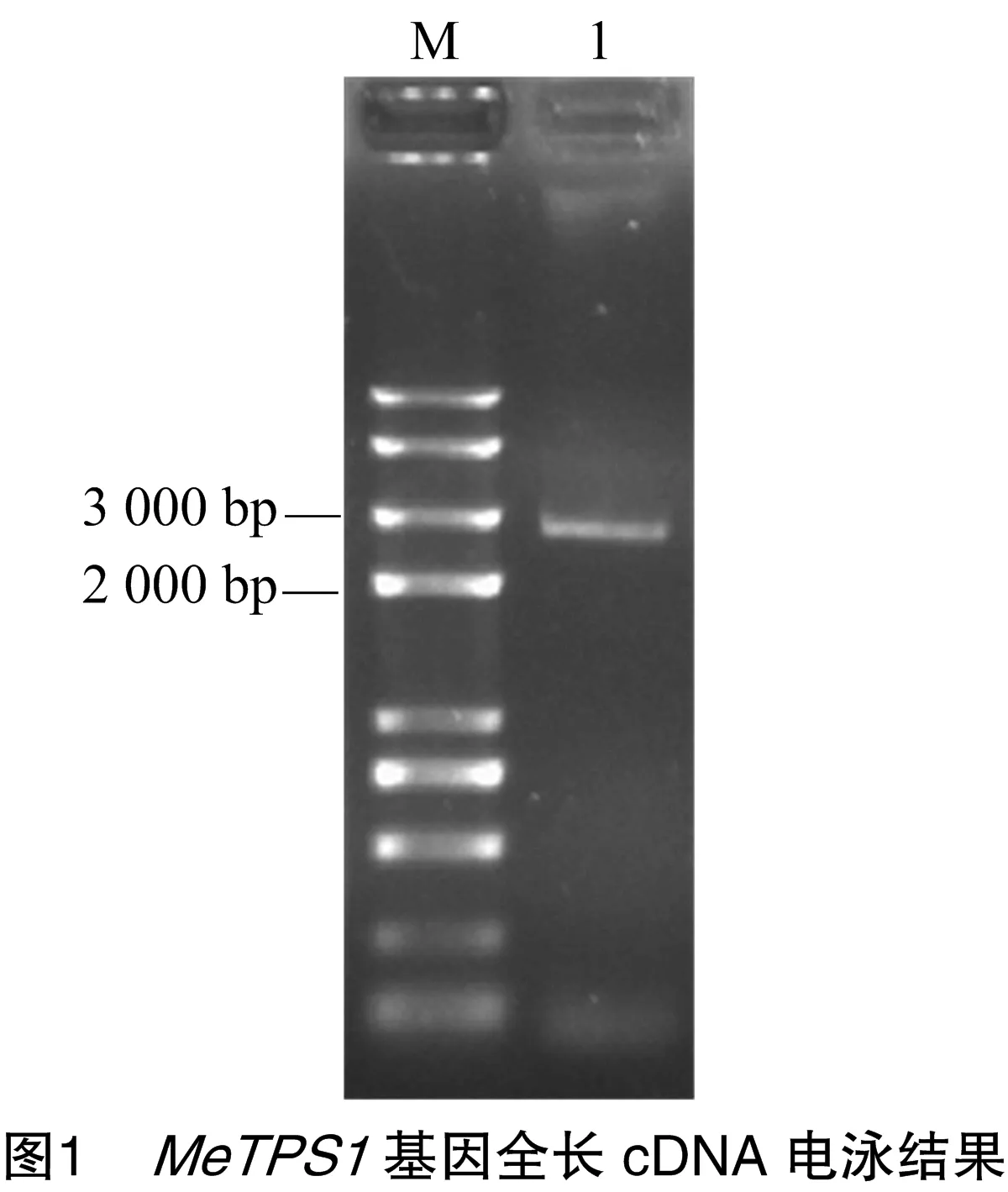
用拟南芥AtTPS1基因(登录号:At1g78580)的蛋白质序列进行BLASTp搜索Phytozome数据库,获得其在木薯中的同源序列(cassava4.1_001223m),之后设计引物进行PCR扩增(图1)。测序后获得1个全长为2 781 bp的序列,编码926个氨基酸(图2),根据该序列与拟南芥TPS基因的同源性,将其命名为MeTPS1。经序列比对,发现MeTPS1与参考序列之间共存在3个碱基差异,其中1个为非同义突变(图2)。将MeTPS1与基因组序列比对得知,该基因含有17个外显子和16个内含子。ProtParam理化性质预测MeTPS1蛋白质的分子式为C4 639H7 296N1 314O1 382S32,分子量为104 614.86 u,理论等电点(pI)为6.34,不稳定系数为49.05,属于不稳定蛋白。亚细胞定位预测结果显示,该蛋白质定位于叶绿体。蛋白质保守结构域分析表明,MeTPS1编码的蛋白含有TPS家族保守结构域(Glyco_transf_20,图3),进一步表明克隆得到的基因为木薯MeTPS1基因。
2.2 MeTPS1基因进化树分析
采用BLASTp同源比对的方法,笔者获取了其他物种中与MeTPS1同源性较高的蛋白质序列。系统进化树分析表明,这些基因大体上可以被分为3组:第Ⅰ组以C4物种为代表,包括谷子、狗尾草、玉米、高粱、黍羊、柳枝稷和二穗短柄草;第Ⅱ组以杨柳目的物种为代表,包括木薯、杨树和杞柳,因此MeTPS1与其在杨树(Potri.011G103900.2)、杞柳(SapurV1A.0026s0140.6)中同源基因的亲缘关系较近,序列相似性分别为88.1%、89.4%;第Ⅲ组以十字花科的物种为代表,包括白菜型油菜、拟南芥、荠菜花、琴叶拟南芥和鼠耳芥(图4)。
2.3 MeTPS1基因启动子元件分析
启动子是控制基因转录起始时间和表达程度的重要组成部分。本研究选取MeTPS1起始密码子上游1 500 bp的序列进行启动子元件分析,发现了一些与胁迫相关的元件,如干旱诱导元件MBS、热胁迫响应元件HSE、以及防御和胁迫响应元件TC-rich repeats(表1)。除此之外,笔者还发现一些与激素相关的元件,如赤霉素响应元件GARE-motif、水杨酸响应元件TCA-element、生长素响应元件TGA-element,以及与光响应相关的元件,如ACE、Box 4和Box I等(表1)。这些结果表明,MeTPS1可能参与木薯干旱、高温/低温、 激素和光照(如遮阴)相关的基因调控。

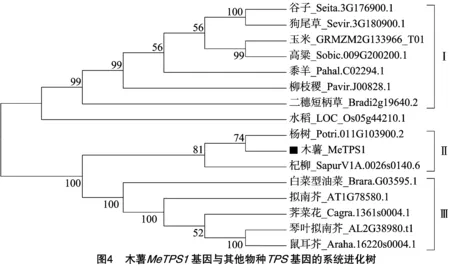
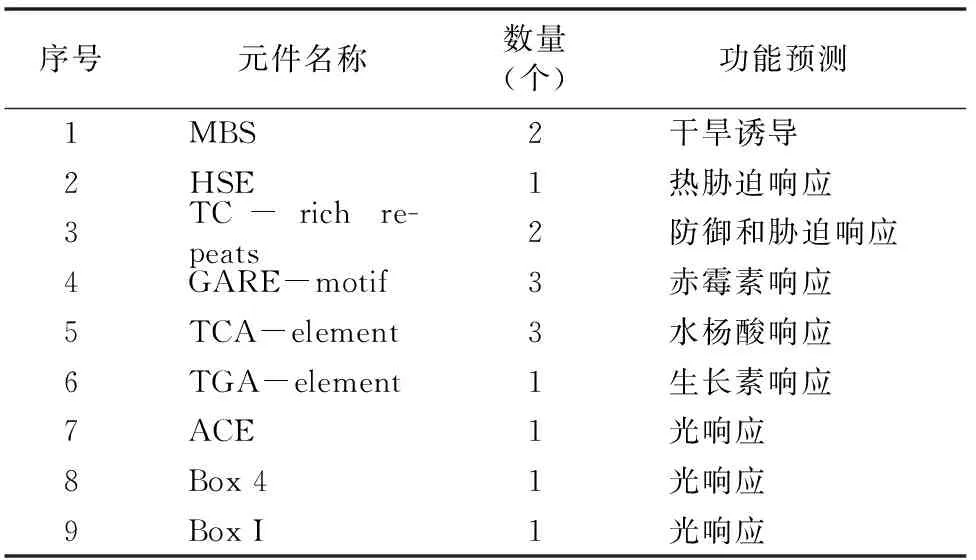
表1 MeTPS1基因启动子元件分析
2.4 MeTPS1基因在木薯不同组织中的表达分析
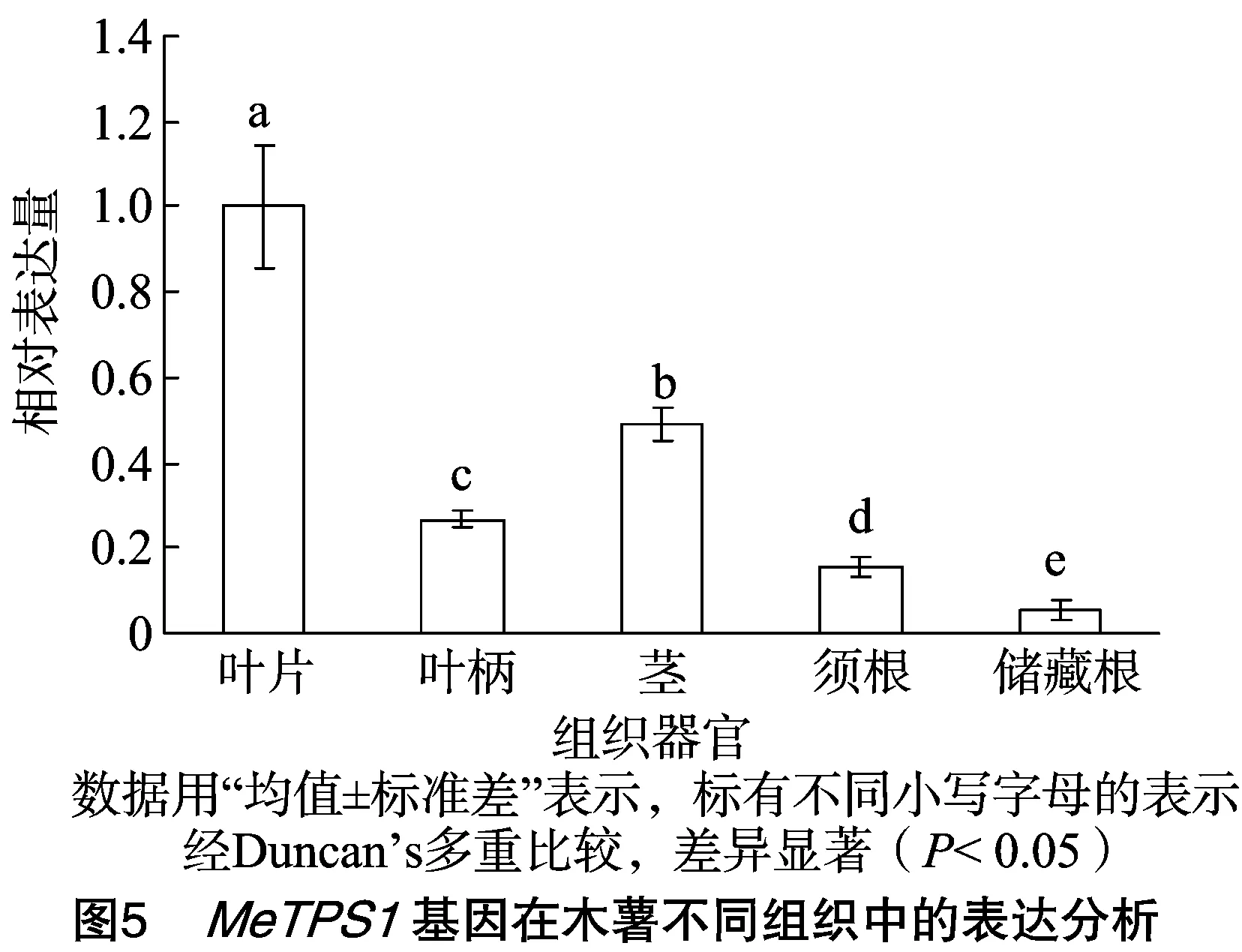
前人研究表明,TPS基因在植物不同组织器官中的表达量差异很大。本研究考察了MeTPS1基因在木薯Ku50不同组织中的表达情况。结果表明,MeTPS1在叶片中的表达量最高,其次是茎、叶柄、须根和储藏根中的表达量,分别是叶片中的49%、27%、16%、5%(图5)。这些结果表明,MeTPS1基因主要在木薯的叶片中起作用,而在根(特别是储藏根)中的作用可能比较有限。
2.5 MeTPS1基因在不同胁迫条件下的表达分析
本研究分别考察了MeTPS1基因在干旱、低温、遮阴和ABA处理条件下不同组织中的表达情况。在PEG 6000胁迫条件(模拟干旱)下,MeTPS1的表达量在未展开叶中呈现先上升后下降的变化趋势, 在胁迫处理3、24 h后与处理0 d相比分别上升了30%、下降了40%;在第1张完全展开叶和老叶中,MeTPS1的表达量在3 h内均没有显著变化,而在24 h分别下降了50%和70%;在根中MeTPS1的表达量在3 h上升了60%,之后在24 h又恢复到初始水平(图6-A)。在低温胁迫条件下,MeTPS1的表达量在不同组织中也呈现不同的表达模式:在未展开叶中MeTPS1的表达量先下降后上升;在第1张完全展开叶中,MeTPS1的表达量持续上升,在低温处理6、24 h后分别上升了1.3、2.2倍;在根中,MeTPS1的表达量呈现先上升后下降的变化趋势(图6-B)。在遮阴条件下,MeTPS1的表达量在未展开叶、第1张完全展开叶中没有显著变化,但在老叶中其表达量被显著诱导了,增加了约30%(图6-C)。然而,在ABA处理3、5、7 d后,MeTPS1的表达量均没有显著变化(图6-D)。

这些结果充分表明,MeTPS1基因的表达受到干旱、低温和遮阴处理显著诱导,在木薯各组织中呈现截然不同的表达模式,但是MeTPS1基因表达量与ABA胁迫处理没有表现出必然联系。
3 讨论与结论
TPS是海藻糖生物合成途径中的一个关键酶,是植物进行遗传改良以抵御干旱、低温等逆境胁迫的一个重要候选基因。植物中TPS基因以基因家族的形式存在,绝大部分TPS蛋白都含有TPS基因家族保守结构域[14]。目前,人们已经先后从拟南芥[23]、水稻[7]、小麦[10]、棉花[12]、茶树[8]、香蕉[24-25]、辣椒[9]等多个物种中克隆了TPS基因,并对其功能进行了深入研究,但在木薯中尚没有TPS基因克隆的相关报道。本研究采用同源基因克隆的方法,从木薯叶片中克隆了1个TPS基因,命名为MeTPS1。序列分析表明,MeTPS1编码926个氨基酸,含有TPS家族保守结构域。进化树分析表明,MeTPS1与杨树和杞柳TPS基因的亲缘关系较近,序列相似性分别达到88.1%和89.4%。
许多研究表明,TPS基因在植物不同组织器官中的表达量差异很大[8-9,26]。例如,辣椒CaTPS在叶片中的表达量大约是根和茎中的5~6倍[9];香蕉MaTPS在叶片、球茎和花中的表达量较大,而在根和果实中的表达量极少[25];茶树CsTPS基因在花中的表达量最高,在根中的次之,其次是在茎、芽、叶和种子中的,且表达丰度仅为花的13%~41%[8]。本研究发现,MeTPS1在叶片中的表达量最高,其丰度是茎、叶柄、须根和储藏根的2~20倍,呈现出明显的组织表达特异性。这些研究结果表明,TPS基因可能在植物不同组织中扮演着不同的功能。
TPS基因的表达量受到干旱、低温、遮阴等非生物胁迫的诱导[11,14]。在干旱胁迫条件下,棉花GhTPS和海带SjTPS的表达量显著增强[11-12];在低温胁迫条件下,茶树CsTPS和辣椒CaTPS的表达量被显著诱导[8-9]。启动子是基因表达调控的重要元件,通过对MeTPS1启动子序列分析,发现了干旱相关元件MBS、热胁迫相关元件HSE,以及许多与光响应相关的元件(如ACE、Box I、Box 4等),从而提示MeTPS1可能参与木薯干旱、低温和光照(如遮阴)相关的基因调控。脱落酸(abscisic acid,简称ABA)是调节植物生长发育非常重要的一种激素,是植物响应干旱、低温等非生物胁迫信号的传导者[27-30]。为此,笔者分别在干旱、低温、遮阴和ABA处理条件下,在木薯不同叶片和根中对MeTPS1基因的表达模式进行详细的研究。试验结果表明,MeTPS1基因表达受干旱、低温和遮阴胁迫显著诱导,但对ABA胁迫处理没有明显反应,暗示MeTPS1参与木薯干旱、低温和遮阴胁迫反应的信号传导路径是不依赖于ABA的。这一点与MeTPS1启动子元件的分析结果是一致的,因为本研究没有发现任何与ABA响应相关的元件。这些研究结果为进一步研究MeTPS1参与木薯非生物胁迫的分子机制奠定了扎实的工作基础,同时也为木薯抗逆遗传改良工作的实施提供了重要的理论依据。
本研究克隆了1个木薯海藻糖合成酶基因MeTPS1,该基因编码926个氨基酸,含有TPS家族保守结构域,它与杨树和杞柳中同源基因的亲缘关系较近。启动子元件分析表明,MeTPS1含有干旱诱导元件(MBS)、热胁迫响应元件(HSE)、防御和胁迫响应元件(TC-rich repeats)以及光响应元件(ACE、Box I、Box 4)等。表达分析结果显示,MeTPS1在叶片中的表达量最高,在须根和储藏根中的表达量最低。而且,MeTPS1基因的表达能被干旱、低温和遮阴胁迫处理显著诱导,但对ABA胁迫处理无明显响应。因此可见,MeTPS1可作为一个重要的候选基因应用于木薯抗逆遗传改良中。
:
[1]张 雯,王宇斐,郭延平. 高等植物6-磷酸海藻糖信号调控研究进展[J]. 植物生理学报,2016,52(4):394-400.
[2]张建波,王莎莎,郝大海,等. 干旱和低温胁迫影响烟草幼苗海藻糖代谢的差异比较[J]. 生物技术通报,2015,31(10):111-118.
[3]Garg A K,Kim J K,Owens T G,et al. Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(25):15898-15903.
[4]郭 蓓,胡 磊,何 欣,等. 海藻糖-6-磷酸合成酶转基因烟草提高耐盐性的研究[J]. 植物学通报,2008,25(1):41-49.
[5]史健志,徐 燕,纪德华,等. 坛紫菜6-磷酸海藻糖合成酶(TPS)家族基因的克隆及表达特征分析[J]. 水产学报,2015,39(4):485-495.
[6]Jang I C,Oh S J,Seo J S,et al. Expression of a bifunctional fusion of theEscherichiacoligenes for trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase in transgenic rice plants increases trehalose accumulation and abiotic stress tolerance without stunting growth[J]. Plant Physiology,2003,131(2):516-524.
[7]Li H W,Zang B S,Deng X W,et al. Overexpression of the trehalose-6-phosphate synthase geneOsTPS1 enhances abiotic stress tolerance in rice[J]. Planta,2011,234(5):1007-1018.
[8]丁 菲,庞 磊,李叶云,等. 茶树海藻糖-6-磷酸合成酶基因(CsTPS)的克隆及表达分析[J]. 农业生物技术学报,2012,20(11):1253-1261.
[9]魏兵强,王兰兰,张 茹,等. 辣椒TPS家族成员的鉴定与CaTPS1的表达分析[J]. 园艺学报,2016,43(8):1504-1512.
[10]黄 鹤,李卓夫,王晓楠,等. 低温下冬小麦与中国春的TPS基因表达分析[J]. 核农学报,2016,30(7):1255-1262.
[11]Deng Y Y,Wang X L,Guo H,et al. A trehalose-6-phosphate synthase gene fromSaccharinajaponica(Laminariales,Phaeophyceae)[J]. Molecular Biology Reports,2014,41(1):529-536.
[12]Kosmas S A,Argyrokastritis A,Loukas M G,et al. Isolation and characterization of drought-related trehalose 6-phosphate-synthase gene from cultivated cotton (GossypiumhirsutumL.)[J]. Planta,2006,223(2):329-339.
[13]Mu M,Lu X K,Wang J J,et al. Genome-wide identification and analysis of the stress-resistance function of the TPS (Trehalose-6-Phosphate Synthase) gene family in cotton[J]. BMC Genetics,2016,17(1):54.
[14]Henry C,Bledsoe S W,Siekman A,et al. The trehalose pathway in maize:conservation and gene regulation in response to the diurnal cycle and extended darkness[J]. Journal of Experimental Botany,2014,65(20):5959-5973.
[15]Okogbenin E,Setter T L,Ferguson M,et al. Phenotypic approaches to drought in cassava:a review[J]. Frontiers in Physiology,2013,4:93.
[16]Brown A L,Cavagnaro T R,Gleadow R,et al. Interactive effects of temperature and drought on cassava growth and toxicity:implications for food security?[J]. Global Change Biology,2016,22(10):3461-3473.
[17]卢赛清,盘 欢,马崇熙,等. 2008年广西木薯低温冻害情况及应对措施[J]. 广西热带农业,2009(1):21-22.
[18]Okoli P S O,Wilson G F. Response of cassava (ManihotesculentaCrantz) to shade under field conditions[J]. Field Crops Research,1986,14(4):349-359.
[19]Ding Z H,Zhang Y,Xiao Y,et al. Transcriptome response of cassava leaves under natural shade[J]. Scientific Reports,2016,6:31673.
[20]丁泽红,付莉莉,铁韦韦,等. 木薯MeNCED3基因克隆,结构变异及其表达分析[J]. 生物技术通报,2016,32(10):148-153.
[21]Xu J,Duan X,Yang J,et al. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots[J]. Plant Physiology,2013,161(3):1517-1528.
[22]Fu L L,Ding Z H,Han B Y,et al. Physiological investigation and transcriptome analysis of polyethylene glycol (PEG)-induced dehydration stress in cassava[J]. International Journal of Molecular Sciences,2016,17(3):283.
[23]Delorge I,Figueroa C M,Feil R,et al. Trehalose-6-phosphate synthase 1 is not the only active TPS inArabidopsisthaliana[J]. Biochemical Journal,2014,466(2):283-290.
[24]邢文婷,李科明,贾彩红,等. 香蕉海藻糖合成酶基因(MaTPS5)生物学及表达特性分析[J]. 生物技术通报,2017,33(2):118-124.
[25]许桂莺,徐碧玉,邢文婷,等. 香蕉MaTPS4基因序列及表达特性分析[J]. 热带作物学报,2016,37(3):532-538.
[26]Yang H L,Liu Y J,Wang C L,et al. Molecular evolution of trehalose-6-phosphate synthase(TPS)gene family inPopulus,Arabidopsisand rice[J]. PLoS One,2012,7(8):e42438.
[27]江 敏,刘 才,宁慧宇,等. 脱落酸对涝渍条件下棉花幼苗生长及相关生理指标的影响[J]. 江苏农业科学,2017,45(7):73-75.
[28]蔡凤香,陈豆豆,杨 飞,等. 镉锌互作条件下ABA对水稻幼苗根系生长和生长素分布的影响[J]. 江苏农业科学,2016,44(6):114-117.
[29]Shinozaki K,Yamaguchi-Shinozaki K. Gene networks involved in drought stress response and tolerance[J]. Journal of Experimental Botany,2007,58(2):221-227.
[30]De Zelicourt A,Colcombet J,Hirt H. The role of MAPK modules and ABA during abiotic stress signaling[J]. Trends in Plant Science,2016,21(8):677-685.
