抗菌肽SMAP-29在大肠杆菌中表达条件的优化及纯化研究
2018-05-30吴三桥赵冠杰
吴三桥, 赵冠杰, 万 健, 陈 琛
(陕西理工大学生物科学与工程学院/中德天然产物研究所,陕西汉中 723000)
近年来,抗生素的长期使用所带来的负面效应已越来越引起全社会的高度关注,药物残留和细菌耐药性等问题日渐严重,特别是2010年出现的“超级细菌”[1]事件再一次将滥用抗生素引发的日益严重的耐药菌株等问题摆在了公众面前,长期滥用抗生素所引起的食品安全、人类健康、环境污染等问题也受到了公众的广泛关注。因此,研制安全、高效、环保型抗生素替代品已迫在眉睫。
抗菌肽(antibacterial peptides)是生物体特定基因编码产生的一类小分子多肽,具有抵抗外界微生物侵害的作用,是生物天然免疫系统中的一个重要组成部分,与传统抗生素相比,抗菌肽具有热稳定好、水溶性好、强碱性、广谱抗菌和作用机制独特等特点[2-3]。
抗菌肽SMAP-29(sheep myeloid antibacterial peptides-29)是1995年Bagella等从绵羊Cathelicidins前体蛋白的羧基端截取的29个氨基酸残基序列,具有两亲性α-螺旋结构域,分子量约为3.2 ku,有很强的抗细菌、真菌、病毒等生物学功能[4-11]。抗菌肽SMAP-29天然含量非常低,化学合成成本较高,因此通过基因工程表达具有较好的前景。抗菌肽SMAP-29基因工程表达已有大量研究报道,但是未见采用小分子泛素样修饰蛋白(small ubiquitin-related modifier,SUMO)融合表达报道。
本试验以抗菌肽SMAP-29为研究对象,通过已构建的表达载体pSUMO-SMAP-29在大肠杆菌中诱导表达融合蛋白SUMO-SMAP-29,优化了融合蛋白SUMO-SMAP-29在大肠杆菌中的表达条件,并通过Ni柱亲和层析纯化了目的蛋白,旨在为其生物活性以及产业化开发奠定基础。
1 材料与方法
1.1 菌株、试剂
含有pSUMO-SMAP-29表达质粒的EscherichiacoliBL21(DE3)菌种由笔者所在实验室保存。
Protein Marker、IPTG、卡那霉素购自生工生物工程(上海)股份有限公司;Ni Sepharose柱购自美国GE Healthcare公司;其余试剂均为国产分析纯。
1.2 融合蛋白SUMO-SMAP-29表达条件的优化
1.2.1 细菌培养 将含重组质粒pSUMO-SMAP-29的E.coliBL21菌种接种于LB(50 μg/mL卡那霉素)固体培养基,37 ℃过夜培养。挑取新鲜单克隆接种于5 mL LB(50 μg/mL卡那霉素)液体培养基中,37 ℃、200 r/min振荡培养过夜。
1.2.2 不同浓度IPTG对目的蛋白表达量的影响 细菌培养方法同“1.2.1”节,然后按体积比1 ∶100的转接量将过夜培养的菌液接种于50 mL新鲜LB(50 μg/mL卡那霉素)液体培养基中,37 ℃、200 r/min振荡培养。当D600 nm约0.6时加IPTG至终浓度为0.25、0.50、1.00、2.00 mmol/L,在 37 ℃ 诱导1 h后各取样1 mL进行SDS-PAGE电泳分析。通过Quantity One和SPSS软件,分析融合蛋白SUMO-SMAP-29的相对表达量,以及IPTG浓度梯度各组之间是否有统计学差异。
1.2.3 不同诱导温度对目的蛋白表达量的影响 细菌培养方法同“1.2.1”节,然后按体积比1 ∶100的转接量将过夜培养的菌液接种于50 mL新鲜LB(50 μg/mL卡那霉素)液体培养基中,37 ℃、200 r/min振荡培养。当D600 nm约0.6时加IPTG至终浓度为0.50 mmol/L,分别在25、30、37、42 ℃诱导,1 h 后各取样1 mL,进行SDS-PAGE电泳分析。通过Quantity One和SPSS软件分析融合蛋白SUMO-SMAP-29的相对表达量,以及诱导温度梯度各组之间是否有统计学差异。
1.2.4 不同诱导时间对目的蛋白表达量的影响 细菌培养方法同“1.2.1”节,然后按体积比1 ∶100的转接量将过夜培养的菌液接种于50 mL新鲜LB(50 μg/mL卡那霉素)液体培养基中,37 ℃、200 r/min振荡培养。在培养至D600 nm约0.6时,加0.50 mmol/L IPTG,在30 ℃条件下诱导,分别于0、1、3、5、7 h取样1 mL,进行SDS-PAGE电泳分析。通过Quantity One和SPSS软件分析融合蛋白SUMO-SMAP-29的相对表达量,以及诱导时间梯度各组之间是否有统计学差异。
1.3 融合蛋白SUMO-SMAP-29的分离纯化
取诱导表达后的菌液离心收集菌体,用Binding Buffer(20 mmol/L Tris,500 mmol/L NaCl,10 mmol/L咪唑,pH值 8.0)重悬菌体,冰浴超声破菌,离心收集上清。将含目的蛋白的细菌破碎液上样于Ni-NTA纯化柱,调整流速(≤1.5 mL/min)后,用Wash Buffer(20 mmol/L Tris,500 mmol/L NaCl,20 mmol/L咪唑,pH值8.0)洗去杂蛋白,再用Elution Buffer(20 mmol/L Tris,500 mmol/L NaCl,250 mmol/L 咪唑,pH值8.0)洗脱,收集洗脱液,SDS-PAGE分析,其余样品用PBS于4 ℃过夜透析,透析液冷冻干燥后存于-80 ℃超低温冰箱。
2 结果与分析
2.1 融合蛋白SUMO-SMAP-29诱导表达条件的优化
2.1.1 不同IPTG浓度对大肠杆菌表达融合蛋白SUMO-SMAP-29的影响 SUMO标签蛋白分子量为14 ku,但是实际表现为18 ku,可能与其特殊的三级结构有关[12]。抗菌肽SMAP-29的分子量为3.2 ku,因此,融合蛋白的分子量表现为21 ku左右。SDS-PAGE电泳结果(图1)表明,在21 ku处可以明显看到融合蛋白SUMO-SMAP-29得到表达。0.25、0.50、1.00、2.00 mmol/L浓度的IPTG均能诱导大肠杆菌表达融合蛋白SUMO-SMAP-29。

通过Quantity One和SPSS软件,对不同IPTG浓度诱导情况下融合蛋白SUMO-SMAP-29的相对表达量进行分析,结果如表1和图2所示。诱导前,大肠杆菌本底水平表达了微量的融合蛋白,约占总蛋白的0.5%,当IPTG浓度为0.50、1.00 mmol/L时融合蛋白SUMO-SMAP-29的表达量相对较高,分别占菌体总蛋白的9.99%、10.02%,统计学分析显示两者差异不显著。因此,IPTG浓度在0.50~1.00 mmol/L之间均能相对高效地诱导融合蛋白SUMO-SMAP-29的表达,出于节约成本考虑,在后续试验中选择0.50 mmol/L IPTG为诱导浓度。

表1 不同IPTG浓度融合蛋白SUMO-SMAP-29的相对表达量
注:同列数据后不同小写字母表示组间差异显著(P<0.05)。下表同。

2.1.2 不同诱导温度对大肠杆菌表达融合蛋白SUMO-SMAP-29的影响 由图2可知,在诱导温度为25、30、37、42 ℃ 时,均能诱导大肠杆菌表达融合蛋白SUMO-SMAP-29。通过Quantity One软件对融合蛋白SUMO-SMAP-29的相对表达量进行分析,结果如表2和图2所示,当诱导温度为30、37 ℃时表达量相对较高,分别占菌体总蛋白的10.10%、9.95%,两者间差异不显著,因此30~37 ℃均能相对高效地诱导融合蛋白SUMO-SMAP-29的表达,为了降低对恒温培养箱的损耗,后续试验选择低一点的温度30 ℃作为诱导温度。
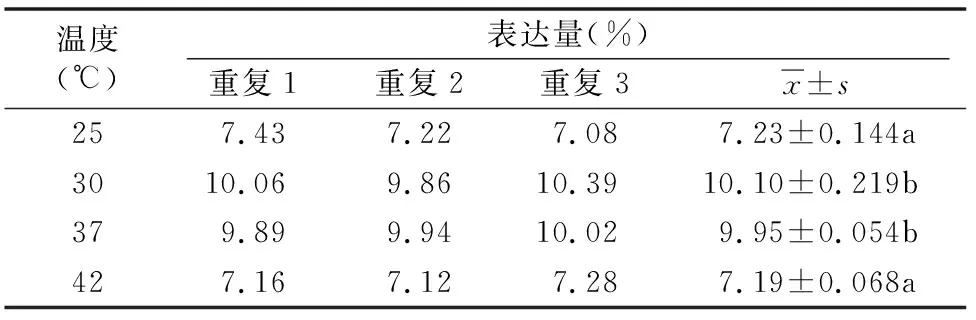
表2 不同诱导温度融合蛋白SUMO-SMAP-29的相对表达量
2.1.3 不同诱导时间对大肠杆菌表达融合蛋白SUMO-SMAP-29的影响 通过Quantity One和SPSS软件对融合蛋白SUMO-SMAP-29的相对表达量进行分析,结果如图3和表3所示,诱导表达后,融合蛋白SUMO-SMAP-29表达量0~3 h不断升高,在5 h处表达量达到相对较高的水平,占菌体总蛋白的11.35%;5 h后,融合蛋白SUMO-SMAP-29的表达量反而有所减少。统计学分析显示,诱导3、5 h的相对表达量差异不显著,出于节约时间的考虑,选取3 h作为诱导时间。
2.2 融合蛋白SUMO-SMAP-29的分离纯化
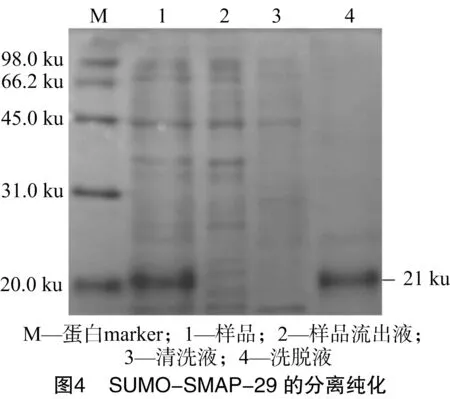
在诱导剂IPTG终浓度为0.50mmol/L、诱导温度为30 ℃、诱导3 h后收集菌液离心。经Ni柱亲和层析纯化后,分别取样品、样品流出液、清洗液以及洗脱液用SDS-PAGE电泳分析(图4),电泳结果显示获得了融合蛋白SUMO-SMAP-29。


表3 不同诱导时间对融合蛋白SUMO-SMAP-29的相对表达量
3 讨论
大肠杆菌具有培养条件简单、生长繁殖快、安全性好、可高效表达外源基因等优点,是目前抗菌肽表达采用最多的表达系统。抗菌肽SMAP-29因本身具有抗菌活性,对宿主菌具有杀伤作用,直接表达较困难。另外,因分子量小和阳离子特性容易被细胞中的蛋白酶降解,目前表达抗菌肽时常采用融合表达。融合表达模拟了抗菌肽在生物机体内合成时的前体结构[13],分子伴侣的作用类似于天然抗菌肽的前体部分。SUMO标签蛋白能促进目的蛋白的可溶性表达和正确折叠[14];对热和蛋白酶有很强的抗性,有利于保持目的蛋白的稳定性;SUMO分子量较小,表达融合蛋白中目的蛋白占比例较大,提高目的蛋白得率。
外界条件如IPTG浓度、诱导温度、诱导时间等对大肠杆菌表达外源蛋白有着十分重要的影响。研究发现,通过优化上述条件能够获得更高的表达量,但因表达菌株、质粒和外源蛋白的差异,最佳的表达条件也各不相同。
诱导剂IPTG浓度过低时,启动子没有完全启动,大肠杆菌无法最大化分泌外源蛋白;但IPTG浓度过高可能会对大肠杆菌有抑制作用,且IPTG一般价格不便宜,会造成试验经费上的浪费。本试验通过研究不同IPTG浓度对大肠杆菌表达SUMO-SMAP-29的影响发现,随着IPTG浓度的升高,融合蛋白SUMO-SMAP-29表达量增加,当IPTG浓度为 0.50、1.00 mmol/L时融合蛋白SUMO-SMAP-29表达量相对较高,统计分析显示表达量差异不显著;但IPTG浓度为 2.00 mmol/L 时,表达量反而下降,这可能与高浓度的IPTG对大肠杆菌有抑制作用相关,出于成本考虑,在本试验选择 0.50 mmol/L IPTG作为诱导浓度。
温度不仅影响大肠杆菌的生长,也对外源蛋白的稳定性有着一定的影响。在温度相对偏低时,菌体生长速率缓慢,代谢速率较低,外源蛋白表达量偏低。但在另一方面,低温有助于维持稳定外源蛋白的结构,高温可能会破坏外源蛋白的结构,研究发现温度过高(如42 ℃)时,融合蛋白SUMO-SMAP-29的表达量有所降低。本试验中发现诱导温度为30、 37 ℃ 时,融合蛋白SUMO-SMAP-29表达量相对较高,统计分析显示30、37 ℃诱导时融合蛋白SUMO-SMAP-29相对表达量之间差异不显著,为了降低对恒温培养箱的损耗,本试验选择低一点的温度(30 ℃)作为诱导温度。
诱导表达时间的优化影响着外源蛋白的最终产量。从外源蛋白开始被大肠杆菌表达至培养基中养分耗尽的过程中,外源蛋白的表达是一个不断变化的过程。因为随着诱导时间的延长,表达的外源蛋白越来越多,但是,外源蛋白也不断被蛋白酶降解。在本试验中,大肠杆菌在0~5 h这段时间大量表达融合蛋白SUMO-SMAP-29;5 h后,由于大肠杆菌表达SUMO-SMAP-29的速率下降,低于SUMO-SMAP-29被降解的速率,所以SUMO-SMAP-29开始减少。统计学分析显示,诱导3、5 h的相对表达量差异不显著,出于节约时间的考虑,选取3 h作为诱导时间。
相对于表达载体的构建和蛋白的诱导表达,外源蛋白的纯化更加困难和繁琐。Ni柱亲和层析是通过蛋白质暴露在表面的一些氨基酸残基(如组氨酸)和树脂上的金属离子之间的特异性结合进行纯化目的蛋白的,具有配体简单、吸附性强、分离条件适宜以及不影响蛋白质自身的生物活性等优点。融合标签SUMO自身带有6×His标签,因此本试验利用Ni柱亲和层析纯化重组融合蛋白SUMO-SMAP-29,且纯化效率较好。
本试验结果表明,融合蛋白SUMO-SMAP-29相对最优的诱导表达条件为IPTG终浓度0.50 mmol/L、诱导温度 30 ℃、诱导表达时间3 h。这为进一步研究抗菌肽SMAP-29的生物学活性及产业化开发奠定了必要的基础。
:
[1]Yong D,Toleman M A,Giske C G,et al. Characterization of a new metallo-beta-lactamase gene,b1aNDM-1,and a novel erythromycin esterase gene carried on a unique genetic structure inKlebsiellapneumoniaesequence type 14 from India[J]. Antimicrobial Agents and Chemotherapy,2009,53(12):5046-5054.
[2]Zasloff M. Antimicrobial peptides of multicellular organisms[J]. Nature,2002,415(6870):389-395.
[3]Silva N C,Sarmento B,Pintado M. The importance of antimicrobial peptides and their potential for therapeutic use in ophthalmology[J]. International Journal of Antimicrobial Agents,2013,41(1):5-10.
[4]Bagella L,Scocchi M,Zanetti M. cDNA sequences of three sheep myeloid cathelicidins[J]. FEBS Letters,1995,376(3):225-228.
[5]Lee D G,Kim P I,Park Y,et al. Antifungal mechanism of SMAP-29 (1-18) isolated from sheep myeloid mRNA againstTrichosporonbeigelii[J]. Biochemical and Biophysical Research Communications,2002,295(3):591-596.
[6]Arzese A,Skerlavaj B,Tomasinsig L,et al. Antimicrobial activity of SMAP-29 against theBacteroidesfragilisgroup and clostridia[J]. The Journal of Antimicrobial Chemotherapy,2003,52(3):375-381.
[7]Giacometti A,Cirioni O,Ghiselli R,et al. Cathelicidin peptide sheep myeloid antimicrobial peptide-29 prevents endotoxin-induced mortality in rat models of septic shock[J]. American Journal of Respiratory and Critical Care Medicine,2004,169(2):187-194.
[8]Skerlavaj B,Benincasa M,Risso A,et al. SMAP-29:a potent antibacterial and antifungal peptide from sheep leukocytes[J]. FEBS Letters,1999,463(1/2):58-62.
[9]Anderson R C,Hancock R E,Yu P L. Antimicrobial activity and bacterial-membrane interaction of ovine-derived cathelicidins[J]. Antimicrobial Agents and Chemotherapy,2004,48(2):673-676.
[10]陈 琛,吴三桥,李新生,等. 抗菌肽SMAP-29结构功能及分子设计策略[J]. 生物工程学报,2011,27(6):846-859.
[11]栾 超. 利用SUMO融合技术在枯草芽孢杆菌中重组表达抗菌肽cathelicidin-BF及其生物活性研究[D]. 杭州:浙江大学,2014.
[12]Vassilevski A A,Kozlov S A,Grishin E V. Antimicrobial peptide precursor structures suggest effective production strategies[J]. Recent Patents on Inflammation & Allergy Drug Discovery,2008,2(1):58-63.
[13]Malakhov M P,Mattern M R,Malakhova O A,et al. SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins[J]. Journal of Structural and Functional Genomics,2004,5(1/2):75-86.
[14]Butt T R,Edavettal S C,Hall J P,et al. SUMO fusion technology for difficult-to-express proteins[J]. Protein Expression and Purification,2005,43(1):1-9.
