MYCT1-GST原核表达载体的构建及鉴定
2018-05-30孙媛媛刘佳富伟能
孙媛媛,刘佳,富伟能
(中国医科大学 1. 基础医学院医学遗传学教研室,沈阳 110122; 2. 实验动物部,沈阳 110001)
MYCT1是本课题组前期应用定位克隆策略发现的与喉癌相关的致病基因,位于6q25,全长21 000 bp,含有2个外显子和1个内含子,mRNA序列长约1 006 bp[1]。MYCT1基因在不同肿瘤中发挥着不同的作用,如在多数实体瘤中发挥抑癌基因作用,在白血病中却发挥癌基因作用,提示MYCT1基因通过不同的信号通路发挥不同的功能[2-6]。然而,有关MYCT1基因在肿瘤发生发展中的具体分子机制仍不清楚,其相互作用蛋白质的筛查和鉴定将有助于明确其发挥作用的分子机制。
本研究中拟通过构建含有GST标签的MYCT1原核表达载体,获得大量的MYCT1-GST融合蛋白,为MYCT1相互作用蛋白质的筛查和鉴定奠定基础。
1 材料与方法
1.1 实验材料与试剂
全血RNA 提取试剂盒 (美国Galen Biopharm公司),反转录试剂盒、胶回收试剂盒、JM109菌株 (日本TaKaRa公司),pET28a (+) 载体 (中国上海吉凯基因公司) 、限制性内切酶NcoⅠ/ HindⅢ及PCR 相关试剂(日本TaKaRa 公司),无内毒素质粒中提试剂盒、BL21 (DE3) 菌株 (中国Tiangen公司),IPTG、琼脂糖粉末、胰蛋白胨、酵母提取物、氯化钠、卡那霉素 (美国Sigma公司),小鼠源GST标签抗体、辣根过氧化物酶标记的山羊抗鼠二抗 (中国Proteintech公司),ECL化学发光液、SDS-PAGE凝胶配制试剂盒、细菌蛋白提取试剂盒 (中国南京凯基公司) 。
1.2 实验方法
1.2.1 载体酶切和鉴定:将纯化的pET28a (+) 质粒应用NcoⅠ/ HindⅢ双酶切,并对载体酶切产物进行琼脂糖凝胶电泳,回收目的条带。
1.2.2 目的片段的获取:取正常人新鲜抗凝血,1 500 r/min离心10 min进行血浆分离,将血浆转移至1.5 mL无RNA酶离心管中,加500 mL TRIzol进行总RNA提取。以提取的RNA为模板,反转录成cDNA;然后进行PCR扩增目片段。引物序列如下:Forward,5’-AAGAAGGAGATATACCATGGTGTCCCCTATACT AGGTTATTGG- 3’;Reverse,5’- CGAGTGCGGCCGC AAGCTTTCAGGAATCTGGGAATGCCTTGATGATG -3’;CCATGG表示插入的NcoⅠ切酶位点,AAGCTT表示插入的HindⅢ内切酶位点。按照试剂盒说明书配制PCR 反应液,扩增条件如下:98 ℃ 5 min;98 ℃ 10 s、55 ℃ 10 s、72 ℃ 90 s,共30个循环;72 ℃ 8 min;4 ℃+∞。
1.2.3 MYCT1-GST表达载体的构建和鉴定:将扩增产物进行琼脂糖凝胶电泳,回收和纯化目的条带,与酶切后的pET28a (+) 空载体按1∶4比例混合,16℃连接过夜,并将连接产物加入含有100 μ L JM109感受态细菌中进行转化;将转化产物加入1 mL LB培养液,37℃恒温摇床培养1 h;将菌液涂布于含有卡纳霉素的LB平板,继续培养12~16 h;挑选单克隆菌落6~10个,放入2 mL含有卡纳霉素的LB液体培养基,37℃振摇培养10~12 h,提取重组质粒进行序列分析。挑取阳性克隆进行菌液PCR鉴定,按照试剂盒说明书配制PCR 反应液,扩增条件:94 ℃ 3 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,30个循环;72 ℃ 5 min;4 ℃ +∞,引物序列:Forward,5’- GAAATCCAG CAAGTATATAGC- 3’;Reverse,5’-TGCTAGTTATT GCTCAGCGG-3’ 。
1.2.4 中量提取质粒:将鉴定出的阳性转化子接种于50 mL含相应抗生素的LB液体培养基中,37 ℃培养12~16 h,6 000 g离心收集菌体。按照试剂盒说明书提取质粒DNA。
1.2.5 原核融合蛋白MYCT1-GST的纯化和鉴定:将MYCT1-GST重组质粒化转BL21 (DE3) 菌株,挑取单个克隆进行PCR鉴定。选取阳性克隆加入5 mL LB的10 mL试管里,37 ℃培养过夜。 将培养菌液转移到含有500 mL LB的1L锥形瓶中,37 ℃,225 r/min培养至OD600≈1.0~1.5,加入适当浓度的IPTG,在37℃下培养8 h。6 000 g离心收集细菌体,加入20 mL细菌裂解液 (PBS 1%Triton-100 PMSF) ,吹打混匀,冰上超声破碎至裂解液充分清凉,11 000 r/min,15 min,4 ℃离心分离上清。取50~70 μ L GST-琼脂糖微球到EP管中,用800 μ L PBS 1%Triton-100润洗1次,将提取的融合蛋白MYCT1-GST与之混匀,4 ℃层析柜旋转结合1 h。PBS 1%Triton-100洗3次,PBS洗3次,离心收集琼脂糖微球,加入40 μ L 5×上样缓冲液溶解琼脂糖微球上的蛋白,煮沸3 min,收集纯化好的重组蛋白。
配置10% SDS-PAGE凝胶,每孔上样量为20 μ L。连接电泳装置,以恒电压80 V进行电泳。当蛋白Marker进入分离胶后,将电压提至120 V,直至溴酚兰泳至凝胶下端附近 (约1.5 h) ,关闭电源,停止电泳。200 mA电转膜1 h,取出PVDF膜,放入封闭液中置于水平摇床上,室温封闭1 h。加入一抗溶液,置于摇床上4 ℃杂交过夜,加入二抗溶液,室温杂交1 h,ECL化学发光。
2 结果
2.1 载体酶切结果
提取纯化pET28a (+) 质粒 (图1A) ,应用NcoⅠ/HindⅢ双酶切该质粒,1%琼脂糖凝胶电泳分析得到1条5 400 bp条带,电泳结果与预期相符 (图1B) 与预期结果一致,提示酶切成功。
2.2 目的片段获取
通过实时PCR实验进行扩增MYCT1 CDS区,产物大小1 424 bp,通过1%琼脂糖凝胶电泳鉴定,结果与预期一致,见图2。
2.3 MYCT1-GST 表达载体的构建和鉴定
挑取阳性克隆进行菌液PCR鉴定,阳性转化子PCR产物大小为919 bp,与预期结果一致 (图3A) 。将鉴定出的阳性转化子进行测序,对测序结果与目的基因序列进行比对分析。结果显示,测序所得序列与目的基因MYCT1的CDS区完全一致 (图3B) 。

图1 pET28a (+) 空载体酶切结果Fig.1 Restriction digestion of the empty vector pET28a (+)

图2 MYCT1目的片段获取Fig.2 MYCT1 target fragment
2.4 融合蛋白MYCT1-GST的纯化与鉴定
通过PCR方法检测MYCT1-GST重组质粒转化效率,结果显示1~7号克隆均转化成功 (图4A) 。应用GST标签抗体通过Western blotting实验对融合蛋白MYCT1-GST进行鉴定,结果显示重组蛋白组 (M1-G)有融合蛋白MYCT1-GST表达而对照组只有GST蛋白表达,提示纯化成功 (图4B) 。
3 讨论
蛋白质是组成细胞结构的重要组分,也是行使功能的主要形式。在细胞中存在大量的蛋白通过与其他蛋白质结合形成复合体参与生命活动的调控[7-9]。因此,研究MYCT1相互作用蛋白将有助于揭示其在肿瘤中发挥的功能和参与的信号通路。
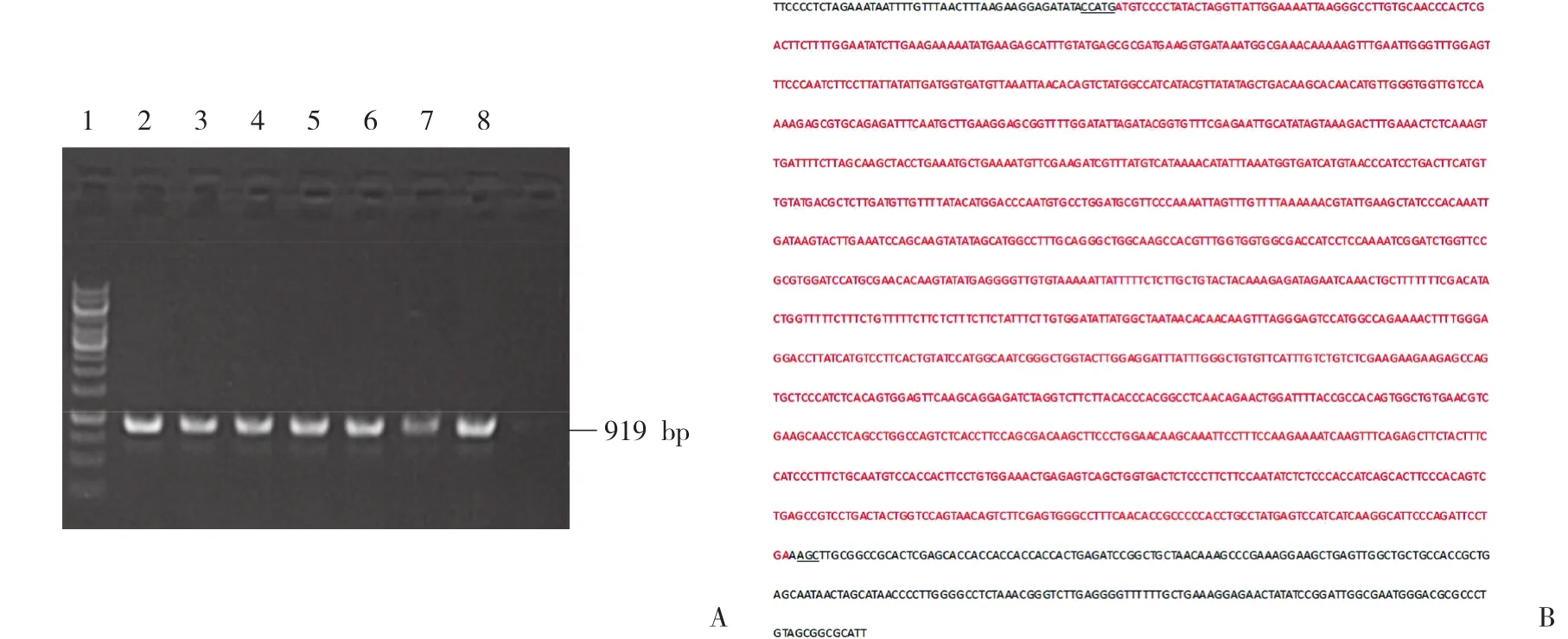
图3 MYCT1-GST 表达载体的构建和鉴定Fig.3 Identification of MYCT1-GST clones
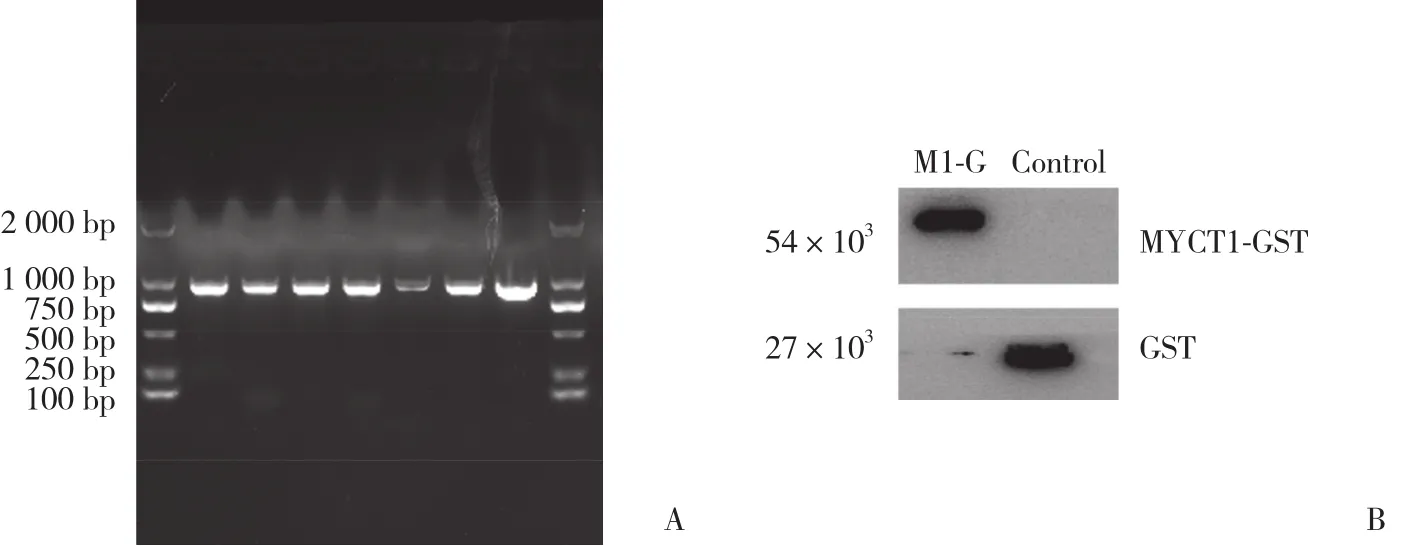
图4 融合蛋白MYCT1-GST的获得与鉴定Fig.4 Acquisition and identification of MYCT1-GST fusion protein
常用的相互作用蛋白研究方法包括GST-pull down、Co-IP、噬菌体展示技术、荧光共振能量转移显微成像技术以及酵母双杂交技术等,其中GST-pull down技术实验周期短,操作步骤简便,比较容易纯化得到大量的重组蛋白,且能够提供2个蛋白质直接相互作用的有力证据[10-12]。因此GST-pull down技术不但可以作为研究蛋白质相互作用的首选方案,同样也可以作为那些通过了其他研究手段如免疫共沉淀,酵母双杂交等方法筛选得到的相互作用对的再次鉴定。
本研究中,通过提取外周血RNA进行实时PCR来获取MYCT1模板,构建至具有PT7启动子的pET28a (+) 载体质粒DNA中,并通过PCR和质谱的方法对其进行了鉴定。结果成功构建了MYCT1-GST载体,并在IPTG诱导下成功表达了GST融合蛋白,进一步应用GST对谷胱甘肽偶联球珠的亲和性,纯化到了MYCT1-GST融合蛋白。MYCT1-GST载体的构建为研究MYCT1奠定了基础,对进一步研究其参与的信号通路及在肿瘤中的分子作用机制具有重要意义。
[1] 邱广斌,邱广蓉,徐振明,等. 6q25区域内一个新基因MTLC的克隆及特性分析[J]. 中华医学遗传学杂志,2003,20 (2) :94-97.
[2] QIU GB,GONG LG,MAO DM,et al. Expression of MTLC gene in gastric carcinoma [J]. World J Gastroenterol,2003,9 (10) :2160-2163. DOI:10.3748/wjg.v9.i10.2160.
[3] YANG M,LI W,LIU YY,et al. Promoter hypermethylation-induced transcriptional down-regulation of the gene MYCT1 in laryngeal squamous cell carcinoma [J]. BMC Cancer,2012,12:219. DOI:10.1186/1471-2407-12-219.
[4] FU S,GUO Y,CHEN H,et al. MYCT1-TV,a novel MYCT1 transcript,is regulated by c-Myc and may participate in laryngeal carcinogenesis [J]. PLoS One,2011,6 (10) :13. DOI:10.1371/journal.pone.0025648.
[5] LAVALLEE VP,GENDRON P,LEMIEUX S,et al. EVI1-rearranged acute myeloid leukemias are characterized by distinct molecular alterations [J]. Blood,2015,125 (1) :140-143. DOI:10.1182/blood-2014-07-591529.
[6] LIDDIARD K,BUMMETT AK,DARLEY RL,et al. RUNX1-ETO deregulates the proliferation and growth factor responsiveness of human hematopoietic progenitor cells downstream of the myeloid transcription factor,MYCT1 [J]. Leukemia,2012,26 (1) :177-179. DOI:10.1038/leu.2011.188.
[7] BASQUIN J,TASCHNER M,LORENTZEN E. Complex reconstitution from individual protein modules [J]. Adv Exp Med Biol,2016,896:305-314. DOI:10.1007/978-3-319-27216-0_19.
[8] GORSKA-PONIKOWSKA M,KUBAN-JANKOWSKA A,EISLER SA,et al. 2-methoxyestradiol affects mitochondrial biogenesis pathway and succinate dehydrogenase complex flavoprotein subunit A in osteosarcoma cancer cells [J]. Cancer Genomics Proteomics,2018,15(1) :73-89. DOI:10.21873/cgp.20067.
[9] FAN R,HE H,YAO W,et al. SOX7 Suppresses Wnt signaling by disrupting β-Catenin/BCL9 interaction [J]. DNA Cell Biol,2017,37(2) :126-132. DOI:10.1089/dna.2017.3866.
[10] SCHFER F,SEIP N,MAERTENS B,et al. Purification of GST-tagged proteins[ J]. Methods Enzymol,2015,559:127-139. DOI:10.1016/bs.mie.2014.11.005.
[11] LUO L,KING NP,YEO JC,et al.Single-step protease cleavage elution for identification of protein- protein interactions from GST pulldown and mass spectrometry[ J]. Proteomics,2014,14( 1) :19-23.DOI:10.1002/pmic.201300315.
[12] SWAFFIELD JC,JOHNSTON SA. Affinity purification of proteins binding to GST fusion proteins[ J]. Curr Protoc Mol Biol,2001,20(20) :20-22. DOI:10.1002/0471142727.mb2002s33.
