杂合抗菌肽MT在大肠杆菌中的融合表达
2018-05-28龚国利王忠忠王盼雪
龚国利, 张 帝, 苏 鹏, 魏 媛, 王忠忠,王 亮, 王盼雪
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.西安市微生物药物工程实验室, 陕西 西安 710021)
0 引言
抗生素广泛应用于各种微生物疾病的治疗.我国使用量远高国外水平(15%~30%)[1].其滥用带来了诸多问题.抗菌肽(AMPs,antimicrobial peptides)是具有生物活性的小分子多肽,其抗菌谱广,能避免细菌因基因突变带来的耐药性问题[2],是21世纪替代抗生素的理想药物.在医药领域、食品领域、畜牧业领域已经广泛应用.
蛙皮素[3]又名马盖宁(Magainin)是Zasloff研究组在研究非洲爪蟾伤口始终不受感染的原因时发现的[4].实验中在蟾的皮肤及胃黏膜腺体上皮细胞产生的物质(抗菌肽),研究证明具有广谱抗菌性[5].该抗菌肽低浓度下对革兰氏阳性菌及阴性菌、真菌都有抑制作用,且具有抗肿瘤活性[6-8],对正常哺乳动物细胞无杀伤作用.死亡素(Thanatin)是从半翅目昆虫刺肩蝽(Podisus maculiventris)的血淋巴中分离[9]的具有广谱抗菌活性的昆虫抗菌肽[10],是第一个生理浓度时对革兰氏阳性菌、阴性菌及真菌有抑制活性的抗菌肽.
天然抗菌肽虽来源广泛,但产量低,提取分离工艺复杂;且常常具有生物毒性作用;从而对其基因的异源表达成为解决其诸多缺陷的一种理想途径.本实验基于前人对蛙皮素和死亡素的研究,及两种抗菌肽的活性优势,将两者作为母体肽,根据密码子偏好性及生物信息学和分子生物学技术,设计出了具有活性的杂合抗菌肽Magainin-Thanatin (MT),为实现MT抗菌肽的活性研究奠定了基础.
1 材料与方法
1.1 主要材料
蛙皮素与死亡素杂合抗菌肽基因序列;转化菌株大肠杆菌DH 5α,金黄色葡萄球菌,枯草芽孢杆菌,由本实验室保存;大肠杆菌BL21(DE3)及表达载体pGEX-6P-1购自宝生物工程(大连)有限公司;LB固/液体培养基;TB液体培养基;SOB培养基;SOC培养基等.
1.2 主要试剂
T4DNA连接酶、限制性内切酶EcoR I酶和BamH I酶购自宝生物工程(大连)有限公司;2×PCR Master Mix酶、DNA纯化回收试剂盒、质粒小提试剂盒购于北京天根生化有限责任公司;Tris购自上海浩然生物技术有限公司;琼脂糖凝胶电泳所需试剂;Western blot所需试剂;蛋白纯化试剂等.
1.3 主要仪器
台式高速冷冻离心机TGL-16M型,湖南湘仪离心机仪器有限公司;PCR仪PTC-200型,Bio-rad公司;核酸电泳仪C71-2Y5型,Bio-rad公司;凝胶成像仪BIS-910型,北京东胜创新生物有限公司;蛋白电泳仪Mini PROTEAN Tetra Cell,转移电泳槽JY-ZY5型BIO-RAD、转移电泳仪FA2104型,Bio-rad公司.
1.4 实验方法
1.4.1 MT基因的设计与合成
以马盖宁(Magainin)和死亡素(Thanatin)为母体肽,查得氨基酸序列,通过生物信息学方法分析:结构参数计算(ProtParam)[11]、二级结构预测(SOPM)[12,13]、三维螺旋轮结构预测(Helical Wheel Projections)和抗菌活性预测(APD Prediction)等.最终确定了杂合肽Magainin-Thanatin(简称MT)的氨基酸序列为: GIGKFLHSAKKFPVPIIYCNRRTGKCQRM共29个氨基酸.根据大肠杆菌密码子偏好性编码其基因以提高其在大肠杆菌中的表达量.为了便于目的基因与表达质粒的连接,在5'端引入肠激酶酶切位点及BamH I酶的酶切位点,3′端引入终止密码子及EcoR I酶的酶切位点通过软件设计得到基因序列为:GAC GAC GAC GAC AAG GGA TCC GGT ATC GGC AAA TTC CTG CAT AGC GCG AAA AAA TTC CCG GTC CCG ATC ATC TAC TGC AAC CGT CGC ACC GGC AAA TGT CAA CGT ATG TAA GAA TTC共117bp.
重叠延伸PCR技术(gene splicing by overlap extension PCR,简称SOE PCR):其采用具有互补末端的引物,使PCR产物形成重叠链,从而在随后的扩增反应中通过重叠链的延伸,将不同来源的扩增片段重叠拼接起来.该技术能够在体外进行有效的基因重组,而且不需要内切酶消化和连接酶处理,可利用这一技术快速获得其它依靠限制性内切酶消化的方法难以得到的产物.
此次实验通过采用该技术,设计了三段引物完成了MT基因的拼接,引物基因序列为:
P1:5′-GGATCCGGTATCGGCAAATTCCTGC
ATAGCGCGAAAAAATTCCCGGT-3′;
P2:5′-GTGCGACGGTTGCAGTAGATGATC
GGGACCGGGAATTTTTTCGCGC-3′;
P3:5′-GAATTCTTACATACGTTGACATTT
GCCGGTGCGACGGTTGCAGTAGA-3′.
第一轮PCR中,用引物P1与P2进行PCR扩增,采用50μL体系:灭菌去离子水23μL;P1 1μL;P2 1μL;2×PCR MIX酶25μL,将上述试剂加入PCR反应管后,混匀离心,使液体聚集在PCR反应管底部,放入PCR仪中95 ℃预变性5 min,95 ℃变性30 s,62.1 ℃退火30 s,72 ℃延伸30 s,32个循环后72 ℃延伸10 min,4 ℃保存.由此得到的扩增产物作为第二轮PCR扩增的模版(T).第二轮PCR时,以上述产物T作为模版,采用50μL体系:灭菌去离子水22μL;T 1μL;P1 1μL;P3 1μL;2×PCR MIX酶25μL,使用引物P1与引物P3进行PCR,将上述试剂加入PCR反应管后,混匀离心,使液体聚集在PCR反应管底部,放入PCR仪中95 ℃预变性5 min,95 ℃变性30 s,60.3 ℃退火30 s,72 ℃延伸30 s,32个循环后72 ℃延伸10 min,4 ℃保存.此时扩增的基因即为所要获得的杂合肽MT基因.
1.4.2 重组表达菌株的构建
此次实验所采用的质粒为pGEX-6P-1,其质粒图谱如图1(a)所示.将含目标质粒的大肠杆菌菌液50μL接种到5 mL含Amp的LB液体培养基中,200 rpm,37 ℃,过夜培养.随后按质粒提取试剂盒操作,纯化质粒.
重组质粒的构建路线如图1(b)所示,将纯化后的MT基因片段与pGEX-6P-1质粒分别用EcoR I酶和BamH I酶进行双酶切,酶切体系(50μL):10× Buffer 5μL,目的片段/载体30μL,ddH2O 5μL,EcoR I 1μL,BamH I 1μL,37 ℃孵育3 h.使用薄型琼脂糖凝胶DNA回收试剂盒对酶切MT基因片段和pGEX-6P-1载体骨架进行切胶回收.用DNA连接酶将MT基因片段和pGEX-6P-1载体骨架于4 ℃过夜连接.连接产物pGEX-6P-1-MT经双酶切(酶切体系同上)后进行1.5%琼脂糖凝胶电泳,用凝胶成像仪进行检测.

(a) 表达载体pGEX-6P-1的质粒图谱

(b)重组质粒pGEX-6P-1-MT的构建路线图1 表达载体的构建
将pGEX-6P-1-MT质粒转导进入预先制备好的大肠杆菌DH5α感受态菌株中,37 ℃,200 rpm条件下培养1 h;随后涂布于含Amp、IPTG、X-gal的固体LB平板上,倒置,37 ℃过夜培养.挑单菌落,用pGEX-6P-1质粒的引物P1与P3进行菌落PCR验证,并以无菌水和pGEX-6P-1的空质粒作对照,验证重组质粒是否为阳性克隆.将鉴定为阳性克隆的大肠杆菌DH5α抽提质粒,随后将质粒转导进入大肠杆菌BL21(DE3)感受态细胞中培养与鉴别操作同大肠杆菌DH5α.
1.4.3 杂合抗菌肽的诱导表达及纯化分析
挑阳性克隆子单菌落接种于含有Amp的LB液体培养基中,过夜培养.接种于含有Amp的LB液体培养基中,培养至OD600值约为0.6左右.加入IPTG进行诱导,培养3 h.离心,去上清,收集菌体.PBS清洗菌体,离心,重复操作两次;加入无菌去离子水,混匀菌体.为聚丙烯酰胺凝胶电泳的上样做准备.
将目的蛋白GST-MT上样至GST琼脂糖凝胶层析柱上进行蛋白纯化,具体步骤如下:将Glutathione-Sepharose Resin混合均匀直至重悬,用吸管移取5 mL填料至层析柱中.室温静置,待凝胶与溶液分层后,打开下端的出液口,通过重力作用使乙醇缓慢流出;用25 mL的去离子水冲洗柱子,然后用50 mL的结合缓冲液平衡柱床;将离心后得到的上清用0.45μm微孔滤膜过滤,与结合缓冲液等混匀,加入柱床,上样流速为0.5~1 mL/min (6 mL层析柱);用50 mL的结合缓冲液过柱,洗涤杂蛋白,洗涤流速为0.5~1 mL/min (6 mL层析柱);用50 mL的洗脱缓冲液洗脱目的蛋白,洗脱流速为0.5~1 mL/min (6 mL层析柱),收集洗脱液;使用25 mL的再生缓冲液1洗涤填料,然后用5~10倍体积的超纯水洗涤;再用25 mL的再生缓冲液2洗涤填料,然后用5~10倍体积的超纯水洗涤,使柱床再生;用10 mL的20%乙醇浸没填料,4 ℃保存.将收集到的洗脱液进行SDS-PAGE电泳分析,检测纯化效率.
为了确定杂合抗菌肽MT的表达,经过SDS-PAGE电泳后,湿转法进行Western blot电泳对表达产物进行进行确认.随后用亲和层析对含有GST标签的重组蛋白进行纯化.过滤除菌,采用5 kDa的超滤管浓缩目的蛋白.采用BCA蛋白定量试剂盒中的微孔检测法测蛋白.
1.4.4 杂合抗菌肽MT的诱导表达条件优化
为了使融合蛋白的表达量增加,测定杂合抗菌肽工程菌的生长曲线,对影响表达的条件进行了优化,这些表达条件主要有诱导温度、诱导时间、IPTG浓度以及培养基种类,本实验对这些因素进行了优化,从而选出最佳的诱导条件.
(1)杂合抗菌肽重组表达菌株生长曲线的测定
挑取实验室保藏的pGEX-6P-1/BL21(DE3)和pGEX-6P-1-MT/BL21(DE3)的单菌落接种于含Amp的LB培养基中,过夜培养.取过夜培养的菌液接种于含Amp的LB培养基中,震荡培养,每隔1 h取样,测OD600,从而确定菌株的生长情况.为了防止同一试管中取样过多而影响细菌的生长,设置了三组平行实验,不同时间段从不同的试管中取样.绘制重组表达菌株生长曲线图,选择最优生长时间.
(2)IPTG浓度对MT重组工程菌表达的影响
挑取pGEX-6P-1-MT/BL21(DE3)的阳性单菌落接种于含Amp的LB培养基中,过夜培养;取过夜培养的菌液接种于含Amp的LB培养基中,震荡培养至OD600值约为0.6(约2.5 h);按照0 mM、0.1 mM、0.2 mM、0.4 mM、0.6 mM、0.8 mM、1.0 mM、1.2 mM的终浓度,加入200 mg/mL的IPTG 0μL 、1.19μL 、2.38μL 、5.76μL 、7.14μL 、9.52μL、11.9μL、14.3μL进行诱导,在37 ℃、200 rpm条件下震荡培养3 h;12 000 rpm条件下离心5 min,加入灭菌的PBS 450μL清洗菌体,12 000 rpm条件下离心5 min,重复两次;加200μL蒸馏水混匀菌体,随后进行SDS-PAGE电泳分析.
(3)诱导时间对MT重组工程菌表达的影响
其他条件同(2),按照1.0 mM的终浓度,加入200 mg/mL的IPTG 11.9μL进行诱导,分别在0 h、1 h、2 h、3 h、4 h、5 h、6 h条件下200 rpm震荡培养;12 000 rpm条件下离心5 min,加入灭菌的PBS 450μL清洗菌体,12 000 rpm条件下离心5 min,重复两次;加200μL蒸馏水混匀菌体,随后进行SDS-PAGE电泳分析.
(4)诱导温度对MT重组工程菌表达的影响
其他条件同(3);分别在32 ℃、35 ℃、37 ℃、39 ℃、42 ℃条件下200 rpm震荡培养3 h;12 000 rpm条件下离心5 min,加入灭菌的PBS 450μL清洗菌体,12 000 rpm条件下离心5 min,重复两次;加200μL蒸馏水混匀菌体,随后进行SDS-PAGE电泳分析.
(5)培养基对MT重组工程菌表达的影响
其他条件同(4);取过夜培养的菌液以1%的接种量接种于5 mL的含Amp的LB、SOC、TB培养基中,加入200 mg/mL的IPTG 11.9μL ,37 ℃,200 rpm条件下震荡培养,至OD600值约为0.6(约2.5 h);12 000 rpm条件下离心5 min,加入灭菌的PBS 450μL清洗菌体,12 000 rpm条件下离心5 min,重复两次;加200μL蒸馏水混匀菌体,随后进行SDS-PAGE电泳分析.
1.4.5 杂合抗菌肽的抗菌活性检测
最小抑菌浓度一般指恒温条件下培养24 h后,抗菌物质能够抑制50%以上的微生物生长的最低浓度[14].测定最小抑菌浓度及抑菌圈可以获得杂合抗菌肽的抗菌活性信息.此次试验通过纯化融合蛋白,采用琼脂孔穴扩散法检测杂合抗菌肽的抑菌活性,指示菌株为枯草芽孢杆菌和金黄色葡萄球菌和大肠杆菌DH5α.
2 结果与讨论
2.1 MT基因的设计与分析
软件分析发现其由大量碱性氨基酸组成(如图2所示),使其最终呈现强碱性.二级结构主要含有α螺旋(h),占20.69%;延伸链(e),占24.14%;β折叠(t),占10.34%;无规则卷曲(c)占44.83%.

图2 杂合抗菌肽的二级结构
其亲水性如图3所示,纵坐标在0点以下为疏水性,在0点以上为亲水性.从图3可看出,该肽为两亲性的抗菌肽,其亲水区域与磷脂的头相结合,疏水区域与磷脂尾部相互作用,造成其独特的杀菌机制.
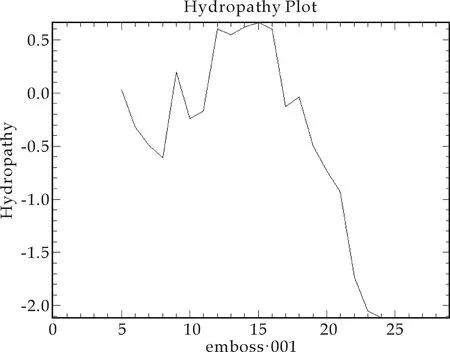
图3 杂合抗菌肽的亲水性图
螺旋轮如图4所示,其中圆代表亲水性氨基酸,共11个;菱形代表疏水性氨基酸,共8个;五边形代表带正电荷的氨基酸,共8个.红色为亲水性最强,绿色为疏水性最强.由图4得知其亲水性氨基酸大体分布在螺旋轮的一侧,而疏水性氨基酸分布在螺旋轮的另一侧,这种结构可导致抗菌肽的抗菌活性、无溶血性或低溶血性.
抗菌肽的生理功能与其结构有很大关系,两亲性在抗菌肽活性方面起关键的作用[15].其改变细胞膜的通透性源于正电荷在细胞膜的富集,但是正电荷数的过高也同样会造成抗菌活性的下降[16].在其插入脂质双分子的过程中,疏水作用比较关键,但过高会导致自身的聚集,降低抗菌活性;反之,则难以插入脂质双分子层,也会导致抑菌活性的下降[17],因此疏水性应保持在一定的范围内.α螺旋度提高了抗菌肽的抑菌活性,但也会提高溶血活性[18].结构参数与活性关系之间的联系当前仍不清楚,这对其设计造成了困扰,但生物信息学工具的应用也为其设计提供了便利.
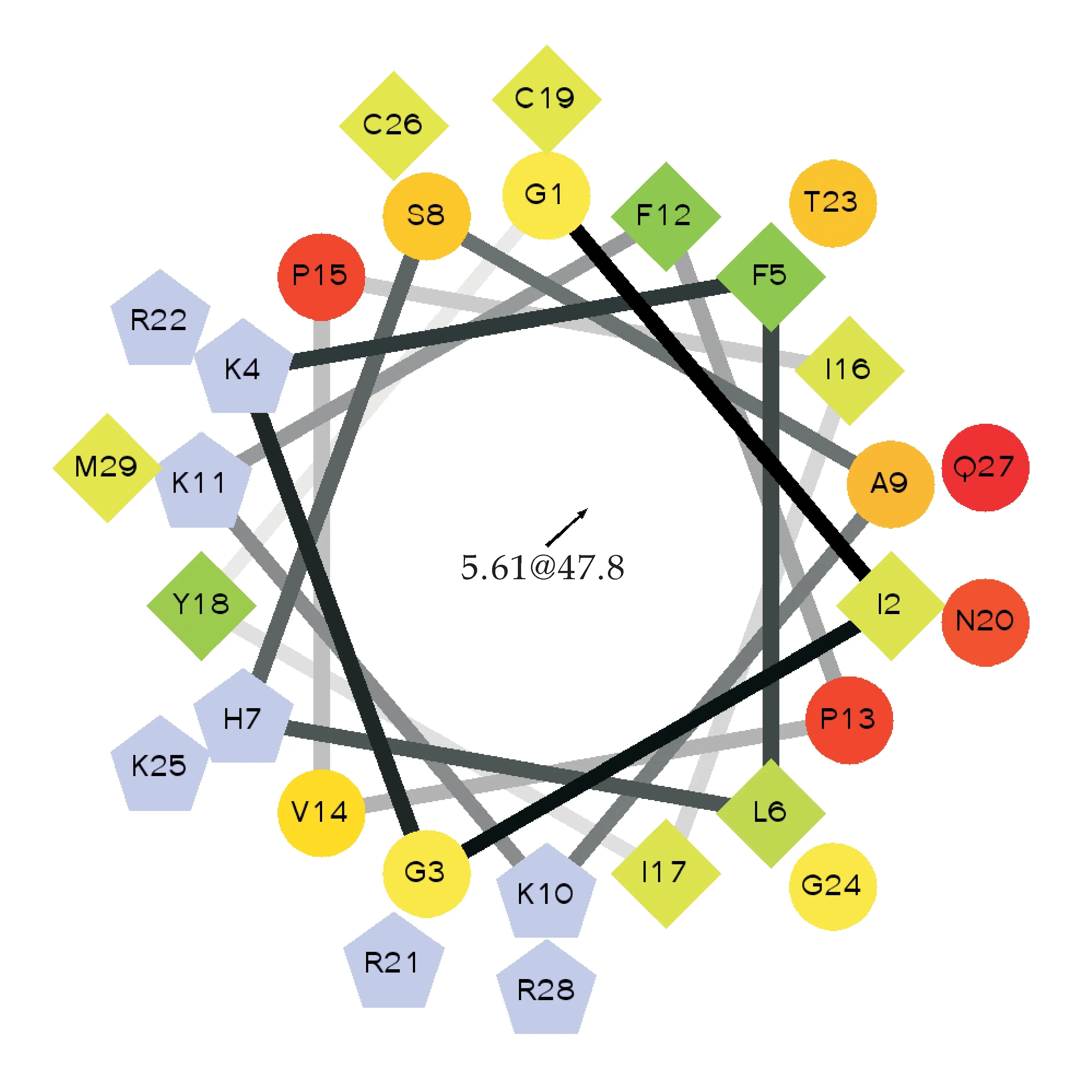
图4 杂合抗菌肽MT螺旋轮图
蛙皮素,有广谱抗菌活性、极低浓度下就对细菌、真菌甚至肿瘤细胞具有杀伤作用,将其核心序列与具有广谱抑制微生物的死亡素核心序列连在一起,经过生物信息学工具的分析,获得杂合肽MT的结构参数,结果显示其可能对细菌有抑制作用.
2.2 MT基因合成及表达载体的构建
杂合肽基因获得方式有多种,在孙艳发[19]的研究中,通过SOE-PCR技术合成了CC31与CC34两条杂合肽基因.胡功玲[20]通过SOE-PCR技术合成了HMCM杂合肽基因.朱嘉明等[21]用类似方法合成了天蚕抗菌肽A和蜂毒素杂合抗菌肽基因.孙长峰[22]使用类似技术表达出了具有较好的热、酸碱和抗胰酶消化稳定性及对小鼠骨髓瘤细胞SP2/0有抑制效果的杂合抗菌肽.因此使用SOE-PCR技术合成目的基因已经成为杂合抗菌肽基因合成的有效方法.
采用的SOE-PCR技术,进行了两次扩增,将两次获得的产物分别做琼脂糖凝胶电泳,第一次扩增的片段大小约为56 bp,第二次扩增的大小约为102 bp,与目的基因片段大小基本相符.结果如图5(a)所示.按质粒提取试剂盒操作流程提取pGEX-6P-1质粒,在琼脂糖凝胶浓度为0.8%的条件下进行电泳,结果如图5(b)所示,出现单一质粒.

1:第2轮PCR扩增产物;2:第1轮PCR扩增产物;M:DNA Ladder Marker(a)MT基因PCR扩增产物1.5%琼脂糖电泳鉴定
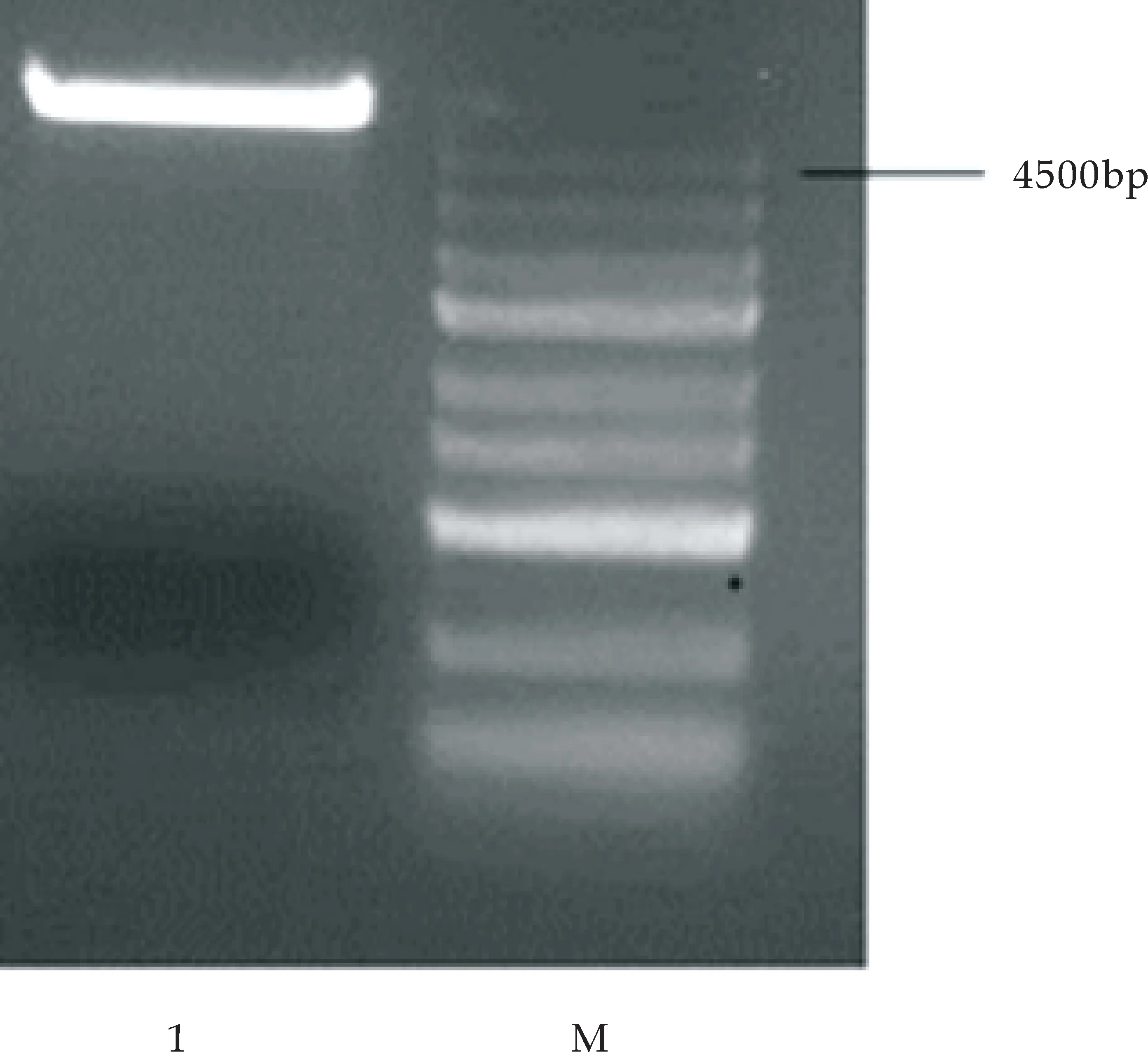
M:DNA marker;1:pGEX-6P-1质粒(b)表达载体0.8%琼脂糖电泳鉴定图5 MT基因及表达载体的琼脂糖电泳验证
将扩增的MT基因片段与提取的pGEX-6P-1质粒用EcoR I酶 和BamH I酶进行双酶切,在浓度为1.5%的琼脂糖凝胶中进行电泳,结果如图6(a)所示,出现双条带.挑单菌落进行菌落PCR验证,将PCR产物在琼脂糖凝胶浓度为1.5%条件下进行电泳,用pGEX-6P-1空质粒和无菌水作为对照,扩增出重组子质粒大小为102 bp,而空质粒无扩增条带,结果如图6(b)所示.由于目的基因片段较小,琼脂糖凝胶的分子筛作用可能无法截留目的片段,此时如果使用EcoR I和BamH I进行双酶切,则在凝胶成像仪中成像结果可能不明显,因此选择了相距较远的EcoR I、EcoR V进行双酶切验证,酶切后电泳条带如图6(c)所示,结果条带仍然较暗.
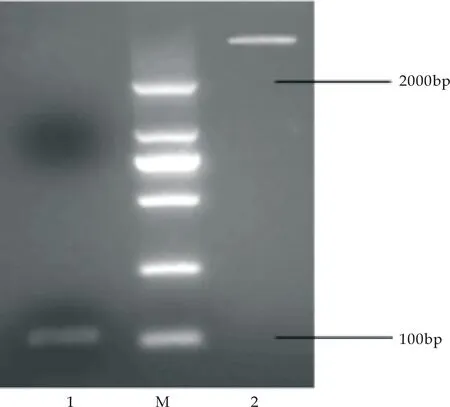
1:MT基因;M:marker;2:pGEX-6P-1 质粒(a)MT基因片段与pGEX-6P-1质粒的双酶切

M:DNA marker;1-4:重组质粒pGEX-6P-1-MT的菌落PCR验证;5:pGEX-6P-1的菌落PCR验证(b)重组质粒的菌落PCR鉴定

M:DNA marker;1:pGEX-6P-1-MT质粒EcoR I和EcoR V双酶切;2:pGEX-6P-1-MT质粒(c)pGEX-6P-1-MT质粒的双酶切验证图6 MT基因及表达载体的琼脂糖电泳再验证
2.3 MT基因在大肠杆菌中的融合表达和纯化
将经过菌落PCR验证的菌株,小量培养后,预处理进行SDS-PAGE电泳,表达蛋白的大小约为30 kDa,如图7(a)所示.SDS-PAGE分析表明,表达蛋白主要存在于超声破碎细胞后经离心的上清中,后续纯化工作将更方便,结果如图7(b)所示.

M:蛋白marker;1:未诱导的pGEX-6P-1-MT;2:诱导的pGEX-6P-1-MT(a)重组蛋白的SDS-PAGE

1:水;2:37 ℃诱导上清;3:37 ℃诱导沉淀;4:16 ℃诱导沉淀;5:16 ℃诱导上清;M:蛋白marker (b)表达产物的可溶性检测图7 目的蛋白SDS-PAGE分析
杂合抗菌肽MT的Western blot检测结果如图8(a)所示.由图可知,杂合抗菌肽的融合蛋白MT-GST与兔抗GST多克隆抗体呈阳性反应,大小为30 kDa,说明融合蛋白在大肠杆菌中获得表达.将重组菌pGEX-6P-1-MT/BL21(DE3)用500 mL的LB培养基进行培养,离心收集菌体,破碎细胞,经过蛋白的可溶性分析得出产物存在于上清中,经过GST-琼脂糖凝胶层析柱的纯化,进行SDS-PAGE电泳,电泳结果如图8(b)所示,从图可得蛋白在30 kDa处蛋白得到表达.表达蛋白经肠激酶切割后,进行亲和层析,除去融合蛋白标签,然后进行Tricine-SDS-PAGE电泳,得到分子量大小为3.35 kDa,结果如图8(c)所示.
采用BCA蛋白定量试剂盒测定蛋白的浓度,绘制标准曲线如图9所示,代入蛋白样品的OD600值后计算的蛋白样品的浓度为49.5 mg/L.

(a)杂合抗菌肽MT的Western blot检测
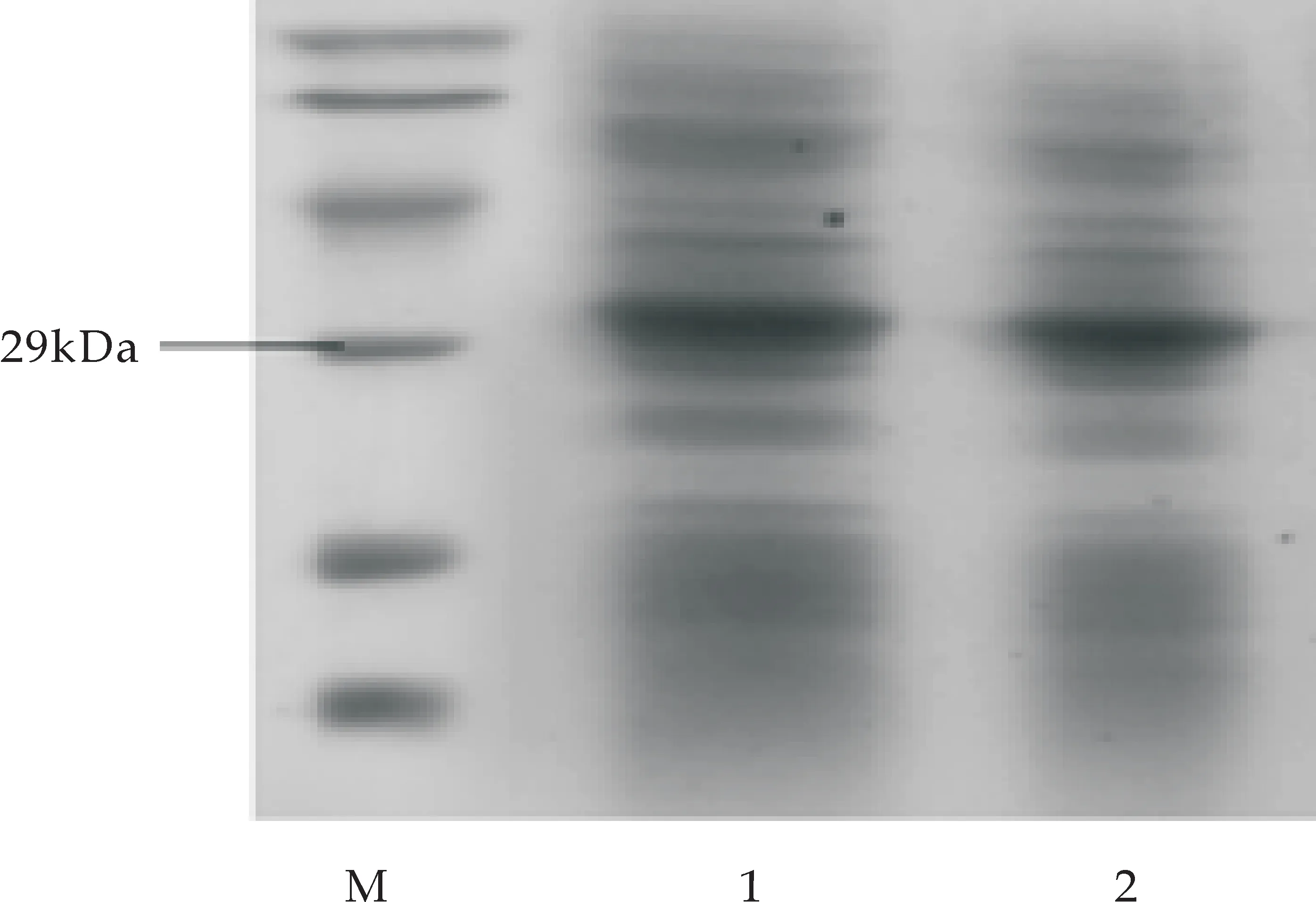
M:蛋白marker;1-2:纯化的杂合抗菌肽MT融合蛋白(b)纯化的杂合抗菌肽MT融合蛋白SDS-PAGE分析

M:蛋白marker;1:杂合抗菌肽MT融合蛋白;2:肠激酶切后产物(c)杂合抗菌肽MT的Tricine-SDS-PAGE分析图8 目标蛋白的确认
活性蛋白表达量是研究的聚焦点,针对如何获得蛋白高效表达进行了不少研究.文良柱等[23]将蜂毒肽与死亡素杂合,采用含有His标签的pET32a作其表达载体,在E.coli BL21(DE3)上表达出了具有抑菌活性的杂合肽,融合蛋白表达量占菌体的56%.胡功玲[20]使用表达载体pET32a对杂合抗菌肽HMCM进行融合表达,经过纯化柱纯化后获得了浓度为11.92 mg/L的融合蛋白,表达量较高.可见融合标签的使用能够促进蛋白的融合表达,提高表达量.

图9 BCA法测定蛋白浓度的标准曲线
2.4 杂合抗菌肽MT的表达条件优化
2.4.1 重组表达菌株生长曲线的测定
基因工程菌在无IPTG诱导时的生长曲线如图10所示.由图10可知,重组大肠杆菌生长曲线呈“S”型,与pGEX-6P-1/BL21(DE3)相比,重组基因工程菌pGEX-6P-1-MT/BL21(DE3)菌株的生长并不受影响.因此将起始诱导时间选在接种后3 h,这时大肠杆菌有一定的生长量且不影响杂合抗菌肽的表达.

图10 重组工程菌的生长曲线
2.4.2 诱导条件对重组工程菌表达的影响
pGEX-6P-1载体中含有强启动子Tac,Tac启动子受IPTG的诱导,低浓度的IPTG就能诱导外源蛋白的表达[24,25].在图11(a)中,IPTG浓度变化对融合蛋白的表达影响不显著,最佳诱导浓度为0.8 mM,这印证了上述观点.在图11 (b)中,IPTG加入后诱导时间的变化显著影响融合蛋白的表达效率,选择诱导时间为5 h.在图11 (c)中,随温度升高,重组蛋白表达量提高,选择37 ℃作为表达的最适温度.在图11(d)中,因TB培养基培养的菌表达融合蛋白条带颜色较深,所以作为优选培养基.

M:蛋白marker;1-8:IPTG浓度为0.0 mM、0.1 mM、0.2 mM、0.4 mM、0.6 mM、0.8 mM、1.0 mM、1.2 mM(a)IPTG浓度的优化

M:蛋白marker;1-8:pGEX-6P-1-MT诱导7 h、6 h、5 h、4 h、3 h、2 h、1 h、0 h(b) 诱导时间的优化

M:蛋白marker;1-5:32 ℃、35 ℃、37 ℃、39 ℃、42 ℃诱导(c) 诱导温度的优化

M:蛋白marker;1:LB培养基;2:TB培养基;3:SOC培养基(d) 培养基的优化图11 诱导条件优化
经过不同诱导因素对杂合抗菌肽MT工程菌的诱导,确定了其最优条件为:IPTG诱导浓度0.8 mM,诱导时间3 h,诱导温度37 ℃,培养基选用TB培养基.
2.5 杂合抗菌肽MT的活性研究
肠激酶酶切的目的蛋白与未酶切的融合蛋白抑菌作用如图12所示.杂合抗菌肽MT对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌具有良好的抑菌作用.加入50μg抗菌肽,金黄色葡萄球菌的抑菌圈为6 mm,大肠杆菌DH5α的抑菌圈为5 mm,枯草芽孢杆菌的抑菌圈为10 mm,杂合肽对枯草芽孢杆菌的抑制作用强于另两种菌.当浓度减小为17μg时,杂合肽不再抑菌.
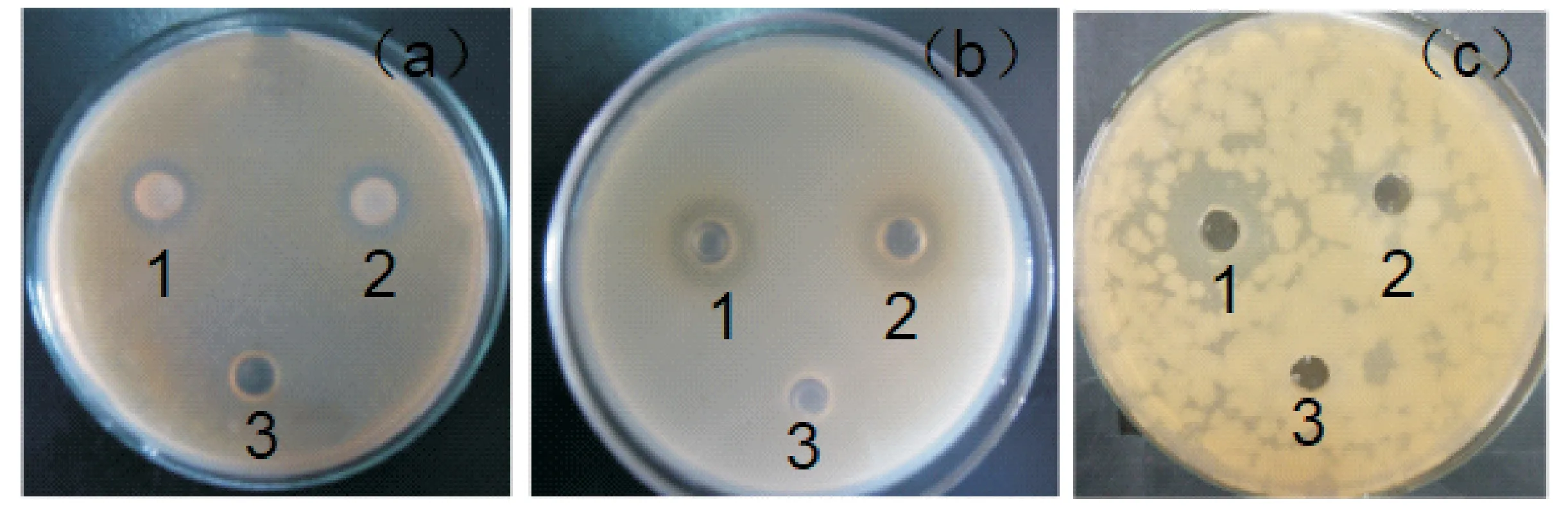
(a)金黄色葡萄球菌 (b)大肠杆菌DH5α (c)枯草芽孢杆菌1:肠激酶酶切的MT蛋白;2:融合蛋白;3:无菌水图12 抗菌活性检测
由实验结果得知,杂合抗菌肽对金黄色葡萄球菌、大肠杆菌DH5α、枯草芽孢杆菌的最小抑菌浓度分别为16.5μM、20μM、9μM.
杂合抗菌肽因可增大细胞膜的通透性,很难产生细菌耐药性作用,成为能替代抗生素的理想抗菌制剂.董天堂[26]在杂合抗菌肽CL23和LH28的分子设计与表达中,设计得到的杂合抗菌肽的抗菌活性比母体肽 LFB15W(4,10)提高了4倍,并且在有效抑菌浓度下,几乎没有溶血性.
3 结论
此次实验通过生物信息学手段,根据抗菌肽分子的设计原理,设计出了具有抗菌潜力的杂合抗菌肽MT.后续工作还需对抗菌蛋白的活性与结构关系,溶血性、热稳定性等进行深入研究从而实现该抗菌肽的工业化生产及大规模发酵.
[1] 梁奕宏,柳 红.滥用抗生素——导致疾病和死亡的社会问题[J].中国检验检疫,2004(10):59-60.
[2] Brogden K A.Antimicrobial peptides:Pore formers or metabolic inhibitors in bacteria?[J].Nat Rev Microbiol,2005,3(3):238-250.
[3] Torsten W,Margitta D,Michael B,et al.Peptide hydrophobicity controls the activity and selectivity of magainin 2 amide in interaction with membranes[J].Biochemistry,1997,36(20):6 124-6 132.
[4] Zasloff M.Magainins,a class of antimicrobial peptides from Xenopus skin:Isolation,characterization of two active forms,and partial cDNA sequence of a precursor[J].Proc Natl Acad Sci USA,1987,84(15):5 449-5 449.
[5] 朱钧萍,申 婧,郭中敏,等.抗菌肽表达系统及应用的研究进展[J].热带医学杂志,2013,13(10):1 301-1 304.
[6] Bulet P,Hetru C,Dimarcq J L,et al.Antimicrobial peptides in insects:Structure and function[J].Dev Comp Immunol,1999,23(4-5):329-344.
[7] Ladokhin A S,Selsted M E,White S H.CD spectra of indolicidin antimicrobial peptides suggest turns,not polyproline helix[J].Biochemistry,1999,38(38):12 313-12 319.
[8] Lamberty M,Zachary D,Lanot R,et al.Insect immunity constitutive expression of a cysteine-rich antifungal and a linear antibacterial peptide in a termite insect[J].J Biol Chem,2001,276(6):4 085-4 092.
[9] Mandard N,Sodano P,Labbe H,et al.Solution structure of thanatin,a potent bactericidal and fungicidal insect peptide,determined from proton two-dimensional nuclear magnetic resonance data[J].Eur J Biochem,1998,256(2):404-410.
[10] Fehlbaum P,Bulet P,Chernysh S,et al.Structure-activity analysis of thanatin,a 21-residue inducible insect defense peptide with sequence homology to frog skin antimicrobial peptides[J].Proc Natl Acad Sci USA,1996,93(3):1 221-1 225.
[11] Gasteiger E,Hoogland C,Gattiker A,et al.Protein identification and analysis tools on the ExPASy server[J].Methods Mol Bio,1999,112:531-542.
[12] 陈文聪,胡朝晖,朱庆义.生物信息学的进展及其在分子微生物学研究中的应用[J].分子诊断与治疗杂志,2011,3(3):207-211.
[13] 李 霞,李亦学,廖 飞.生物信息学[M].1版.北京:人民卫生出版社,2010.
[14] Lee D G,Kim H N,Park Y,et al.Design of novel analogue peptides with potent antibiotic activity based on the antimicrobial peptide,HP (2-20),derived from N-terminus of helicobacter pylori ribosomal protein L1[J].Biochim Biophys Acta,2002,1 598(1-2):185-194.
[15] Jin Y,Hammer J,Pate M,et al.Antimicrobial activities and structures of two linear cationic peptide families with various amphipathic beta-sheet and alpha-helical potentials[J].Antimicrob Agents Chemother,2005,49(12):4 957-4 957.
[16] Yang S T,Song Y S,Hahm K S,et al.Design of perfectly symmetric trp-rich peptides with potent and broad-spectrum antimicrobial activities[J].International Journal of Antimicrobial Agents,2006,27(4):325-330.
[17] Tossi A,Sandri L,Giangaspero A.Amphipathic,alpha-helical antimicrobial peptides[J].Biopolymers,2000,55(1):4-30.
[19] 孙艳发.杂合抗菌肽CC31和CC34的分子设计、表达及其活性研究[D].大庆:黑龙江八一农垦大学,2010.
[20] 胡功铃.杂合抗菌肽HMCM的原核表达及其抗菌活性的初步鉴定[D].重庆:重庆大学,2011.
[21] 朱嘉明,刘飞鹏,李月琴,等.天蚕抗菌肽A与蜂毒素杂合肽基因的合成及在大肠杆菌中的克隆与表达[J].遗传,2002,24(1):31-34.
[22] 孙长峰.杂合抗菌肽Cecropin P1-Dermaseptin S4在毕赤酵母中的分泌表达及活性检测[D].济南:济南大学,2014.
[23] 文良柱,张家骊,钱 坤,等.蜂毒肽与死亡素杂合肽(MT)在大肠杆菌中融合表达的研究[J].食品与生物技术学报,2006,25(6):45-48.
[24] 丁 鸣,余建法.融合表达载体的研究进展[J].生物技术,1998,8(4):5-8.
[25] 周宇荀,魏东芝,王二力.融合蛋白表达载体pGEX及其应用[J].生命科学,1998,10(3):122-124.
[26] 董天堂.杂合抗菌肽CL23和LH28的分子设计与表达[D].北京:中国农业科学院,2008.
