采后苯丙噻重氮处理促进梨果实的愈伤
2018-05-25张静荣李永才
张静荣,王 斌,姜 红,王 毅,李 雪,司 敏,李永才,毕 阳*
梨是温带地区的重要水果,但梨果实在采收及采后各环节中易遭受机械损伤,果实表面形成的伤口为病原物的侵染提供了通道,导致采后病害发生[1]。多种真菌与梨果实的采后病害相关,其中由互隔交链孢(Alternaria alternata)引起的黑斑病是我国北方梨果实的最常见病害[2]。有报道表明,果蔬具备采后愈伤的能力,通过自我激活一系列的防御代谢来促进伤口愈合,从而有效抑制水分蒸腾,阻止病原菌的侵入[3]。但正常的自然愈伤所需时间偏长,因此有效缩短梨果实愈伤时间是当前生产中亟待解决的问题。Spotts等[4]发现,‘d’Anjou’和‘Bosc’两品种西洋梨果实在20 ℃下愈伤2 d后,再在伤口处接种灰葡萄孢(Botrytis cinerea)和扩展青霉(Penicillium expansum),灰霉病和青霉病的发病率明显降低;对伤口处组织观察发现,有纤维素、软木脂及单宁等愈伤成分的积累。同样,苹果果实分别在20 ℃和38 ℃下愈伤4 d后,再在伤口处接种B. cinerea和P. expansum后,发现热处理下灰霉病和青霉病的发病率显著降低,伤口处组织有明显的酚类及木质素等愈伤成分沉积[5]。苯丙噻重氮(benzothiadiazole,BTH)是一种人工合成的水杨酸类似物,可诱导多种果蔬的采后抗病性[6]。BTH采后处理可以诱导鸭梨果实对P. expansum的抗性[7],还可增强苹果果实的采后抗病性[8]。BTH诱导果实抗性的机理主要与激活苯丙烷代谢、促进活性氧代谢,以及表达病程蛋白基因有关[9]。虽然已有仁果类果实愈伤以及BTH诱导仁果类果实采后抗病性的报道。但鲜见BTH处理对仁果类果实采后愈伤能力影响的报道。本实验以‘玉露香’梨为原料,人工模拟损伤后用100 g/L BTH处理伤口,在常温(20~25 ℃)、相对湿度70%~80%条件下进行愈伤,通过观察果实质量损失率和损伤接种A. alternata后的发病率以及测定愈伤期间伤口处组织苯丙烷代谢关键酶和产物的积累,以及抗氧化酶的活力变化,通过比较处理组和对照组之间的差异来评价愈伤效果,为BTH诱导梨果实的快速愈伤提供理论和方法依据。
1 材料与方法
1.1 材料与试剂
供试‘玉露香’梨于2015年10月采自甘肃省景泰县国营条山集团梨生产基地,选取外观整齐、大小一致、无病虫害、无机械损伤的果实,单果套网套后入瓦楞纸包装箱,于当天运抵甘肃农业大学食品学院采后生物学与技术实验室,于常温(20~25 ℃)、相对湿度70%~80%条件下贮藏待用。供试A. alternata由甘肃农业大学采后生物学与技术实验室提供,PDA培养基中培养并保存待用。
BTH(有效体积分数50%) 北京Solarbio公司。
1.2 仪器与设备
SW-CJ-2FD超净工作台 苏净集团苏州安泰空气技术有限公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;DHP-9272B型恒温培养箱 上海一恒科技有限公司;CX21FSIC光学显微镜 奥林巴斯工业有限公司;UV2450型岛津分析仪器 日本岛津公司;H-1850R型台式高速冷冻离心机 长沙湘仪离心机有限公司;1510-04087型酶标仪 赛默飞世尔科技有限公司。
1.3 方法
1.3.1 梨果实人工损伤、BTH处理及愈伤
参考Fu Da等[10]的方法并作修改。梨果实先用清水冲洗,然后用体积分数1%的次氯酸钠溶液浸泡1 min进行表面消毒,无菌水冲洗、晾干后,用灭菌接种钉在梨果实的赤道部位均匀刺出3 个深3 mm、直径3 mm的伤口。0.5 h后将损伤的梨果实浸入100 g/L BTH中5 min,取出晾干后分别装入打孔的聚乙烯保鲜袋(25 cm×40 cm,厚0.02 mm),于常温(20~25 ℃)、相对湿度70%~80%的黑暗条件下进行愈伤。以清水处理作对照。每处理用梨果实100 个,重复3 次。1.3.2 愈伤效果的评价
1.3.2.1 质量损失率的测定
参照曹建康等[11]的方法。采用质量法测定愈伤期间梨果实的质量损失率。每个处理用梨果实15 个,重复3 次。
1.3.2.2 发病率的测定
参照Li Yongcai等[12]的方法。于培养7 d的A. alternata培养皿中加入适量的无菌水,用涂布器刮下培养基表面的孢子,用4 层纱布过滤至三角瓶中,振荡20 s,采用血球计数板计数,制备成浓度为1×106CFU/mL的孢子悬浮液。在梨果实愈伤的第0、0.5、1、2、4、6天,将已配制好的20 μL孢子悬浮液注入梨果实人工损伤的伤口处,接种梨果实重新装入打孔聚乙烯保鲜袋中,于常温黑暗条件下愈伤,4 d后统计损伤接种梨果实的发病率,表皮出现黑斑且病斑直径超过3 mm计作病果。每个处理用梨果实15 个,重复3 次。
1.3.3 生化测定样品取样
在愈伤后的第0、0.5、1、2、4、6天时,采用手术刀切取创口周边5 mm、深3 mm的愈伤组织3 g,锡箔纸包好后液氮冷冻,在-80 ℃超低温冰箱中待用。
1.3.4 PAL、SOD、POD、PPO活力及蛋白质含量的测定
苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)活力的测定参照葛永红等[13]方法。取冷冻组织3 g,用3 mL 0.05 mol/L的硼酸缓冲液(含1 g/100 mL聚乙烯聚吡咯烷酮(poly-vinylpolypyrrolidone,PVPP)、5 mmol/L β-琉基乙醇,pH 8.8)冰浴研磨成匀浆,4 ℃、15 000×g离心30 min,取上清液用于酶活力的测定。反应体系:在500 μL粗酶液中加入0.05 mol/L的硼酸缓冲液中(pH 8.8),再加入20 mmol/L的L-苯丙氨酸,37 ℃保温30 min,充分混合后于290 nm波长处测定吸光度,作为反应初始值(A0)。再在37 ℃下反应60 min,测定其吸光度(A1)。对照组以硼酸缓冲液代替酶液。以每分钟内吸光度变化0.01为1 个活力单位(U),酶活力单位为U/mg。
超氧化物歧化酶(superoxide dismutase,SOD)活力的测定参照Venisse等[14]方法。取3.0 g冷冻组织,加入3 mL 100 mmol/L磷酸缓冲液(pH 7.5,含5 mmol/L二硫苏糖醇和2 g/100 mL PVPP),冰浴条件下研磨成匀浆后于4 ℃、12 000×g离心30 min,上清液立即用于酶活力测定。取5 mL指形管4 支,2 支为测定管,另2 支为对照管,依次加入1.5 mL 50 mmol/L磷酸缓冲液、0.3 mL 130 mmol/L甲硫氨酸溶液、0.3 mL 750 µmol/L氮蓝四唑(nitroblue tetrazolium,NBT)溶液、0.3 mL 100 µmol/L EDTA-2Na溶液、0.3 mL粗酶液,最后加入0.3 mL 20 µmol/L核黄素。其中对照组的2 支管以缓冲液代替酶液,混匀后将1 支对照管置于暗处,其他各管于4 000 Lux日光灯下反应15 min。至反应结束后,以暗处对照作空白参比,于560 nm波长处分别测定其他各管的吸光度。以每毫克蛋白抑制NBT光化还原的50%为一个酶活力单位(U/mg)。
过氧化物酶(peroxidase,POD)活力的测定参照Bradford[15]方法。取冷冻组织3 g,加入5 mL 4 ℃预冷的50 mmol/L磷酸缓冲液(pH 5.9,含0.5 g/100 mL PVPP),冰浴下充分研磨成匀浆,在4 ℃ 11 250 r/min下离心20 min,上清液立即用于POD活力测定。反应体系包括:2.5 mL 25 mmol/L愈创木酚、200 μL 250 mmol/L H2O2和200 μL上清液,加入上清液15 s后用酶标仪开始记录反映体系在470 nm波长处的吸光度变化,连续测定2 min,以每分钟吸光度变化0.01为一个POD活力单位(U),酶活力单位为U/mg。
多酚氧化酶(polyphenol oxidase,PPO)活力的测定参照Li Yongcai等[12]的方法。取冷冻组织3 g,加入3 mL pH 7.5的50 mmol/L的磷酸提取缓冲液(内含4 g/100mL PVPP、1 mmon/L聚乙二醇、1 mmol/L苯甲基磺酰氟、体积分数0.01 % Triton X-100),冰浴条件下研磨成匀浆,4 ℃、15 000×g离心20 min,取上清液为粗酶液。反应体系包括:2 mL pH 7.5的磷酸缓冲液、100 μL粗酶提取液。空白组不加酶液,其余同反应体系。以每分钟内吸光度变化0.01为1 个活力单位(U),酶活力单位为U/mg。
1.3.5 木质素、总酚及类黄酮含量的测定
木质素含量的测定参照Yin Yan等[16]方法。取冷冻组织3 g,在预冷的5 mL 、体积分数95%乙醇溶液中研磨成匀浆状,然后4 ℃、14 000×g离心30 min,弃去上清液,将沉淀物用体积分数95%乙醇溶液冲洗3 次,再用乙醇-正己烷(1∶2,V/V)溶液冲洗3 次,再次收集沉淀在60 ℃烘箱中干燥24 h,将干燥物转移至离心管中,溶于1 mL溴化乙酰-冰醋酸(1∶4,V/V)溶液,70 ℃恒温水浴30 min,最后加入1 mL 2 mol/L NaOH溶液终止反应。再加2 mL冰醋酸和0.1 mL 7.5 mol/L羟胺盐酸溶液,离心,取上清液0.5 mL,用冰醋酸定容至5 mL,在280 nm波长处测定吸光度,重复3 次。木质素含量以A280nm表征,以鲜质量计。
总酚及类黄酮含量的测定参照Yin Yan等[16]方法。取冷冻组织3 g,于预冷的 5 mL体积分数1%盐酸-甲醇溶液中,冰浴研磨成匀浆,然后于4 ℃下12 000×g离心30 min,收集上清液分别于280、325 nm波长处测定吸光度。总酚与类黄酮含量分别以A280nm和A325nm表征,以鲜质量计。
上述各项测定均做3 次重复。
1.4 数据统计与分析
全部数据用Excel 2007软件计算平均值和标准差,用SPSS 19.0进行Duncan’s多重差异显著性分析及相关性分析。
2 结果与分析
2.1 BTH处理对梨果实愈伤期间质量损失率和发病率的影响


图1 BTH处理对愈伤期间梨果实质量损失率(A)和发病率(B)的影响Fig. 1 Effect of BTH treatment on weight loss rate (A) and decay incidence (B) of pear fruits during wound healing
由图1可知,愈伤期间,对照组和BHT处理组果实的质量损失率均逐渐升高,虽然BHT处理组果实的质量损失率始终低于对照组,但无显著差异。对照组和BHT处理组果实的发病率随愈伤时间的延长而逐渐降低,但BTH处理组果实的发病率明显低于对照组,第4天时,BTH处理组果实的发病率仅为对照组的40%,第6天时,处理组果实的发病率已降至13%,而对照组果实的发病率仍高达34%(图1B)。
2.2 BTH处理对愈伤期间梨果实PAL、SOD、POD、PPO活力的影响
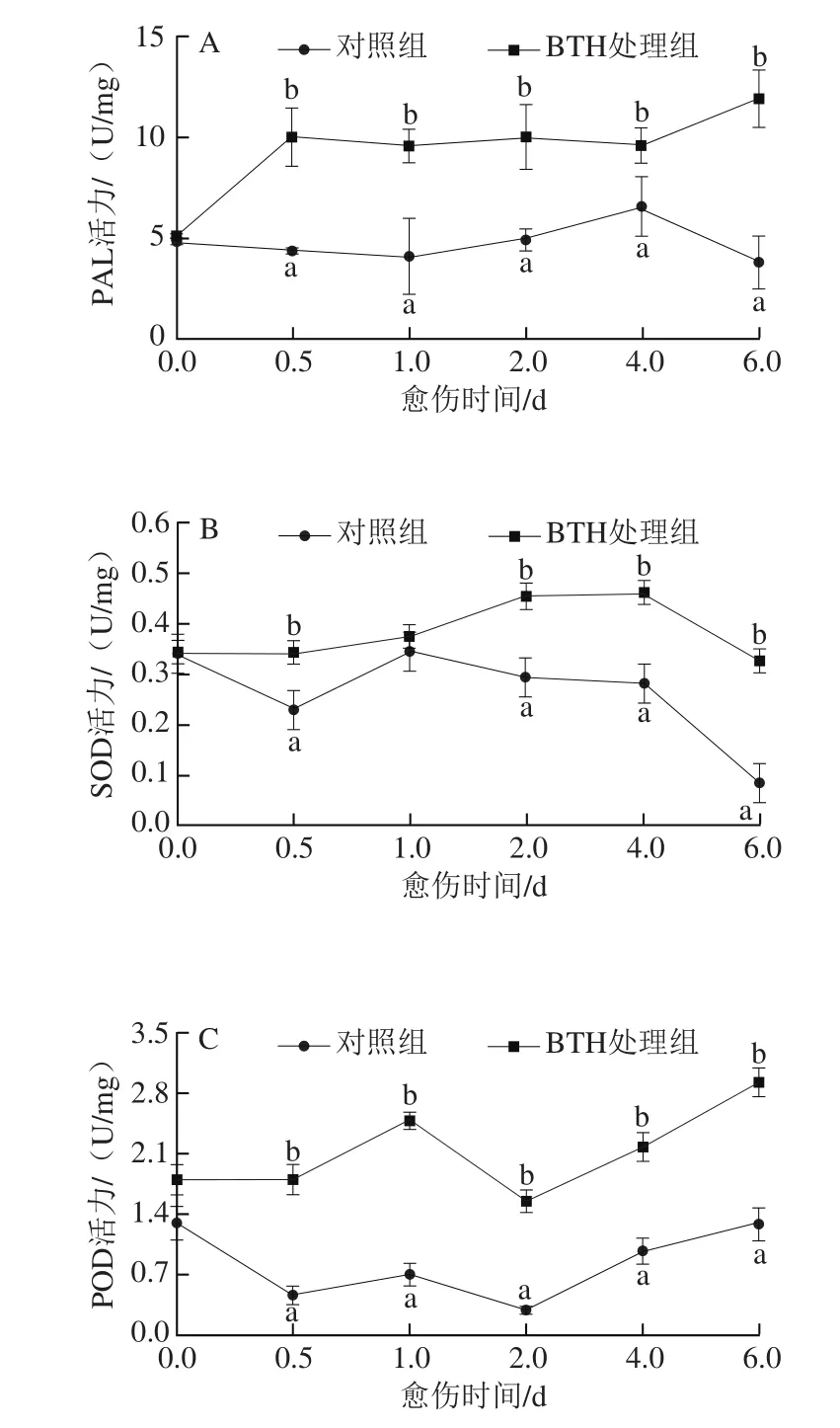
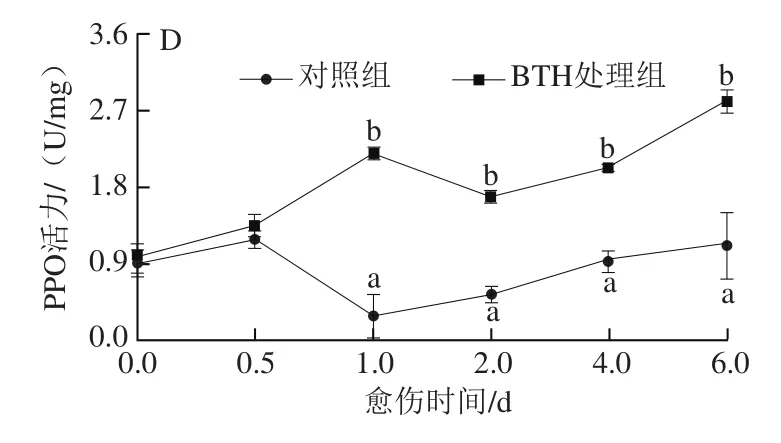
图2 BTH处理对梨果实愈伤期间PAL(A)、SOD(B)、POD(C)及PPO(D)活力的影响Fig. 2 Effect of BTH treatment on PAL (A), SOD (B), POD(C) and PPO (D) activities in pear fruits during wound healing
由图2A可知,愈伤期间,对照组梨果实的PAL活力除在第4天稍有升高外,其他时间基本保持平稳。而BTH处理组梨果实的PAL活力在0.5 d内快速升高,之后保持平稳,4 d之后又开始上升。BTH处理组梨果实的PAL活力在愈伤期间始终明显高于对照组,且在第0.5天和第6天时,分别高于同期对照组1.29 倍和2.16 倍。对照组梨果实的SOD的活力则整体呈降低趋势,处理组梨果实的SOD活力在愈伤期间先升高后降低(图2B),处理组梨果实的SOD活力始终高于对照组,在第0.5天和第6天时,分别高出同期对照组50%和2.8 倍。处理组梨果实的POD活力在愈伤期间逐渐升高,对照组果实则是先降低后升高(图2C),愈伤1 d后处理组果实的POD活力始终高于对照组,第1天和6天时,分别高出同期对照组2.5 倍和1.3 倍。处理组梨果实中的PPO活力在愈伤期间总体呈升高的趋势,对照组梨果实则出现先升高后降低再升高的趋势(图3D),处理组梨果实的PPO活力始终高于对照组,在第1天和第6天时,分别高出同期对照组6.4 倍和3.1 倍。
2.3 BTH处理对梨果实愈伤期间的总酚、类黄酮和木质素含量的影响
总酚含量先上升后维持稳定,处理组梨果实的总酚含量在0.5 d后整体高于对照组,第1天和第6天时,分别比同期对照组高19.0%和19.8%(图3A)。愈伤前期处理组和对照组梨果实中的类黄酮含量均迅速升高,0.5 d后对照组梨果实的类黄酮含量开始下降并保持平稳,处理组梨果实则持续上升,且至第4天达到峰值,第1天和第4天时,处理组梨果实的类黄酮含量分别高于同期对照组63%和94%(图3B)。对照组梨果实的木质素含量在愈伤后期则基本保持稳定,处理组梨果实的木质素含量在愈伤前期迅速升高后保持平稳,至第4天达到峰值,处理组梨果实的含量始终高于对照组(图3C),在第0.5天和第4天时,分别高出同期对照组1.4 倍和75%。
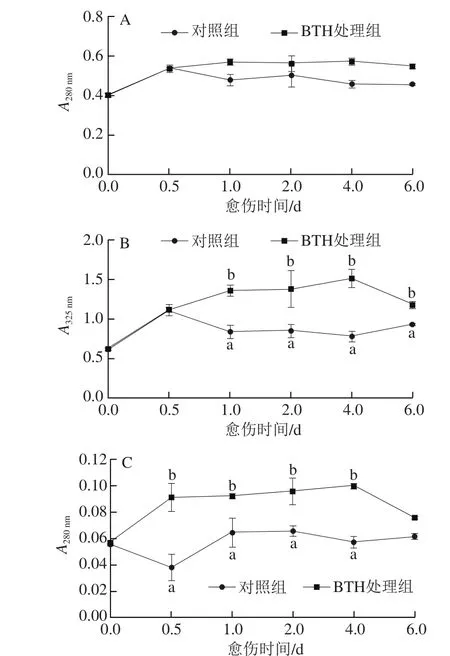
图3 BTH处理对梨果实愈伤期间总酚(A)、类黄酮(B)和木质素(C)含量的影响Fig. 3 Effect of BTH treatment on the contents of total phenols (A),flavonoids (B) and lignin (C) in pear fruits during wound healing
2.4 BTH处理后梨果实发病率和相关指标的相关性
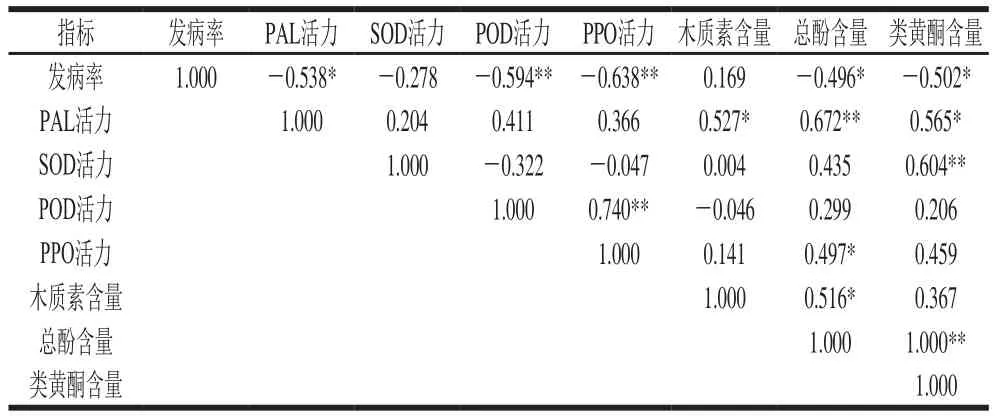
表1 BTH处理后梨果实发病率和相关指标的相关性分析Table 1 Correlation between BTH treatment and related parameters of pear fruits
由表1可见,处理梨果实的发病率和PAL活力、总酚含量、类黄酮含量之间均呈显著负相关,相关系数分别为0.538、0.496、0.502。由此表明,BTH处理通过提高PAL活力激活了苯丙烷代谢,从而促进了梨果实愈伤,且抑菌物质总酚、类黄酮在抑制梨果实发病率方面起到了重要的作用。处理组梨果实的发病率与POD和PPO活力之间呈极显著负相关,相关系数分别是0.594、0.638。由此表明,POD及PPO在促进愈伤物质聚合及形成抗菌物质方面发挥了重要作用。
3 讨 论
作为水杨酸的类似物,BTH可诱导多种果蔬的采后抗病性[6]。本研究发现,BTH可通过活化苯丙烷代谢关键酶PAL,促进代谢产物总酚、类黄酮和木质素的积累,提高POD和PPO的活力来促进梨果实的愈伤和降低采后病害的发生。
苯丙烷代谢在植物愈伤中具有重要作用[17-18]。PAL是苯丙烷代谢途径的关键酶,催化L-苯丙氨酸生成反式肉桂酸[19],伤口部位PAL的活力提高可促进酚类物质的积累,酚类物质不仅可抑制病原菌通过伤口侵染果实[20],又可参与愈伤组织的形成,抵御病原菌的侵入[21-22]。酚类物质是合成木质素的前体,木质素是由肉桂醇、咖啡醇和芥子醇等木质素单体聚合而成的致密复合物,是构成愈伤组织的主要成分,总酚和木质素含量的增加可促进伤口修复。此外,愈伤还会诱导细胞分化形成特定的愈伤组织,从而使健康组织与受损位部位隔离,形成抵御外界病原物侵染的物理屏障[23-24]。类黄酮则是重要的植保素,在抑制病原物的扩展中发挥了重要作用,类黄酮的产生速率和积累量常作为植物抗病性强弱的重要指标[25]。本研究中发现的BTH处理提高了梨伤口组织中苯丙烷代谢关键酶活力的结果与前人采用BTH诱导鸭梨果实采后抗病性提高的结果[7]基本一致。
SOD是生物体内唯一可以清除超氧阴离子的酶,可将超氧阴离子歧化为H2O2,而H2O2则参与了愈伤组织形成中细胞壁成分的氧化交联,通过氧化交联才可在伤口表面形成一层物理屏障,从而阻止水分的蒸发和防止病原物的侵入[26]。本研究中,BTH处理诱导了SOD活力的升高,增强其抗病性,该结果与Sparla等[27]采用水杨酸处理增强梨果实SOD活力的结果基本一致。PPO是广泛存在于植物体内的氧化酶类,能催化多酚类物质氧化为醌类化合物[28],醌对病原菌具有很高的毒性,可直接抑制病原菌的生长[29]。POD既是重要的抗氧化酶类,也是催化木质素单体聚合形成木质素的关键酶,在愈伤组织的形成中具有关键作用。伤口部位POD的活力与愈伤组织的形成之间密切相关[30]。本研究中发现的BTH处理诱导了梨果实POD活力升高的结果与前人采用BTH诱导苹果果实POD活力升高的结果[8]基本一致。
4 结 论
采后BTH处理可显著促进梨果实的愈伤和降低采后病害的发生。该作用机理与激活苯丙烷代谢关键酶PAL活力,提高代谢产物总酚、类黄酮和木质素的含量密切相关。此外,BTH处理还提高了SOD、POD和PPO 3 种抗氧化酶的活力,这些酶活力的提高与H2O2供应、细胞壁成分的氧化交联和抗菌物质的积累密切相关。
参考文献:
[1] YU T, WU G P, QI J J, et al. Improved control of postharvest blue mold rot in pear fruit by a combination of Cryptococcus laurentii and gibberellic acid[J]. Biological Control, 2006, 39(2): 128-134.DOI:10.1016/j.ijfoodmicro.2007.02.005.
[2] LI Y C, BI Y, AN L Z. Occurrence and latent infection of Alternaria rot of Pingguoli pear (Pyrus bretschneideri Rehd. cv. Pingguoli) fruits in Gansu, China[J]. Journal of Phytopathology, 2007, 155(1): 56-60.DOI:10.1111/j.issn.439-0434.2006.01202.x.
[3] VISHWANATH S J, DELUDS C, DOMERGUE F, et al. Suberin:biosynthesis, regulation, and polymer assembly of a protective extracellular barrier[J]. Plant Cell Reports, 2015, 34(4): 573-586.DOI:10.1007/s00299-014-1727-z.
[4] SPOTTS R A, SANDERSON P G, LENNOX C L, et al. Wounding,wound healing and staining of mature pear fruit[J]. Postharvest Biology and Technology, 1998, 13(1): 27-36. DOI:10.1016/S0925-5214(97)00079-3.
[5] SHAO X F, TU K, TU S, et al. Effects of heat treatment on wound healing in Gala and Red Fuji apple fruits[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4303-4309. DOI:10.1021/jf904273m.
[6] 葛永红, 毕阳, 李永才, 等. 苯丙噻重氮(ASM)对果蔬采后抗病性的诱导及机理[J]. 中国农业科学, 2012, 45(16): 3357-3362.DOI:10.3864/j.issn.0578-1752.2012.16.015.
[7] CAO J K, JIANG W B, HE H. Induced resistance in Yali pear(Pyrus bretschneideri Rehd.) fruit against infection by Penicillium expansum by postharvest infiltration of acibenzolar-S-methyl[J].Journal of Phytopathology, 2005, 153(11/12): 640-646. DOI:10.1111/j.issn.1439-0434.2005.01031.x.
[8] 葛永红, 李灿婴, 朱丹实, 等. 采后BTH处理对苹果果实苯丙烷代谢和病程相关蛋白积累的增强作用[J]. 食品工业科技, 2015, 36(5):306-310. DOI:10.13386/j.issn1002-0306.2015.05.056.
[9] ROMANAZZIA G, SANZANI S M, BI Y, et al. Induced resistance to control postharvest decay of fruit and vegetables[J]. Postharvest Biology and Technology, 2016, 122: 82-94. DOI:10.1016/j.postharvbio.2016.08.003.
[10] FU Da, XIANG Hualing, YU Chen, et al. Colloidal chitin reduces disease incidence of wounded pear fruit inoculated by Penicillium expansum[J]. Postharvest Biology and Technology, 2016, 111: 1-5.DOI:10.1016/j.postharvbio.2015.07.025.
[11] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 1-176.
[12] LI Yongcai, YIN Yan, BI Yang, et al. Effect of riboflavin on postharvest disease of Asia pear and the possible mechanisms involved[J]. Phytoparasitica, 2012, 40(3): 261-268. DOI:10.1007/s12600-011-0216-y.
[13] 葛永红, 毕阳, 杨冬梅. 诱抗剂处理对“银帝”甜瓜采后粉霉病和黑斑病的抑制效果[J]. 食品科学, 2006, 27(1): 246-249. DOI:10.3321/j.issn:1002-6630.2006.01.059.
[14] VENISSE J S, GULLNER G, BRISSET M N. Evidence for the involvement of an oxidative stress in the initiation of infection of pear by Erwinia amylovora[J]. Plant Physiology, 2001, 125(4): 2164-2172.DOI:10.1104Physiologia Plantarum.125.4.2164.
[15] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254.DOI:10.1016/0003-2697(76)90527-3.
[16] YIN Yan, BI Yang, LI Yong cai, et al. Use of thiamine for controlling Alternaria alternata postharvest rot in Asian pear (Pyrus bretschneideri Rehd. cv. Zaosu)[J]. International Journal of Food Science and Technology, 2012, 47(10): 2190-2197. DOI:10.1111/j.1365-2621.2012.030.
[17] BERNARDS M A, SUSAG L M, BEDGAR D L, et al. Induced phenylpropanoid metabolism during suberization and lignification: a comparative analysis[J]. Journal of Plant Physiology, 2000, 157(6):601-607. DOI:10.1016/S0176-1617(00)80002-4.
[18] VOGT T. Phenylpropanoid biosynthesis[J]. Molecular Plant, 2010,3(1): 2-20. DOI:10.1093/mp/ssp106.
[19] 任亚琳, 毕阳, 葛永红, 等. BTH浸泡处理对厚皮甜瓜采后病害的控制及贮藏品质的影响[J]. 食品科学, 2013, 34(2): 267-272.
[20] AHUJA I, KISSEN R, BONES A M. Phytoalexins in defense against pathogens[J]. Trends in Plant Science, 2012, 17(2): 73-90.DOI:10.1016/j.tplants.2011.11.002.
[21] SHADLE G L, WESLEY S V, KORTH K L, et al. Phenylpropanoid compounds and disease resistance in transgenic tobacco with altered expression of L-phenylalanine ammonia-lyase[J]. Phytochemistry,2003, 64(1): 153-161. DOI:10.1016/S0031-9422(03)00151-1.
[22] REA G, METOUI O, INFANTINO A, et al. Copper amine oxidase expression in defense responses to wounding and Ascochyta rabiei invasion[J]. Plant Physiology, 2002, 128(3): 865-875. DOI:10.1104/pp.010646.
[23] LULAI E C, SUTTLE J C. Signals involved in tuber wound-healing[J].Plant Signaling and Behavior, 2009, 4(7): 620-622. DOI:10.4161/psb.4.7.8922.
[24] MAJOR I T, CONSTABEL C P. Molecular analysis of poplar defense against herbivory: comparison of wound and insect elicitorinduced gene expression[J]. New Phytologist, 2006, 172(4): 617-635.DOI:10.1111/j.1469-8137.2006.01877.x.
[25] STADNIK M J, BUCHENAUER H. Inhibition of phenylalanine ammonia-lyase suppresses the resistance induced by benzothiadiazole in wheat to Blumeria graminis, f. sp. tritici[J]. Physiological and Molecular Plant Pathology, 2000, 57(1): 25-34. DOI:10.1006/pmpp.2000.0276.
[26] BERNARDS M A, RAZEM F A. The poly (phenolic) domain of potato suberin: a non-lignin cell wall bio-polymer[J]. Phytochemistry,2001, 57(7): 1115-1122. DOI:10.1016/S0031-9422(01)00046-2.
[27] SPARLA F, ROTINO L, VALGIMIGLI M C, et al. Systemic resistance induced by benzothiadiazole in pear inoculated with the agent of fire blight (Erwinia amylovora)[J]. Scientia Horticulturae,2004, 101(3): 269-279. DOI:10.1016/j.scienta.2003.11.009.
[28] ŚLESAK I, ŚLESAK H, LIBIK M, et al. Antioxidant response system in the short-term post-wounding effect in Mesembryanthemum crystallinum leaves[J]. Journal of Plant Physiology, 2008, 165(2): 127-137. DOI:10.1016/j.jplph.2007.03.015.
[29] VOGT T. Phenylpropanoid biosynthesis[J]. Molecular Plant, 2010,3(1): 2-20. DOI:10.1093/mp/ssp106.
[30] ASSELBERGH B, CURVERS K, FRANCA S C, et al. Resistance to Botrytis cinerea in sitiens, an abscisic acid-deficient tomato mutant,involves timely production of hydrogen peroxide and cell wall modifications in the epidermis[J]. Plant Physiology, 2007, 144(4):1863-1877. DOI:10.1104/Physiologia Plantarum.107.099226.
